三氯生暴露加剧高脂饮食诱导的小鼠肠道和肝脏功能损伤
张鹏,郑丽洋,高会会,毛大庆,罗义,*
1. 南开大学环境科学与工程学院,天津300350 2. 南开大学医学院,天津 300071 3. 南京大学环境学院,污染控制与资源化国家重点实验室,南京 210093
三氯生(triclosan, TCS),又名三氯沙、三氯新,其作为一种抗菌剂被广泛添加到2 000多种日常生活用品,如肥皂、牙膏、化妆品、服装、家具甚至儿童玩具等[1]。由于含TCS日用品的广泛使用,TCS随着生活污水的排放已经对淡水生态系统造成了较严重的污染[2]。研究表明,残留于环境中的TCS及其代谢产物具有持久性和生物累积性,对水生生态系统平衡造成了显著影响,甚至对动物以及人类健康造成威胁[3]。越来越多的证据表明,TCS作为杀菌剂能够加速环境中细菌的进化[4],扰乱水生生物肠道菌群[5],并造成水生生物(蝌蚪和水蚤等)脂类物质代谢异常[6-7]。最近的研究发现,在人体血液、尿液甚至母乳中均可检测到一定水平的TCS[8-10],并且TCS暴露能够显著改变人体肠道菌群[11]。基于流行病学调查和动物模型的研究发现,TCS暴露与机体内分泌功能紊乱和心血管功能衰竭等不良健康反应有关[12-16],而且TCS暴露能够通过加剧肝脏组织再生和纤维化显著改变肝脏功能,甚至引起肝癌[17]。
近几年的研究表明,高脂饮食作为当前人类最重要的一种饮食方式存在诸多健康风险,其中肠道微生态紊乱与高脂饮食引起的代谢系统疾病关系密切[18],尤其是肠道菌群对于宿主肝脏生理稳态的维持意义重大。肠道内的细菌代谢物或细菌组分(如革兰氏阴性细菌细胞壁组分——脂多糖)通过门静脉直接进入肝脏,会引起肝脏低水平炎症和糖代谢紊乱,扰乱机体肝脏功能[19]。然而,目前对TCS引起的肠道菌群紊乱在机体健康中潜在风险的研究还存在不足,尤其是TCS能否影响高脂饮食引起的机体肝脏功能紊乱的证据缺乏,而这对于TCS暴露和摄入高脂饮食过多的人群具有重要意义。本研究旨在阐述TCS是否加重高脂饮食诱导的肝脏功能紊乱及其潜在的机制,首次在高脂饮食模型小鼠中证实了TCS引起的肠道菌群紊乱通过诱发肝脏炎症加剧高脂饮食诱导的肝脏功能损伤,为全面阐述TCS对机体的毒性及其使用策略的调控提供了理论依据。
1 材料与方法(Materials and methods)
1.1 主要试剂与仪器
三氯生(CAS No.: 3380-34-5),购于大连美仑生物技术有限公司,纯度>99%;组织RNA提取试剂TRIzol,购于美国Life Technologies公司;大肠杆菌DH5α感受态细胞,粪便总DNA提取试剂盒、小鼠白介素(interleukin, IL)-6 ELISA试剂盒、红细胞裂解液、蛋白酶抑制剂、组织蛋白提取裂解液(高效Ripa裂解液)、BCA蛋白定量分析试剂盒、蛋白上样缓冲液、二抗和辣根过氧化物酶显色液等购于北京索莱宝生物科技有限公司;RNA反转录试剂盒和实时荧光定量PCR(RT-qPCR)试剂盒购于宝日医生物技术(北京)有限公司;质粒DNA提取试剂盒和AT克隆试剂盒购自生工生物工程(上海)股份有限公司;小鼠脂多糖(lipopolysaccharide, LPS)ELISA试剂盒购自武汉华美生物工程有限公司;小鼠流式抗体APC-CD3、FITC-CD4和PE-CD8购自美国Biolegend公司;小鼠蛋白一抗TLR4、TNF-α和β-actin购自美国Cell Signaling Technology公司。
实时荧光定量PCR仪(瑞士Roche,LightCycler96);赛多利斯电子天平(上海赛多利斯,Secura);天能化学发光凝胶成像系统(上海天能,5200Multi);超微量分光光度计(德国Implen,N50);全波长多功能酶标仪(瑞士Tecan,M1000);流式细胞仪(美国BD,Accuri C6);全自动生化分析仪(深圳迈瑞,BS-200);离心机(德国Eppendorf,5430R)。
1.2 动物暴露实验
4~5周洁净级(specific pathogen free, SPF) C57BL/6J雄性小鼠32只,购自北京华阜康生物科技股份有限公司。小鼠饲养条件:温度22℃±1℃、湿度(50±10)%、12 h有光/12 h黑暗,自由进水和食物。高脂饲料(45% fat kJ%)和对照饲料(10% fat kJ%)购自江苏美迪森生物医药有限公司,将TCS分别均匀混入饲料制成含TCS(10 μg·g-1)的对照饲料和高脂饲料颗粒。小鼠适应性喂养一周后随机分为4组,每组8只,分别为正常饮食对照组(control)、三氯生组(TCS)、高脂饮食组(HFD)和高脂饮食加三氯生组(HFD+TCS),并随即对TCS组和HFD+TCS组喂养含TCS的对照饲料。一周后,HFD开始以高脂饲料喂养,HFD+TCS组开始喂食含TCS的高脂饲料,每周检测小鼠体质量并收集小鼠新鲜粪便,连续饲养6周。实验结束后摘眼球取血,然后颈椎脱臼处死小鼠,迅速在无菌条件下取出小鼠脾脏、结肠和肝脏等组织,用于下一步实验。
1.3 肝脏组织蛋白提取和蛋白免疫印迹分析
根据组织蛋白提取试剂盒说明,将50 mg肝脏组织在冰上剪成细小碎片,加入1 mL裂解液和适量的蛋白酶抑制剂,涡旋混匀,直至充分裂解,然后将样品在4 ℃条件下12 000g离心5 min,取部分上清进行BCA蛋白含量测定,并将其他上清与蛋白上样缓冲液混合用于Western blotting分析。取30 μg蛋白样品进行SDS-PAGE凝胶电泳(浓缩胶,65 V 30 min;分离胶,100 V 90 min),然后将胶上蛋白湿转到PVDF膜上(恒流200 mA,2 h),接着5%脱脂奶粉封闭60 min,小鼠Toll样受体4(Toll-like receptor 4, TLR4)、TNF-α和β-actin一抗孵育过夜。经TBST洗涤3次后,室温条件下孵育偶联辣根过氧化物酶(horseradish peroxidase, HRP)的二抗60 min。最后经化学发光显影液处理并使用凝胶成像系统进行拍照,利用ImageJ软件对蛋白条带进行半定量分析。
1.4 组织总RNA提取和RT-qPCR分析
使用TRIzol法提取小鼠结肠和肝脏组织总RNA,利用超微量分光光度计进行RNA含量测定。取1 μg RNA样本进行反转录获得cDNA,然后使用TB Green嵌合荧光法对cDNA样本进行靶基因检测,引物序列如表1所示。RT-qPCR的反应条件为:95 ℃预变性5 min,然后进行40个循环的95 ℃变性15 s和60 ℃延伸30 s,之后进行仪器默认的溶解曲线分析。以管家基因β-actin作为mRNA表达分析的内参,并采用2-ΔΔCT法对各处理组靶基因进行相对定量分析[20]。
1.5 粪便菌群绝对定量
通过AT克隆的方法构建含小鼠厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)和肠杆菌科(Enterobacteriaceae)特征序列的质粒载体,然后转入到DH5α感受态细胞,挑选阳性克隆扩增培养,然后提取质粒DNA,并使用超微量分光光度计进行质粒DNA含量测定,并计算出质粒拷贝数,通过RT-qPCR方法确定每种靶标菌序列CT值和拷贝数之间的标准曲线,然后再对粪便菌群DNA进行RT-qPCR方法分析,最后计算出各类肠道菌在粪便样本中的拷贝数。公式如下:
式中:PCN为平均每个细菌的质粒拷贝数(plasmid copy number),CP为含每类菌特征序列质粒DNA的浓度(ng·μL-1),LP为含每类特征菌序列的质粒长度(bp)。
1.6 脾脏淋巴细胞分离和流式细胞分析
将分离的脾脏组织浸泡在预冷的1 mL无菌磷酸盐缓冲溶液(PBS)中,取部分脾脏组织轻轻研磨并过100目不锈钢筛网,将过滤液在4 ℃条件下400g离心10 min,取上清,加2 mL红细胞裂解液,并于37 ℃孵育2 min,然后用PBS洗2遍并去上清,收集淋巴细胞进行染色。将小鼠APC-CD3、FITC-CD4和PE-CD8抗体与淋巴细胞混匀,并于暗室中冰上孵育30 min,然后用预冷的PBS洗2遍,收集染色后的细胞并用0.1%多聚甲醛固定。最后使用流式细胞仪进行淋巴细胞分析,并使用FlowJo对各细胞系进行分析获得数据。
1.7 生化分析
通过全自动生化分析仪检测肝功能指标丙氨酸氨基转移酶(alanine aminotransferase, ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase, AST)和甘油三酯(triglyceride, TG)水平;血清IL-6含量、血清LPS和粪便LPS含量通过ELISA方法检测。
1.8 统计方法
数据处理采用Graphpad Prism 8软件的单因素方差分析(ANOVA),随后采用Turkey法进行显著性分析,并用字母标记法对各组间分析进行显著性标记。标记原则为:相同字母表示组间差异不显著,不同字母表示组间有显著性差异(P<0.05)。
2 结果(Results)
2.1 TCS暴露加重高脂饮食对小鼠的损伤
如图1(a)所示,4~5周的小鼠适应环境后使用TCS处理一周,高脂饮食再喂养小鼠6周。与对照组相比,TCS暴露7周后小鼠体质量和肝脏质量没有显著性差异;HFD组的小鼠体质量从第4周开始表现出明显的差异;而HFD和TCS一起处理小鼠的体质量在第3周就表现出明显差异。如图1(b)所示,与HFD组小鼠相比,HFD+TCS组的小鼠体质量从第4周开始明显提高。如图1(c)所示,HFD组的小鼠相对肝脏质量为(6.3±0.7)%,显著高于control组(4.3±0.1)%和TCS组(4.4±0.4)%小鼠的相对肝脏质量,但是明显低于HFD+TCS组小鼠的相对肝脏质量(8.4±0.9)% (P<0.05)。
2.2 TCS暴露扰乱肠道菌群稳态
如图2(a)所示,与对照组相比,单独TCS暴露能够降低粪便中厚壁菌门(Firmicutes)和拟杆菌门(Bacteroides)肠道菌的含量,增加肠杆菌科(Enterobacteriaceae)肠道菌的含量;与TCS组和HFD组相比,HFD和TCS联合处理进一步降低了粪便中厚壁菌门和拟杆菌门肠道菌的含量,增加了肠杆菌科肠道菌的含量。如图2(b)所示,HFD+TCS组小鼠单位质量粪便(g)中LPS的含量显著高于其他处理组。

表1 RT-qPCR引物序列Table 1 Gene-specific primer sequences used for RT-qPCR

图1 TCS暴露加重高脂饮食对小鼠体质量和肝脏的影响注:(a)实验流程图,(b)实验过程中小鼠体质量变化曲线图,(c)实验结束时小鼠相对肝脏质量(肝脏质量/体质量);数据表示为平均值±标准差 (mean±SD),每组8只小鼠,图中不同字母代表存在组间显著性差异(P<0.05),图(b)中#(P<0.05)和##(P<0.01)表示在不同喂养时间处理组与 对照组相比存在显著性差异,*(P<0.05)和**(P<0.01)表示在不同喂养时间HFD+TCS组与HFD组相比存在显著性差异。Fig. 1 TCS exposure exaggerates the effects of high fat diet on body mass and liver in miceNote: (a) the schedule of the experiment, (b) the curve of body mass change of mice during the experiment, (c) the relative liver mass of mice (liver mass/body mass); the data are expressed as mean±SD of eight mice; different letters indicate the significant differences between groups (P<0.05), # (P<0.05) and ## (P<0.01) indicate the significant difference between the control group and other groups, and *(P<0.05) and **(P<0.01) indicate the significant difference between the HFD group and HFD+TCS group.

图2 TCS暴露扰乱小鼠肠道菌群注:(a)单位质量(g)小鼠粪便中厚壁菌门、拟杆菌门和肠杆菌科肠道菌的拷贝数,(b)单位质量(g)粪便中细菌脂多糖的含量; 数据表示为平均值±标准差(mean±SD),n=5,不同字母代表存在组间显著性差异(P<0.05)。Fig. 2 TCS exposure disturbed the gut microbiotaNote: (a) the copy numbers of Firmicutes, Bacteroides and Enterobacteriaceae per gram of feces, (b) the lipopolysaccharides (LPS) contents per gram of feces; the data are expressed as mean±SD, n=5; different letters indicate the significant differences between groups (P<0.05).
2.3 TCS暴露加重高脂饮食诱导的肠道屏障损伤
如图3(a)所示,H&E染色结果表明,TCS组和HFD组小鼠表现出一定程度的肠道损伤,而HFD+TCS组小鼠结肠损伤程度明显高于TCS组和HFD组;HFD+TCS组小鼠结肠组织病理学评分显著高于其他组。为进一步探究TCS和HFD对小鼠肠道屏障功能的影响,本研究检测了紧密连接蛋白基因ZO-1、Occludin和粘蛋白MUC2在mRNA水平上的相对表达量。如图3(b)~(d)所示,与对照组、TCS组和HFD组相比,TCS+HFD组小鼠肠道组织中紧密连接蛋白基因ZO-1、Occludin和粘蛋白MUC2的表达都出现显著降低的趋势。肠道屏障损伤的加剧可导致LPS从肠腔异位到血液循环系统[21],如图3(e)所示,HFD+TCS组小鼠血清中LPS的含量显著高于其他组;而TCS组和HFD组小鼠的LPS含量与对照组没有显著性差异。
2.4 TCS暴露加重HFD引起的免疫紊乱
如图4所示,TCS和HFD引起了机体免疫变化。

图3 TCS暴露加重高脂饮食诱导的肠道屏障损伤注:(a)末端结肠组织的H&E染色(左)和组织学评分(右), (b)结肠组织中基因ZO-1的相对表达量,(c)结肠组织基因Occludin的相对表达量,(d)结肠组织中基因MUC2的相对表达量, (e)小鼠血清中LPS水平;图中数据表示为平均值±标准差(mean±SD),n=5;图中不同字母代表存在组间显著性差异(P<0.05)。Fig. 3 TCS exposure aggravates intestinal barrier damage induced by high fat dietNote: (a) representative H&E-stained colon sections (Left) and histological score (Right), (b) gene expression of ZO-1 in colon, (c) gene expression of Occludin in colon, (d) gene expression of MUC2 in colon, (e) concentration of LPS in serum; the data are expressed as mean±SD, n=5; different letters indicate the significant differences between groups (P<0.05).
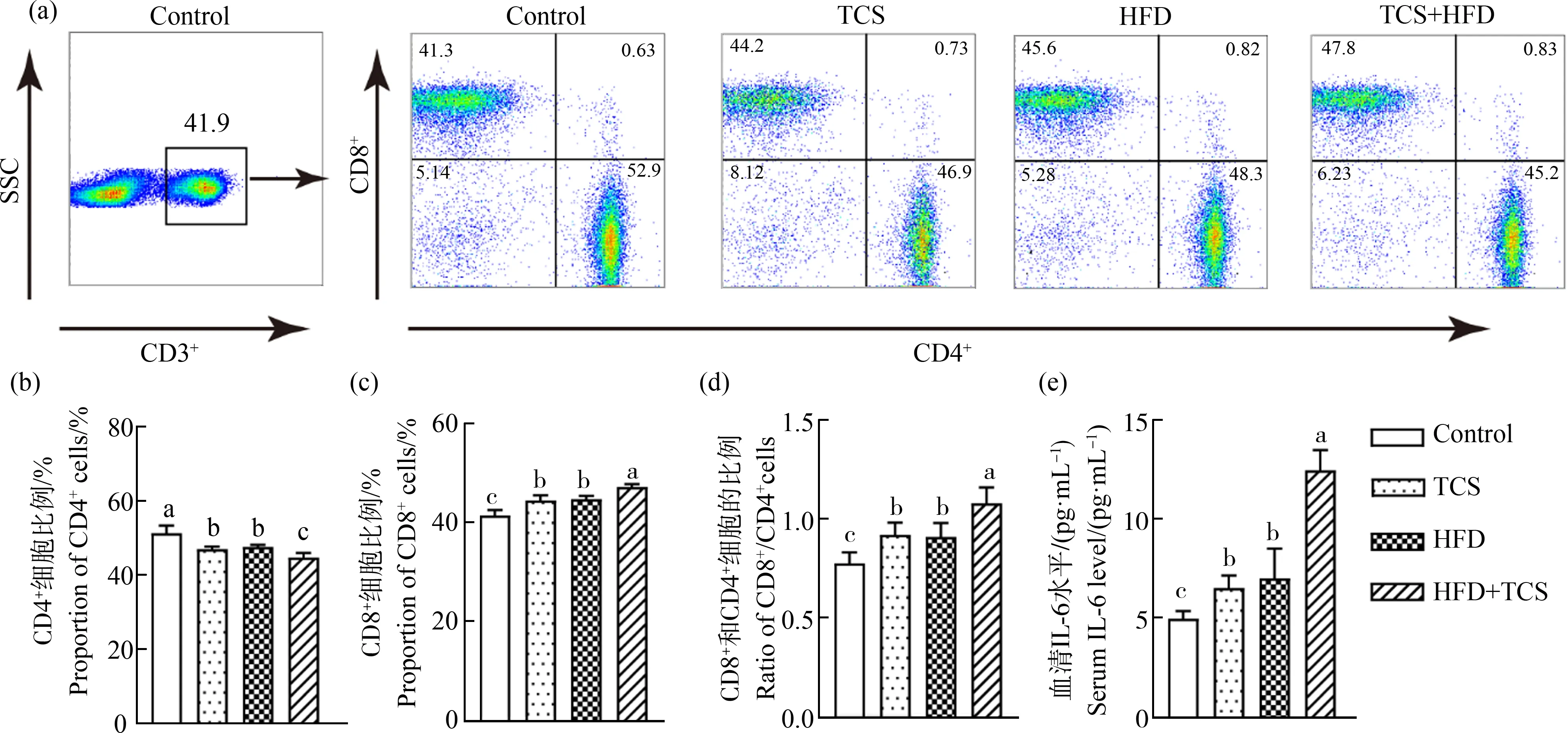
图4 TCS暴露加重高脂饮食引起的机体免疫紊乱注:(a)小鼠脾脏中CD3+ T细胞群中CD4+和CD8+ T细胞亚群的分群状况,(b) CD3+CD4+ T细胞亚群占CD3+ T细胞群的比例, (c) CD3+CD8+ T细胞亚群占CD3+ T细胞群的比例,(d) CD3+ T细胞群中CD8+和CD4+ T细胞亚群的比例, (e)小鼠血清中IL-6水平;图中数据表示为平均值±标准差(mean±SD),n=5;图中不同字母代表存在组间显著性差异(P<0.05)。Fig. 4 TCS exposure aggravates immune disorders induced by high fat dietNote: (a) the cluster profiles of CD4+ and CD8+ subgroup T cells in CD3+ T cells of murine spleen, (b) the proportion of CD3+CD4+ T cells in CD3+ T cells, (c) the proportion of CD3+CD8+ T cells in CD3+ T cells, (d) the ratio of CD4+ to CD8+ subgroup T cells in CD3+ T cells, (e) the serum IL-6 level; the data are expressed as mean±SD, n=5; different letters indicate the significant differences between groups (P<0.05).
与对照组相比(图4(a)~(d)),TCS组和HFD组小鼠脾脏中CD3+CD4+T细胞比例显著降低,CD3+CD8+T细胞的比例明显提高。与HFD组相比,HFD+TCS组小鼠的机体免疫进一步紊乱,CD3+T细胞群中CD4+T细胞的比例明显降低,而CD8+T细胞在CD3+T细胞群中的比例以及CD8+T细胞相对CD4+T细胞的比例明显提高(P<0.05)。如图4(e)所示,与对照组相比,TCS和HFD处理显著提高了小鼠血清IL-6水平;而HFD+TCS组小鼠血清中的IL-6水平明显高于TCS组或HFD组(P<0.05)。IL-6作为重要的炎症介质,对机体细菌感染和炎症有重要意义。
2.5 TCS暴露加重HFD引起的肝脏功能紊乱
如图5(a)~(c)所示,与对照组相比,TCS处理轻微提高了小鼠血液中ALT、AST和TG的水平,但是不存在显著性差异(P>0.05);HFD处理显著提高了小鼠ALT、AST和TG水平(P<0.05)。此外,HFD+TCS组小鼠的ALT、AST和TG水平明显高于HFD组(P<0.05),表明TCS处理能够加重HFD引起的肝脏功能紊乱。
TCS暴露明显提高了HFD处理小鼠血清中LPS含量,而LPS能够激活肝脏炎症反应加重肝脏损伤。如图6(a)所示,与对照组相比,TCS和HFD处理没有激活肝脏中TLR4和TNF-α蛋白的表达,而TCS和HFD协同处理显著提高了肝脏中TLR4蛋白和TNF-α蛋白的表达(P<0.05)。如图6(b)所示,与对照组相比,TCS处理没有改变肝脏中炎症因子IL-1β和IL-6及抗炎因子IL-10的基因表达;而HFD显著提高了肝脏中IL-1β和IL-6的基因表达,并降低了IL-10的基因表达(P<0.05)。与HFD组相比,TCS和HFD协同暴露显著提高了炎症因子IL-1β和IL-6的表达,并进一步降低了抗炎因子IL-10的基因表达(P<0.05)。
3 讨论(Discussion)
本研究分析了TCS和HFD对小鼠肠道菌群、肠道屏障功能、机体免疫以及肝脏功能的影响。结果显示,TCS处理引起肠道菌群紊乱和粪便LPS升高,通过受损的肠道屏障造成LPS异位到血液循环系统,加剧了HFD引起的肝脏功能紊乱。
目前,TCS的毒性作用机制还没有被完全阐明,然而不断有研究表明,TCS暴露能够引起水生生物,哺乳动物甚至人体肠道菌群的紊乱[22-24]。有研究发现,环境相关浓度(environmentally relevant concentrations)约0.35~3.45 nmol·L-1TCS暴露使黑头软口鲦(Pimephalespromelas)肠道菌群多样性显著降低[25]。由于含TCS日用品废弃物的大量排放导致淡水生态系统中TCS污染严重,甚至某些地区TCS成为河流中排名前十的污染物[26],因此TCS对水生生态系统平衡有不可忽视的负面影响。随着研究深入,TCS暴露对水生生物代谢方面的影响不断被揭示,其中环境相关浓度TCS暴露能够显著影响非洲蟾蜍(Xenopustropicalis)肝脏代谢和机体免疫[27-28],尤其是对正常肝脏脂代谢功能的损伤表明TCS暴露有导致非酒精性脂肪性肝病的风险。此外,利用斑马鱼作为研究对象,TCS同样对机体脂代谢过程有一定影响[29]。本研究发现,TCS暴露能够引起小鼠肠道菌群紊乱,降低肠道中厚壁菌门和拟杆菌门等肠道共生菌的含量,并造成一定程度的肠道损伤,但是并没有导致显著的小鼠肝脏功能改变。
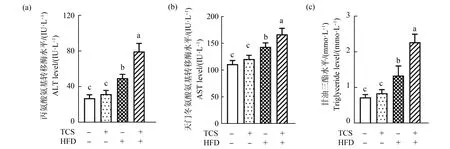
图5 TCS暴露加重高脂饮食引起的肝脏功能紊乱注:(a)小鼠血清中丙氨酸氨基转移酶水平,(b)小鼠血清中天门冬氨酸氨基转移酶水平;(c)小鼠血清中甘油三酯水平; 图中数据表示为平均值±标准差(mean±SD),n=5;图中不同字母代表存在组间显著性差异(P<0.05)。Fig. 5 TCS exposure aggravates liver function disorders induced by high fat dietNote: (a) the alanine aminotransferase (ALT) levels in mice serum, (b) the aspartate transaminase (AST) levels in mice serum, (c) the triglyceride levels in mice serum; the data are expressed as mean±SD, n=5; different letters indicate the significant differences between groups (P<0.05).

图6 TCS暴露通过炎症反应加重高脂饮食诱导的肝脏功能紊乱注:(a)肝脏组织中TLR4和TNF-α蛋白的表达水平,(b)肝脏组织炎症因子IL-1β和IL-6及抗炎因子IL-10的基因表达水平; 图中数据表示为平均值±标准差(mean±SD),n=5;图中不同字母代表存在组间显著性差异(P<0.05)。Fig. 6 TCS exposure aggravates liver function disorders induced by high fat diet via inflammatory responsesNote: (a) the protein expression of TLR4 and TNF-α in liver tissues, (b) the gene expression of pro-inflammation cytokines of IL-1β and IL-6 and anti-inflammation cytokines IL-10 in liver tissues; the data are expressed as mean±SD, n=5; different letters indicate the significant differences between groups (P<0.05).
高脂饮食摄入是当前普通人群肥胖的主要诱因,其中高脂饮食主要通过影响肝脏脂肪代谢加剧机体负担,甚至诱发多种慢性疾病[30]。虽然高脂饮食损伤肝脏正常生理功能是一个相对缓慢的过程,但是不断有研究表明,多种环境污染物(如多氯联苯和有机磷农药等)能够加速这个过程,进而造成严重的机体负担[31-33]。进一步的毒理学研究发现,除了此类环境污染物对肝脏的直接毒性外,肝脏作为机体最重要的解毒和异生质转化器官,缺乏对大多数环境污染物的直接代谢机制而造成异生质的累积也是造成肝脏功能紊乱的重要原因[34]。然而,越来越多的研究表明,肠道菌群在机体健康中发挥重要作用,同时大多数环境污染物引起的肠道菌群变化及其对机体健康的影响也不断被阐明[35-36]。高脂饮食能够引起小鼠肠道菌群紊乱和机体免疫响应,造成小鼠血液中AST、ALT和TG含量明显升高,进而导致肝脏功能异常。本文的研究结果表明,TCS暴露能够显著提高HFD暴露小鼠血液中AST、ALT和TG水平,加重小鼠的肝脏功能损伤。
本研究中,为了探讨TCS引起的肠道菌群变化的作用,在喂养高脂饮食前一周开始TCS处理,最终引起小鼠肠道菌群中厚壁菌门和拟杆菌门肠道菌的含量显著降低,这与之前的研究结果一致[37]。此外我们还发现TCS暴露极大地提高了HFD饲养小鼠肠道中肠杆菌科丰度和粪便LPS含量,这可能导致肠道菌群致病潜能的增加[38]。由于肠杆菌科细菌的丰度增加与代谢系统疾病和炎症性肠病密切相关[39-40],已经有研究将肠道中肠杆菌科作为一种可能的疾病微生物特征[41]。其中,肠杆菌科细菌的过度生长首先会引起肠道炎症,损伤肠道屏障功能,导致肠道菌群及其产物(如LPS等)异位到血液循环系统中,使机体处于炎症状态。低浓度TCS(约8~10 μg·g-1饲料)暴露3周能够引起小鼠轻微的肠道炎症响应[42],而相似浓度TCS暴露8个月后引起明显的小鼠肝脏纤维化甚至肝癌[43]。在我们的研究中,TCS(10 μg·g-1饲料)处理7周后引起了机体免疫反应,但是没有引起明显的肝脏炎症和肝脏功能改变;尽管如此,TCS处理显著增强了高脂饮食对小鼠肝脏功能的损伤,其中血液中累积的LPS通过TLR4途径激活的肝脏炎症反应可能发挥重要作用。该研究为全面了解TCS的毒性以及其通过扰乱肠道菌群加重HFD对机体肝脏功能损伤的机制提供了借鉴,同时为探索众多环境污染物对机体健康的影响提供了思路。

