海洋无脊椎动物重金属富集研究进展
张柏豪,方舟,2,3,4,5,*,陈新军,2,3,4,5,王丛丛,2,3,4,5
1. 上海海洋大学海洋科学学院,上海 201306 2. 大洋渔业资源可持续开发教育部重点实验室,上海 201306 3. 国家远洋渔业工程技术研究中心,上海 201306 4. 农业农村部大洋渔业开发重点实验室,上海 201306 5. 农业农村部大洋渔业资源环境科学观测实验站,上海 201306
重金属污染物具有强毒性、耐还原性和耐降解性等特点[1],在进入生物体后会与生物体的蛋白质、酶等物质结合或发生反应,产生毒性更强,更难以降解的物质,通过食物链的生物放大作用,最终在高营养级生物和人类体内富集[2-3],在影响生态环境的同时[4],也会引发公害事件[5]。重金属污染物通过陆源、空源等途径吸附、络合在富含有机物和营养盐的海水和海洋沉积物中[6],对海洋初级生产力及海洋生物活动有着重要影响[7-8]。因此,海水和海洋沉积物被视为海洋生物体内污染物富集的重要来源[9]。已有研究表明,能够对海洋生物和人体造成严重影响的重金属主要有Hg、Cd、Pb以及类金属As等[10-11],这些元素也是我国对食用水产品进行“有毒有害物质限量”检测的重要指标[12]。
海洋无脊椎动物作为海洋食物网重要组成部分,处于生态系统中的底层,营养级普遍低于大型鱼类等其他海洋生物[13],且大部分物种栖息于海洋沉积物底内或底表,具有移动性弱、区域性强的特点,因此受到重金属污染的风险较高。海洋无脊椎动物重金属富集特征受到包括栖息环境、生理结构因素、生活习性差异、不同个体差异、重金属化学性质及形态的影响[14-15],导致海洋无脊椎动物体内重金属富集程度、器官分布等多个特征存在区别[16-18]。由于海洋无脊椎动物中的贝类、甲壳类和头足类等是重要的渔业资源,同时也是一些高营养级渔业资源生物重要的食物来源,近年来围绕海洋无脊椎动物的研究日渐增多,研究结果也受到各界的广泛关注,因此分析海洋无脊椎动物不同物种、个体和组织对重金属的富集特征,有助于了解重金属在海洋食物网、海洋环境中的传递特征。本文总结了近年来关于重金属在海洋无脊椎动物中富集情况的研究进展,并对未来的研究方向进行展望,希望能够为相关研究提供参考依据。
1 近年来发表文献概况(Analysis of papers published in recent years)
1.1 文献数量年度变化
利用Web of Science数据库作为分析数据源,检索式为“TS=(“heavy metal*”)AND TS=(“bioaccumulation”)AND TS=(“marine invertebrate*”),年份区间为1995—2020年,通过对结果进行扩展和精炼,最终共检索到文献1 250篇。根据发文年份对结果进行分类,历年发文情况如图1所示。由图1可知,发文量在年间存在一定的波动,整体成不断上升趋势。自2009年开始,论文数呈现快速增长的趋势,2018年达到峰值119篇,2009—2020年年均发表论文数量为87篇。证明随着对重金属以及海洋研究的重视,关于海洋无脊椎动物重金属富集的研究已逐渐成为热点。
1.2 关键词共现分析
利用知识图谱对科学知识点进行描述,表明了不同知识领域之间的联系,有助于显示科学知识的发展过程与结构关系[19-20]。以海洋无脊椎动物重金属富集为例,学者对海洋无脊椎动物重金属富集的研究侧重点不同,一部分研究主要是根据海洋无脊椎生物体内重金属浓度判断是否可以安全食用,另一部分研究主要是讨论海洋无脊椎动物作为环境指示物的可行性;同时科学家们的研究重点在不同时期也会有所不同。利用关键词共现分析(co-word analysis)的方法,以涉及海洋无脊椎动物重金属富集研究的文献关键词为指标,得到关键词共现知识图谱(analysis map of keywords co-occurrence)(图2)。数据来源是Web of Science核心数据库,检索式为“TS=(“heavy metal*”)AND TS=(“bioaccumulation”)AND TS=(“marine invertebrate*”),年份区间为2009—2019年。由图2可知,生物富集(bioaccumulation)出现频次最高,重金属(heavy metal)次之,之后为微量元素(trace element)。在对具体某种重金属富集现象的研究中,Cd、Hg的出现频次最多,证明这2种重金属元素被关注程度最高。从关键词所属学科领域来看,生物学、毒理学和环境科学等方面均有涉及。结果表明,海洋无脊椎动物作为重金属富集的研究对象,与多个领域的研究关键词联系十分密切。

图1 海洋无脊椎动物重金属富集研究论文 年度变化趋势(截至2020年9月)Fig. 1 Annual changes of bibliographic records of heavy metal bioaccumulation in marine invertebrates (until September 2020)
1.3 关键词突变检测
根据突变理论[21],若一个关键词在某段时间内被引频次激增,则表明这个关键词所涉及的研究领域可能是新的研究方向,即研究前沿。通过对关键词进行突变检测,可以找到在某个时期内关于海洋无脊椎动物重金属富集研究的前沿热点,在该段时间内受学者关注程度的高低可通过突变强度来表明[22]。对数据结果进行关键词突变检测,根据突变强度排列(表1)。

图2 关键词共现分析图谱Fig. 2 Analysis map of keywords co-occurrence
分析可知,海洋无脊椎动物重金属富集领域的研究主要分为3个方向:1)海洋污染相关的研究,如污染、暴露、生物配体模型等;2)物种富集特征相关的研究,如贝类、甲壳类、双壳纲等的研究;3)对食物网的研究,包括营养转移、食物网、生命周期等。
2 海洋无脊椎动物重金属富集特征(Bioaccumulation characteristics of heavy metal in marine invertebrates)
本综述主要涉及上述第2类研究方向,即归纳分析与物种富集特征相关的文献,以3类海洋无脊椎生物:头足类、贝类和甲壳类为代表,从暴露途径、个体特征、组织器官分布规律以及组织间转移特征几个方面来综述重金属富集在海洋无脊椎动物中的研究现状。
2.1 海洋无脊椎动物重金属污染物暴露途径
海洋无脊椎动物体内重金属浓度,很大程度上受环境中重金属污染物的影响。环境中重金属污染物通过不同的暴露途径进入海洋无脊椎动物体内是种间、种内以及不同组织器官的重金属富集浓度存在差异性的重要原因。因此分析海洋无脊椎动物体内重金属元素的来源和分布,首先需要评估海洋无脊椎动物的暴露途径。对于大多数海洋无脊椎动物来说,暴露途径主要分为3种:海水途径、沉积物途径以及摄食途径。重金属元素在环境中分散、滞留或积累的空间、物体(如水体、沉积物等)等都是海洋动物的潜在污染源[23]。同时,海洋无脊椎动物栖息环境、生活习性和摄食条件的不同会使得3种途径产生影响的比重有所差异[24-25]。Liu等[26]研究发现,我国胶州湾养殖区内的菲律宾蛤仔(Ruditapesphilippinarum)重金属浓度与表层沉积物、海水中重金属浓度高低密切相关,这是由于菲律宾蛤仔栖息在沉积物中,摄食方式为滤食性,在进食的过程中会摄入大量的海水和藻类。因此海水、沉积物和摄食途径均会促进菲律宾蛤仔重金属富集。且菲律宾蛤仔相较于中大型鱼类具有更小的个体尺寸,代谢更活跃,最终表现为以菲律宾蛤仔为代表的贝类生物对多种重金属元素富集能力明显强于其他物种,这点与多位学者研究结果相同[27-29]。甲壳类中的锯缘青蟹(Scyllaserrata)也存在同样的情况[30]。由于相当一部分海洋无脊椎动物均为底栖生物,该类生物的生活环境中海水与沉积物同时存在,无法区分重金属进入体内的具体途径,因此上述2种途径对该类生物重金属富集过程影响比重难以估计。但非底栖生物可以通过比较鳃和其他组织中重金属浓度来判断某种元素的主要暴露途径,若鳃中重金属浓度相较其他组织高,则可证明该种元素的主要暴露途径是海水途径[31]。
对于食物链中营养级相对较高的海洋无脊椎动物来说,摄食途径是重金属富集的最主要来源。Lacoue-Labarthe等[32]利用放射性示踪剂技术(203Hg)研究乌贼(Sepiaofficinalis)幼体经海水途径暴露和摄食途径暴露后对无机汞的吸收和净化动力学,通过比较2种途径下乌贼体内Hg的富集浓度,发现Hg主要通过摄食途径富集,约占全身富集量的77%。因此不同营养级的海洋无脊椎动物的主要暴露途径有所区别:营养级较高的生物更容易通过摄食接触重金属元素,营养级较低的底栖生物则更容易通过海水和沉积物接触重金属,营养级较低营浮游生活的海洋无脊椎动物则更易通过海水接触重金属元素。
2.2 海洋无脊椎动物种间富集特征
海洋无脊椎动物物种众多,各物种生物由于其栖息环境、生理结构和进食习性等的不同,会导致体内重金属富集浓度存在较大差异。龚倩[33]通过研究发现,同为双壳纲的3种贝类生物缢蛏(Sinonovacullaconstricta)、文蛤(Meretrixmeretrix)和泥蚶(Tegillarcagranosa)在相同条件下于1 μg·L-1Cd海水中暴露5 d后,Cd的富集浓度分别为0.15、0.44和1.43 mg·kg-1,这与这3种贝类的生活习性密切相关:虽同为埋栖型贝类,但泥蚶无水管,只能通过张开双壳靠纤毛的活动过滤摄食[34],能够直接接触到污染物;文蛤和缢蛏的习性较为类似,均具有水管结构,通过水管结构进行滤食活动[35-36],因而能够有效过滤部分的污染物,因此生理结构和摄食习性的差异可能是影响3种贝类重金属富集量的原因之一。
不同物种的头足类生物体内重金属的富集浓度差异主要与头足类生物的栖息环境和摄食习性有关,Lischka等[37]对来自东热带大西洋地区翼柄柔鱼(Sthenoteuthispteropus)体内重金属Cd、Hg等元素的浓度进行测定,同时通过计算外套膜长度和稳定同位素(δ13C和δ15N)比值,来研究翼柄柔鱼在生态食物网中的摄食生态位[38]。通过比较翼柄柔鱼与其他头足类如枪乌贼(Loligovulgaris)、双柔鱼(Nototodarussloani)、大王乌贼(Architeuthisdux)等体内的重金属Cd、Hg的浓度,发现该海域的翼柄柔鱼体内Cd浓度是所有比较物种中最高的,为747.80 mg·kg-1,这与其在食物链中的营养级呈正相关关系。这可能因为这片海域处于副热带环流和回流回旋交汇处的佛得角前缘地带[39],此海域的海洋条件使得水体中的营养物质更容易与Cd结合[40]。同时,由于翼柄柔鱼的食性广泛,摄食小型头足类如爪乌贼(Onychoteuthisbanksii)、小型鱼类如蛇鼻鱼(Myctophumaffine)以及一些甲壳类如沃氏小戎(Hyperiettavosseleri)等[41],这些生物存在一个共同特点即体内的重金属浓度相较上层捕食者高。多个因素综合作用最终导致该海域翼柄柔鱼体内重金属浓度较高。

表1 基于突变检测的热点关键词分布Table 1 Burst detection and classification of keywords
2.3 海洋无脊椎动物个体间富集特征
在大多数海洋动物中,重金属富集普遍与年龄、大小呈正相关关系[42]。李来好等[43]对不同大小规格的南美白对虾(Litopeneausvannamei)体内重金属含量进行检测,发现大规格样品体内重金属含量高于同种的小规格样品。但是Seco等[44]通过研究南大洋中8种头足类体内Hg含量的变化发现,部分头足类生物Hg浓度和年龄大小不一定存在正相关关系。部分头足类在幼年阶段更偏好摄食贝类等对Hg有强富集能力的生物,因此在幼年阶段体内Hg的富集量随着年龄增大而增大。但是在个体性成熟后会偏好摄食鱼类等体内Hg富集量较少的海洋动物,因此这类头足类体内Hg的富集量增长缓慢,甚至在体内消化腺的解毒作用下呈下降趋势,表现为随着年龄的增长体内的Hg浓度反而降低。Cd、Pb也有此类变化趋势[45-46]。而贝类生物情况较为特别,主要表现为重金属的浓度与个体大小成负相关[47-48]。这是因为较小的个体,其表面积与体积的比例更大,更易与重金属元素接触;且较小个体的新陈代谢更为旺盛,会促进重金属在体内的吸收与转移。
2.4 海洋无脊椎动物在不同组织(器官)富集特征
重金属离子进入生物体内后会与组织细胞中某些蛋白质或者酶发生反应,蓄积在其中,造成细胞活性丧失,若含量超过一定阈值则会导致机体中毒[49]。这是由于重金属离子有着亲蛋白质分子的特征,易与蛋白质表面基团结合。正是由于该特性,使得重金属离子可分布于生物体内多个组织或器官中,且由于器官功能、重金属种类和重金属价态等条件的不同而导致不同器官中重金属浓度有差异,但是总体而言重金属元素的主要分布器官是机体的消化器官(表2)。王军等[50]对我国北方养殖品种虾夷扇贝(Mizuhopectenyessoensis)不同组织中4种重金属含量进行调查研究,发现虾夷扇贝内脏团仅占整只贝质量的8%~15%,但Cd、Zn、Cu和Pb等元素总量的76%~85%蓄积在内脏团中,表明内脏是Cd、Pb等有毒元素以及Zn、Cu等必需元素的主要富集器官。上述现象在海洋无脊椎动物中普遍存在。Bustamante等[51]发现在乌贼(Sepiaofficinalis)的消化腺中Ag、Co的总量占全身的91%~95%,证明乌贼的消化腺是这2种元素的主要储存器官。Kim等[52]的研究表明,太平洋褶柔鱼(Todarodespacificus)消化腺内Cd、Zn和Cu浓度均显著高于肌肉中的浓度,其中消化腺中Cd的浓度是肌肉中Cd浓度的310倍。同为柔鱼科种类的短柔鱼(T.eblanae),其消化腺中的Cd的浓度也明显高于其他组织[53]。甲壳类生物也存在类似情况,Bordon等[54]发现美青蟹(Callinectesdanae)体内Cd、Co和Pb等重金属元素在鳃中浓度最高,其次是肝胰腺,在肌肉的含量最低。

表2 海洋无脊椎动物体内不同组织(器官)中Cd浓度Table 2 Concentrations of Cd in different tissues (organs) of marine invertebrates (mg·kg-1)
某些元素在海洋无脊椎动物体内的分布情况较为特殊,如Hg、As。Tanaka等[55]对中国东海中3种重要经济头足类生物不同器官Hg、As的分布研究发现,不同于Cd在消化腺中含量最高的分布方式,As在3种头足类生物体内均衡分布在各个器官中,Hg则在消化腺中含量较低,但在其他器官中含量较高。Reichmuth等[56]比较河口中污染和清洁区域的蓝蟹(Callinectessapidus)肌肉和肝胰腺中多种重金属富集情况,发现在污染区域的蓝蟹肌肉中Hg的浓度明显要高于肝胰腺中的浓度,将清洁区域中的蓝蟹放入污染区域生长8周后,其体内Hg浓度明显升高且肌肉中重金属浓度远高于肝胰腺。Hg、As在海洋无脊椎动物体内的分布规律源于不同重金属含量的关联性以及重金属在海洋无脊椎动物组织间转移。海洋无脊椎动物的不同组织器官中蛋白含量不同以及富集机制的不同,是导致富集浓度存在差异的主要原因。
2.5 海洋无脊椎动物组织间转移特征
重金属在进入海洋无脊椎动物体内后可以在组织中保留和转移。摄食途径获得的重金属会首先进入消化器官,之后会随血液的运输到达全身各个组织和器官;海水和沉积物途径则会通过鳃等器官的毛细血管进入到血液中并随循环系统达到各组织和器官。Raimundo等[57]研究加利福尼亚海湾茎柔鱼(Dosidicusgigas)体内重金属富集现象发现,某些元素存在从消化腺(如Cd、Co)或鳃(如As、Co)向外套膜转移的现象。由于Co是维生素B12的重要组成元素[58],维生素B12又与细胞代谢密切相关。因此在茎柔鱼的生长过程中Co会通过不同的渠道转移至外套膜。Cd的转移则是由于消化腺的解毒能力有限,部分无法及时与金属硫蛋白结合的Cd会传递到外套膜中。As情况较为特殊,As在环境中以有机砷和无机砷这2种形式存在,无机砷有剧毒[59]而有机砷无毒,且会参与组成砷甜菜碱(C15H11AsO2),该物质与甘氨酸甜菜碱(glycine betaine)结构相似。甘氨酸甜菜碱是一类渗透压调节物质,起到使机体不受周围水盐度变化影响的作用[60]。细胞无法区分2种物质,因此会通过相同的转运体吸收砷甜菜碱,这也是As在头足类生物体分布较为均匀的原因[61-62]。重金属转移的现象在贝类中也较为常见,张丽岩等[63]研究Cd对青蛤(Cyclinasinensis)的急性毒性及其在体内的蓄积,72 h前青蛤体内组织Cd浓度高低顺序依次是:鳃>内脏团>肌肉,72 h后随着肌肉对Cd的富集量迅速增加,浓度顺序变为肌肉>内脏团>鳃。
Hg在海洋无脊椎动物体内的转移现象较为特殊。以头足类为例,摄入总汞(T-Hg)之后,首先会在消化腺中去甲基化,但是由于消化腺的去甲基化作用有限,导致仍有大部分的有机汞(O-Hg)存在。由于O-Hg的化学性质决定了该物质与肌肉的亲和力更强[64],所以O-Hg向外套膜等肌肉组织转移,导致外套膜中Hg浓度升高。由于贝类习性多为底栖,体内甲基汞含量高,因此部分喜好摄食贝类的头足类会出现外套膜中Hg含量高于消化腺中Hg含量的现象[65]。
一些生物必需元素如Zn会随着生物机体的生长,从主要富集器官转移至性腺再到子代。原田葉乃[66]以太平洋褶柔鱼(T.pacificus)和马氏乌贼(Sepiamadokai)为例,研究2种生物从肝脏向生殖腺转移Cd、Zn和As的情况,发现2种头足类生物性腺中Zn和As都会从性腺转移至子代。由于As是头足类生物细胞中的重要组成元素,因此其被视为是头足类生物的必需元素。不同的是2种生物在生殖腺的发育过程中,太平洋褶柔鱼肝脏中的Cd会向性腺中转移,而马氏乌贼则不存在这种现象(图3)。其他海洋无脊椎动物在这方面的研究较少。
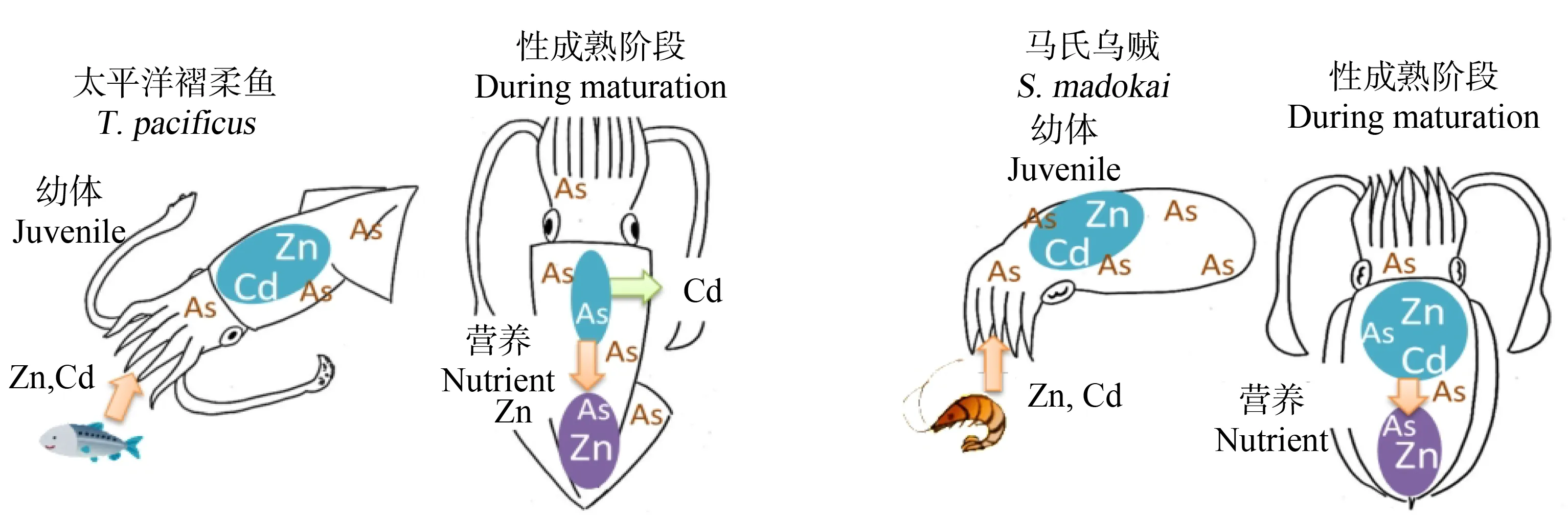
图3 太平洋褶柔鱼(Todarodes pacificus)和马氏乌贼(Sepia madokai)体内重金属分布变化[66]Fig. 3 Changes of heavy metal distribution in Todarodes pacificus and Sepia madokai [66]
3 海洋无脊椎动物重金属富集影响因素(Influencing factors of heavy metal bioaccumulation in marine invertebrates)
3.1 重金属之间相互作用的影响
由于海洋无脊椎动物接触到的重金属不是单一的某种元素,因此富集重金属的量会受到不同种类重金属元素相互作用的影响,表现为某种重金属的浓度会随着另一种重金属浓度的升高而升高或降低。相互作用可分为4种类型:拮抗作用、相加作用、协同作用以及独立作用。其中Cd与Zn、Cu的含量呈正相关关系,即检测到体内Cd含量高的海洋无脊椎动物体内Zn和Cu的含量也会高[45],二者表现出明显的协同作用。这是由于Cd富集的肝脏、肾脏等组织是生物体重要的解毒器官,其中金属硫蛋白(metallothionein)的含量较高,同时这也是该物质的主要合成部位。金属硫蛋白是一类金属结合蛋白,在体内可以结合多种金属(如Cd),使其以不溶性形式储存在体内,进而达到降低毒性的目的[67-68]。Zn在诱导该蛋白表达方面有着重要作用,可以对Cd中毒起到拮抗作用[69],因此在生物体内Zn与Cd的浓度关联性较大。反之,如果环境水体中Zn的生物利用度增加,则不仅导致组织中Zn的浓度增加,而且增强了Cd、Cu的生物富集效应。Liu和Wang[70]为找出Cd、Cu与Zn生物富集的关系及作用机制,将3个种群的香港巨牡蛎(Crassostreahongkongensis)进行Zn暴露处理,然后测定其中Zn、Cd和Cu的富集量,同时测定2个空白组香港巨牡蛎种群的Zn、Cd和Cu的富集量并进行对比分析,最终结果表明,Zn暴露对提高香港巨牡蛎体内Cd、Cu的组织浓度起着重要作用(表3)。
Hg与Se的含量往往呈正相关关系。在自然界中,Hg常以有机汞和无机汞2种形式存在,二者合称为总汞,有机汞的毒性大于无机汞[71]。Hg元素和Se元素二者具有很强的亲和力,会在分子水平上相互作用,产生毒性较弱的硒化汞晶体(HgSe),这些晶体主要储存在解毒器官中,同时HgSe晶体的形成也会导致Hg的去甲基化[72],这样有利于拮抗Hg的毒性,Se不仅具有拮抗Hg毒性的作用,而且对于其他有毒元素如Pb、Cr和As等也有同样的作用[73]。因此,有研究表明可以通过检测Se/Hg比来判断目标生物机体是否达到Hg中毒的阈值或是否有能力耐受Hg浓度的升高[74]。
3.2 环境因素表达谱,以帮助研究者根据具体需要,选择合适的肠道细胞材料。Caco-2、HT29和T84细胞系常用于建立肠道细胞单培养模型,是目前研究最多和应用最广的肠道细胞系。
3.2.1 季节变化
多种贝类体内重金属含量会随季节变化而波动。Bendell和Feng[75]对加拿大西北海岸的太平洋牡蛎(Crassostreagigas)采样,并测定其不同时期体内Cd含量的变化,发现冬季采样的太平洋牡蛎体内Cd浓度高于夏季时采样的牡蛎体内Cd浓度,原因可能是组织质量会发生季节性变化,夏季牡蛎在更高温度下生长更迅速,导致组织质量增加和金属含量稀释。此外,在夏季,牡蛎对Cd的清除率和耗氧量是冬季的2倍[76],从而减少了Cd的残留。同时,上升流将较冷、较深的水(富含溶解Cd)带到地表,而在较冷的季节,浮游植物的丰度较低,导致这些藻类对溶解态Cd的吸收量很小,溶解态Cd含量较高,因此,冬季时牡蛎体内Cd积累量更大。Li等[77]分别采集了我国崇明岛7月、9月、11月和4月的瘤背石磺(Onchidiumstruma)样本,测定其体内多种重金属元素的浓度,发现冬季采集样本中Cd、Pb和Cr含量明显高于其他季节的样本,这也验证了海洋无脊椎动物重金属富集浓度会发生季节性变化。
3.2.2 气候现象
气候现象对海洋无脊椎动物重金属富集的影响主要体现在底栖无脊椎动物中。Maar等[78]在研究壳菜紫贻贝(Mytilusedulis)体内Cd、Cu、Pb和Zn等重金属元素生物富集的影响因素时发现,季节性因素或事件,如风暴、强降雨等,会短暂改变海洋环境,进而导致海洋无脊椎动物体内重金属浓度的变化。海底沉积物中的重金属随径流而动,密度发生变化,在达到重新的平衡前,许多海洋无脊椎动物尤其是滤食性的动物会受到影响。目前关于甲壳类和头足类无脊椎动物受气候影响的研究较为缺乏,需要后续进行更为深入的研究。

表3 经Zn暴露后海洋无脊椎动物香港巨牡蛎(Crassostrea hongkongensis)不同组织(器官)中重金属浓度Table 3 Concentrations of heavy metals in different tissues (organs) of marine invertebrates Crassostrea hongkongensis after Zn exposure
3.2.3 pH与温度
pH也会影响到海洋无脊椎动物重金属的富集作用。无脊椎动物在生活史早期阶段对CO2和温度更为敏感[79]。Lacoue-Labarthe等[80]研究发现,pH降低会影响乌贼的卵膜通透性,进而会影响金属的生物富集。当pH降低到7.85时,有毒元素Ag会在酸化条件下显著增加,必需元素Zn进入胚胎的量会随着pH的降低而升高,但存在一个阈值。在成体贝类体内pH对Cd富集的影响程度有所不同,Shi等[81]研究发现,与正常海水(pH 8.07±0.05)中生长的文蛤(Meretrixmeretrix)相比,生长在pH 7.8和pH 7.4海水中的文蛤体内的Cd分别是其含量的1.21倍和1.32倍。可能的原因:(1)酸化的海水造成了上皮细胞的损伤,使Cd更容易渗透;(2)海洋酸化阻碍了文蛤对体内Cd的排出;(3)海洋酸化增加了Cd的浓度和海水中Cd2+/Ca2+的浓度,进而增加了Cd通过钙通道的内流。目前关于海洋酸化对于海洋无脊椎动物体内重金属富集的研究还不够成熟,需要更多的深入研究。
4 研究展望(Outlook)
海洋无脊椎动物是海洋生态系统中重要的组成成分,其中大多数物种是低营养级生物、底栖生物,相较其他高营养级生物具有易富集重金属等污染物、对环境变化更敏感的特点。本文以海洋无脊椎动物为研究对象,从机体暴露途径、机体组织分布情况及过程、污染物在组织间的转移规律和变化因素4个方面入手,全面归纳和总结了近10年来污染物在重要海洋无脊椎动物体内的分布和变化特征,但是仍存在一些问题需要进一步研究:
(1)目前对于海洋无脊椎动物体内污染物的富集过程、转移特征的研究较为深入,但是对于气候现象、自然条件的改变以及不同污染物之间的相互影响等方面的研究较少。建议在今后的研究中可以比较不同污染物、某个气候现象和某个理化指标对污染物富集情况的影响,将环境因素结合到研究中,并与其他相关学科建立联系,更为全面地了解污染物在海洋无脊椎动物体内的富集规律。
(2)海洋无脊椎动物中大多数物种是低营养级生物,因此在其体内富集的重金属会在食物链中经生物放大后,进入高营养级生物体内,同时会对高营养级生物个体及种群产生影响。因此,后续研究可尝试采用毒物动力学进行模拟推测,预测由自然灾害、气候因素和人为因素等所导致的重要渔业资源污染物超标,以及污染物消除所需的代谢时间等。相关研究可以为海洋渔业管理政策制定(如确定休渔期等)提供依据。
(3)海洋环境污染物中很大一部分会最终随食物链进入人体,该部分的污染物若浓度过高则会对人体造成危害,虽然目前海洋生物体内的污染物浓度大多在允许残留标准以下,但仍要未雨绸缪,对海洋生物体内污染物富集情况进行严密监测。由于海洋无脊椎动物相较于其他物种对污染物具有较强的富集能力,且多数物种具有生命周期短、活动范围小、种群数量大和易捕捞等特点,因此后续研究中应针对不同海域的特征选择适宜的海洋无脊椎动物作为污染物生物监测物种。
(4)目前大部分的研究集中在特定水域污染物污染情况的分析,以及特定水域中渔业资源受污染程度是否影响安全食用,而对于污染物随海洋生物的生理活动、洄游行为而转移,对临近海域的影响研究较少。因此今后应考虑研究一些洄游范围较大且主要摄食海洋无脊椎动物的高营养级海洋生物,考察当其自身作为污染物富集者时,对洄游所经过的海域以及该海域中的栖息生物所产生的潜在影响。

