常压蒸汽处理对全麦粉脂肪相关酶活性及微生物的影响
杜昱蒙,任国宝,任晨刚,4,陈 潜,甘婉强,陈 艳✉
(1. 中粮营养健康研究院,北京 102209;2. 新希望六和股份有限公司,北京 100020;3. 中粮海嘉(厦门)面业有限公司,福建 厦门 361000;4. 营养健康与食品安全北京市重点实验室(北京市科委),北京 102209)
全麦粉含有丰富的维生素、膳食纤维及多种微量元素,越来越受到崇尚健康、绿色、自然的消费者的青睐。小麦中的大部分活性脂肪酶(75%~80%)分布在籽粒麸皮中,(20%~25%)分布于胚芽中[1]。小麦籽粒经过研磨制备全麦粉时,区隔麦麸、胚芽、胚乳的区室被破坏,原本储藏在胚芽、麸皮细胞中的脂肪和酶被释放。诸多研究表明,影响全谷物粉品质及货架期稳定性的最关键因素为脂肪的分解及氧化[2]。低温贮藏可以有效减缓脂肪的分解速度,在-20 ℃条件下贮藏20周的全麦粉几乎未发生脂肪分解,但冷链运输及贮藏的成本过高,难以大范围应用[3]。也有学者通过气调包装和在包装中加入抗氧化剂等措施延缓脂肪分解,但收效甚微,原因是脂肪水解酸败是酶促反应,并不受环境中的氧气含量的影响[4],而游离脂肪酸的氧化速度过快,导致抗氧化剂无法及时起效。因此,提高全谷物粉稳定性的最佳方法是抑制脂肪酶及脂肪氧化酶的活性。
对此,国内外有大量的相关研究报道。目前,应用比较广泛的灭酶工艺包括:热处理(干热或湿热),微波处理,挤压处理等[5]。其中,使用蒸汽处理钝化脂肪酶及脂肪氧化酶的研究较为广泛,蒸汽处理可大致分为过热蒸汽和常压蒸汽处理。过热蒸汽处理小麦籽粒,显著减少了全麦粉中脂肪酶、脂氧合酶以及多酚氧化酶的活性[6]。但是,使用过热蒸汽处理麸皮会在一定程度上改变麸皮的微观结构和面团的流变特性,从而对全麦粉的应用品质产生一定程度的影响[7-8]。另一方面,过热蒸汽处理对于设备及操作人员的专业性要求较高,对于生产企业负担较大。对麸皮进行常压蒸汽处理是抑制全麦粉微生物含量及酶活性最为经济、有效的手段之一。同时,常压蒸汽处理[9]对于维持麸皮形态、色泽等方面也存在一定的积极意义,可以作为稳态化全麦粉生产的常规处理方法之一。
全麦粉中的微生物也是影响全麦粉货架期的重要因素。目前,小麦粉国标中尚未有微生物的相关标准,但许多食品企业已经开始逐步建立卫生相关的内控标准。小麦中的微生物主要集中在小麦籽粒的表面,seiler 等报道[10],小麦的菌落总数(6.4 log CFU/g)远远高于面粉的菌落总数(1.9 log CFU/g),小麦的霉菌(4.3 log CFU/g)为面粉霉菌(3.7 log CFU/g)的2倍。杨少武的研究表明,各系统粉嗜温芽孢菌含量也存在较大差异,接近表皮部分嗜温芽孢菌含量较中心胚乳部分含量高[11]。未经任何处理的全麦粉微生物含量远远高于普通面粉,也会对后续产品的生产造成较大的威胁。
因此,本研究评估了不同常压蒸汽处理强度对麸皮微生物及酶活的影响,并综合评价蒸汽处理麸皮制备的稳态化全麦粉保质期,为工业化生产稳态化全麦粉提供参考。
1 材料与方法
1.1 实验材料
国产全麦粉Ⅰ、Ⅱ、Ⅲ(金山全麦粉:益海嘉里(昆山)食品工业有限公司;孖叁牌全麦粉:肇庆市福加德面粉有限公司;一风吹全麦粉:河南金苑粮油有限公司);进口红磨坊全麦粉:美国鲍勃红磨坊;硬红春麦,2019年9月收获,2020年1月到港后取样在恒温样品库中储藏(23 ℃,RH60%):加拿大西部;氢氧化钠、无水乙醇、乙醇(95%)、邻苯二甲酸氢钾、酚酞(99%)、浓硫酸、丙酮、石油醚(沸程 30~60 ℃)(均为分析纯):国药集团化学试剂有限公司。
1.2 仪器与设备
小型实验磨粉机(Quadrumat Junior):德国布拉班德仪器设备有限公司;全自动旋风磨(M3100):波通瑞华科学仪器(北京)有限公司;Titrette®数字瓶口滴定器:德国普兰德公司;分光光度计(UV-4802):尤尼柯(上海)仪器有限公司;激光粒度仪(Mastersizer 3000):英国马尔文公司;医用台式离心机(TDZ5-WS):长沙平凡仪器仪表有限公司;多功能蒸汽锅(10L,WSYH26A):美的集团股份有限公司。
1.3 实验方法
1.3.1 全籽粒全麦粉制备
使用小型实验磨粉机将小麦籽粒研磨成粉,并分离胚乳及麸皮,得到出率70%面粉及30%麸皮(含粉)。再使用全自动旋风磨粉机对麸皮进行研磨(筛片孔径 0.8 mm),使所有麸皮粉可通过80目筛,再将麸皮粉和出率为70%的自制面粉混合,得到全籽粒全麦粉。
1.3.2 稳态化麸皮粉及全麦粉制备
稳态化麸皮粉:使用小型实验磨粉机将小麦籽粒研磨成粉,并分离胚乳及麸皮,得到出率70%面粉及30%麸皮。将蒸汽锅中水加热煮沸,取150 g麸皮铺于筛网上(筛面30 cm×30 cm),将筛网放在蒸汽锅上方分别加热指定时间,加热后麸皮放入烘箱中,80 ℃烘干,将麸皮水分烘干至11%~12%,再使用全自动旋风磨粉机对麸皮进行研磨(筛片孔径 0.8 mm),使所有麸皮粉可通过80目筛。
稳态化全麦粉:将稳态化处理后的麸皮粉按30%的比例与出粉率 70%的面粉混合后,制成稳态化全麦粉。
1.3.3 粒径测量
使用马尔文Mastersizer 3000激光粒度仪,采用干法粒径测试系统。参数:气压:1.5 bar;进样速度:40%;折射率:1.59;颗粒密度:1.05 g/m3;测量次数:1;背景测量持续时间:10 s;样品测量持续时间:20 s;背景稳定时间:120 s。
1.3.4 脂肪酸值测定
脂肪酸值参考GB/T 15684—2015《谷物碾磨制品 脂肪酸值的测定》测定。
1.3.5 脂肪酶活性测定
脂肪酶活性测定参考 Domenico R等报道[12]的方法;使用磷酸盐缓冲液配制(pH7.5,0.2 mol/L)配制10.75 mMp-硝基苯丁酸酯溶液,称量麸皮样品0.02 g和9 mL磷酸盐缓冲液于试管中,加入1 mLp-硝基苯丁酸酯溶液,混匀后,25 ℃水浴20 min,1 000 r/min 离心 5 min,在加入p-硝基苯丁酸酯溶液后的30 min取上清测试其在400 nm处的吸光值。使用对硝基苯酚做标准曲线,计算p-硝基苯丁酸酯的氧化情况,从而评估脂肪酶活性。
1.3.6 脂肪氧化酶活测定
脂肪氧化酶活测定参考Cato L等报道[13]的方法。酶提取液:将 2 g样品和 10 mL缓冲液(0.1 mol/L,pH 7.5 磷酸缓冲液)混合,冰水浴提取 30 min,4 ℃,3 000 r/min 离心 20 min,取上清液。
底物配制:0.125 mL吐温20分散于2.5 mL,pH 9.0的0.05 mol/L硼酸盐缓冲液中,摇动下逐滴加入0.150 mL的亚油酸,充分混匀使亚油酸的微细状体分散于液体中,加入1 mol/L氢氧化钠0.325 mL摇动使体系成为清澈透明的溶液,然后加入硼酸盐缓冲液22.5 mL,用1 mol/L盐酸调pH至7.0,用清水定容至50 mL。
分别加 0.5 mol/L,pH5.5乙酸盐缓冲液3.86 mL,提取酶液 20 μL,底物 120 μL 于试管中,混合均匀,于234 nm处,记录吸光值,3 min后再次记录吸光值。
酶活的定义:在20 ℃,234 nm处,以亚油酸为底物时,反应体系每分钟增加吸光度 0.001为一个活力单位。
1.3.7 全麦粉的保质期测试
采用铝箔袋包装(每包 30 g),对全麦粉进行长期稳定性试验和加速破坏性试验[14],以脂肪酸值为评价指标。长期稳定性试验的样品在常温(25±1)℃、湿度50%的条件下进行,取样间隔30 d。加速破坏性试验温度为 35、45 ℃,湿度 50%。其中,35 ℃贮藏样品取样时间间隔为 15 d、45 ℃为 8 d。根据标准 LS/T 3244—2015《全麦粉》规定,以全麦粉的脂肪酸值(以干基 KOH计)达到116 mg/100g时的日期作为保质期参考限。
1.3.8 微生物检测方法
菌落总数:参考GB 4789.2—2016《食品安全国家标准 食品微生物学检验 菌落总数》测定;
霉菌:参考GB 4789.15—2016《食品安全国家标准 食品微生物学检验 霉菌和酵母计数》测定;
大肠菌群:参考GB 4789.3—2016 《食品安全国家标准 食品微生物学检验 大肠菌群计数》测定;
总芽孢杆菌:与菌落总数测定方法相同,需增加在制备完成1∶10的样品匀液后,将其放置于试管中,在80 ℃水浴条件下加热10 min,并使用冷却后的样品匀液进行后续的测试,计数与结果统计方法均与GB 4789.2—2016相同。
1.4 数据分析
使用 SPSS 16.0进行数据统计分析。部分结果以平均值±标准差表示,指标内部的均值比较采用单因素方差分析,多重比较采用邓肯法,采用95%置信度(P<0.05)。
2 结果与分析
2.1 市售全麦粉货架期关键指标对比
选取四款市售全麦粉与自制全麦粉的关键指标进行对比。其中,有三款国产全麦粉、一款进口全麦粉,国产全麦粉的膳食纤维均在10%~11%的范围内,样品间膳食纤维含量差别不显著,进口全麦粉膳食纤维含量为 15.6%,明显高于国内全麦粉的平均水平。
根据标准LS/T 3244—2015《全麦粉》规定,理化指标应符合总膳食纤维≥9.0%,表1中的市售及自制全籽粒全麦粉均符合全麦粉关键指标的要求。市售四款全麦粉的粒径差异较明显,其中国产全麦粉Ⅱ粒径最大,其次为国产全麦粉Ⅰ和国产全麦粉Ⅲ,其中进口全麦粉和自制全籽粒全麦粉的粒径最小。

表1 市售及自制全麦粉膳食纤维及粒径分析Table 1 Dietary fiber content and particle size distribution of the whole wheat flour samples
限制全麦粉货架期的主要问题是酸败和哈败,其中起到关键性作用的两种物质为脂肪酶和脂肪氧化酶,表1~2结果显示,市售及自制全麦粉经过3个月相同条件储藏后,其脂肪酸值均处于较高水平,根据标准LS/T 3244—2015《全麦粉》规定,全麦粉脂肪酸值(以干基 KOH计)≤116 mg/100g。在贮藏3个月后,全麦粉的脂肪酸值均高于标准要求或处于临界值附近。这与前期的研究结果一致[15]。

表2 市售及自制全麦粉脂肪酶系及脂肪酸值Table 2 Fatty acid value and enzyme activity of the whole wheat flour samples
另一方面,全麦粉的微生物含量较高,且含有大量不易被杀死的芽孢,这也间接导致全麦制品中菌落总数超标的问题。因此,在全麦粉生产过程中,微生物含量也是影响全麦粉应用品质的重要环节。
如表3所示,国产全麦粉Ⅰ和国产全麦粉Ⅱ的菌落总数较高,分别为8.0×103CFU/g和1.0×104CFU/g,国产全麦粉Ⅲ和自制全籽粒全麦粉的菌落总数较低,分别为 9.5×103CFU/g和 4.0×103CFU/g。进口全麦粉的菌落总数含量较低,为8×102CFU/g。其中,进口全麦粉的霉菌含量最低,为10 CFU/g,国产全麦粉Ⅱ的霉菌总数90 CFU/g,其他全麦粉的霉菌含量为2.6~7.3×102CFU/g,进口小麦粉总芽孢数较低,为15 CFU/g,除国产全麦粉Ⅰ号外,其他国产全麦粉和自制全麦粉芽孢含量较高,为1.8~3.5×102CFU/g,其结果基本与文献报道的结果一致。研究表明,小麦籽粒中芽孢含量超过4.3 log CFU/g,即会对面包产生不利影响[16]。Berghofer[17]等调查显示,澳大利亚小麦粉中细菌总数 103CFU/g、芽孢为 102CFU/g、大肠菌群为 10 CFU/g、霉菌和酵母菌的含量为102CFU/g。国内部分小麦粉种微生物含量较澳洲小麦粉高,其中菌落总数在 3.4×103~ 1.8×105CFU/g之间;霉菌含量在 40 ~1.1×103CFU/g 的范围内,其原因推测与国产小麦种植未实现集中种植、收储和管理,存在微生物控制不严格,品质差异大等问题[18]。

表3 市售全麦粉微生物情况Table 3 Microbiological condition of the whole wheat flour samples CFU/g
2.2 常压蒸汽处理对麸皮微生物及脂肪酶活的影响
如表4所示,将麸皮部分分别进行5~60 min不同时长的蒸汽处理。结果表明,麸皮中菌落总数数值最大,芽孢其次,霉菌和酵母含量较少,且不耐热,极易被杀死。经过10 min的常压蒸汽处理后,麸皮中的菌落总数从2.2×105CFU/g下降至 1.4×102CFU/g,芽孢从 1.2×103CFU/g 下降至 1.1×102CFU/g;常压蒸汽处理 20 min 后,菌落总数和芽孢均降至100 CFU/g以下,达到较低水平。

表4 不同汽蒸时间处理麸皮的微生物情况Table 4 Microbiological condition of the bran with steam treatment in different time CFU/g
由于小麦、燕麦等籽粒的脂肪酶主要集中在麸皮部分,因此,可以采用先分离出麸皮部分进行单独的灭酶处理,再将麸皮回添至面粉中的方法制备全谷物粉,Rose(2008)报道,使用微波(1 000 W)和蒸汽(60 s)处理麸皮,其脂肪酶活性分别减少了93%和96%[19]。脂肪酶和脂肪氧化酶对于热处理较为敏感,实验结果如图1所示,常压蒸汽处理5 min以上,脂肪酶失活率可达90%以上,脂肪氧化酶在常压蒸汽处理10 min后失活率可达80%以上。

图1 不同汽蒸时间处理麸皮脂肪相关酶钝化情况Fig.1 Passivation rate of the lipase and lipoxygenase in bran with steam treatment in different times
2.3 稳态化全麦粉货架期测试
基于上述麸皮处理结果,选取蒸汽处理10 min的麸皮粉与自制的出率70%的面粉混合,制成稳态化全麦粉,并对其进行货架期评价。实验结果如表5和图2所示,经过稳态化处理后的全麦粉菌落总数降低至1 000以下,脂肪酶及脂肪氧化酶活性降低60%以上。

表5 稳态化全麦粉微生物情况Table 5 Microbiological condition of stabilized whole wheat flour CFU/g

图2 稳态化全麦粉粉脂肪相关酶活性Fig.2 Enzyme activity of stabilized whole wheat flour samples
2.3.1 全麦粉货架期内菌落总数测试
对上述全麦粉进行货架期稳定性试验,不同储藏温度下稳态化全麦粉菌落总数变化情况结果见图3。
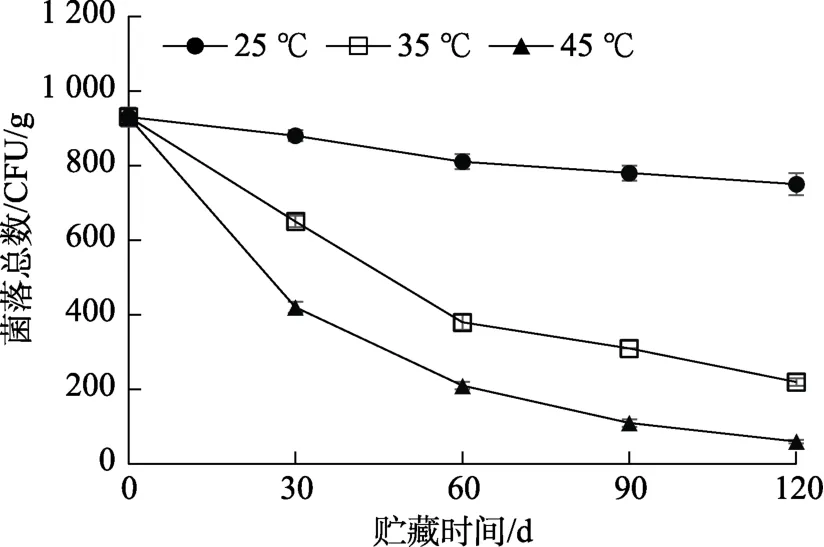
图3 不同储藏温度下稳态化全麦粉菌落总数变化情况Fig.3 Changes in total plate count of the stabilized whole wheat flour in a long-term storage test
稳态化全麦粉在储藏期间菌落总数呈现下降的趋势,贮藏温度越高,菌落总数下降越显著。贮藏120 d后,45 ℃存放全麦粉菌落总数下降至60 CFU/g,35 ℃存放全麦粉菌落总数下降至220 CFU/g,25 ℃存放全麦粉菌落总数下降至750 CFU/g。这主要是由于面粉水分含量较低,不适合微生物的生长和繁殖,尤其是当温度较高的情况下,部分不耐热的微生物更加难以存活。
2.3.2 全麦粉货架期内脂肪酸值测试
如图4~6所示,全籽粒全麦粉在25、35、45 ℃条件下的保质期(脂肪酸值达到116 mgKOH/100g)分别为95、51、26 d,根据食品保质期通用指南中的方法计算,其Q10=1.86~1.96,也就是说温度每升高10 ℃,其保质期缩短1.86~1.96倍。稳态化全麦粉在25、35、45 ℃条件下储藏120 d后,脂肪酸值均未超过 116 mgKOH/100g,因此无法通过超出脂肪酸值限量的日期来判断其准确货架期。基于前期的研究和文献报道[20],面粉脂肪酸值随时间的变化基本成线性,因此对三种储藏温度下面粉脂肪酸值上升趋势曲线进行线性拟合,发现其R2均大于0.99。斜率分别为k25=0.077 8;k35=0.158 5;k45=0.327 5。根据这一趋势推算出其Q10=2.04~2.07。在 45 ℃条件下存放 120 d 的稳态化全麦粉,脂肪酸值为92.18 mgKOH/100g,按照Q10=2.04~2.07推测,稳态化全麦粉若在25 ℃条件下存放499~514 d(即16~17个月左右),其脂肪酸值为92.18 mgKOH/100 g,未超出标准限量。因此,推测稳态化全麦粉的货架期至少为16~17个月。

图4 25 ℃储藏全麦粉脂肪酸值变化情况Fig.4 Changes in fatty acid value of the whole wheat flours in a long-term storage test (25 ℃)

图5 35 ℃储藏全麦粉脂肪酸值变化情况Fig.5 Changes in fatty acid value of the whole wheat flours in a long-term storage test (35 ℃)

图6 45 ℃储藏全麦粉脂肪酸值变化情况Fig.6 Changes in fatty acid value of the whole wheat flours in a long-term storage test (45 ℃)
3 结论
通过前期的市场产品调研及文献查阅结果显示,与普通面粉相比,全麦粉的微生物情况和脂肪酶等引起的脂肪酸值过高和哈败等问题是影响其保质期的关键因素。通过对微生物和酶含量较高的麸皮部分进行蒸汽处理,可有效延长全麦粉货架期,提升全麦粉的货架期稳定性,极大丰富全麦粉的贮藏及应用范围。结果表明,麸皮经常压蒸汽处理10 min以上的稳态化全麦粉,菌落总数从 9.5×103CFU/g 降低至 8.8×102CFU/g,总芽孢数从 450 CFU/g降低至10 CFU/g,并在不同温度贮藏期间呈现下降的趋势。脂肪酶和脂肪氧化酶活性降低60%以上。据推测,其货架期至少为16~17个月。

