肠道菌群与胰腺炎:现状及未来
温 华,李 茜,路 宁,苏媛媛,马培晗,张明鑫
温华,苏媛媛,西安医学院 陕西省西安市 710000
温华,李茜,路宁,苏媛媛,张明鑫,西安医学院第一附属医院消化内科 陕西省西安市 710077
马培晗,张明鑫,陕西中医药大学第二临床医学院 陕西省咸阳市712046
温华,主要从事肠道菌群与消化道疾病的研究.
0 引言
健康人肠道菌群的特点是微生物丰富,物种多样性高.有人把肠道菌群称作“第二基因组”.据报道人类肠道菌群包含1013-1014个微生物,以及超过5×106个决定了肠道菌群的基因[1,2].在这种微环境中,细菌为优势菌,分为有害菌、中性菌及有益菌.其中厚壁菌门和拟杆菌门是主要的细菌门,占微生物总数的85%-90%,而放线菌门和变形菌门数量较少,最多占10%[3](表1).一般情况下,中性菌及有益菌种类比有害细菌种类多.但是,当肠道微生态被打乱时,有害细菌就会增多,一些菌群生理功能就会相应丧失[4,5].在这种不良环境中,肠细胞之间的紧密连接减少,导致粘膜屏障完整性的功能受损;这种被称为“肠漏”的变化有时会导致细菌移位(图1),并在胃肠道和全身性疾病的发展中起着关键作用[6].近年来,人们逐渐意识到肠道菌群在人类健康和疾病中起着重要的作用,如炎症性肠病、肠易激综合征、阿尔茨海默病和糖尿病等疾病均跟肠道菌群有关[1-10].同理,肠道菌群对胰腺炎也有着重要的作用及影响[11],研究者们相信肠道菌群与胰腺之间存在着一个生物交互系统,即“菌群-肠道-胰腺轴”[12].本文就肠道菌群与胰腺炎的相互影响,做了相关论述,希望能为这方面的研究者提供一些借鉴和思考.
1 肠道菌群与急性胰腺炎
急性胰腺炎(acute pancreatitis,AP)是腺泡内胰蛋白酶原和其他蛋白水解酶过早激活的结果,导致胰腺腺泡损伤、炎症介质上调、细胞因子释放、全身炎症反应和微循环损伤[13],多跟暴饮暴食、胆石症、酒精、高脂血症、高钙血症及家族遗传史等这些因素有关.多项研究表明肠道菌群跟AP也密切相关.
1.1 肠道菌群与AP密切相关 Zhang等[14]研究显示AP患者的样本含有更多的拟杆菌和变形杆菌,而厚壁菌和放线菌较少(表1).既往研究也发现AP患者肠球菌、肠杆菌等潜在致病菌含量显著高于非感染组,而双歧杆菌等益生菌含量显著低于非感染组;由此可见,肠道菌群失衡可能是导致AP易位感染的的重要原因.尽管细菌可能不是胰腺炎的诱因,但炎症环境可能使这些微生物进入胰腺,并使局部和全身炎症状况恶化.有研究表明AP患者的淋巴结样本、浆膜标本、血液标本中可以培养出细菌,这些细菌大多来自下消化道,其中最常见的微生物是大肠杆菌(54%)[15].
AP改变肠道菌群的机制可能是炎症导致肠屏障功能受损[16](图1),从而增加了肠道的通透性.这可能是通过降低claudin 2/4的表达改变肠道的紧密连接来实现的[17].器官衰竭和更大程度坏死的AP患者中具有较多的致病菌群[18,19].Tsiotos等[20,21]研究也显示约30%胰腺坏死的无菌病例,最终会被感染致病菌群,而且具有更高的致死率(20%-30%).这些研究都为“肠漏”机制提供了证据.
1.2 胰腺分泌抗菌肽可以抑制肠道菌群 抗微生物肽(CRAMP)是一种通过细菌膜具有抗微生物活性的蛋白质[22,23].这种胰腺分泌的抗菌肽可以抑制肠道菌群(图1)[24,25].Orai1是胰腺抗菌肽胞吐所需的Ca2+通道,在AP发展过程中,由于胰腺腺泡损伤或者Orai1通道的破坏导致胰腺分泌抗菌肽减少,可能使肠道菌群失调,有害菌群大量繁殖.而有害菌群的增多又可能通过“肠漏”及炎症等机制反过来加重胰腺炎.
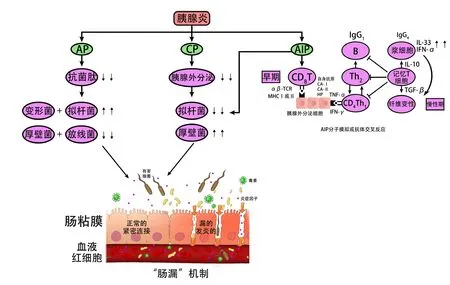
图1 肠道菌群与胰腺炎的相关机制.AP使胰腺腺泡损伤或者Orai1通道的破坏导致胰腺分泌抗菌肽减少,从而使肠道变形菌和拟杆菌增加,厚壁菌和放线菌减少,有害菌的增多又可能导致肠道屏障受损从而形成“肠漏”.CP和AIP主要通过影响胰腺外分泌功能,从而改变肠道菌群的种类和数量,在有害菌和炎症的刺激下使肠道屏障受损形成“肠漏”.在AIP早期,对自身抗原或分子拟态(H.pylori)的初始反应是通过减少CD8T细胞,诱导产生IFN-γ、TNF-α等炎症因子,补体系统的经典通路可能被IgG免疫复合物激活,从而通过浆细胞样树突状细胞产生IFN-α和IL-33,最终介导慢性纤维炎症反应.AP:急性胰腺炎;CP:慢性胰腺炎;AIP:自身免疫性胰腺炎;H.pylori:幽门螺杆菌.
1.3 改变AP相关肠道菌群,有望改善疾病预后 日本相关指南认为急性重症胰腺炎(severe acute pancreatitis,SAP)及胰腺坏死者应早期使用抗菌药物.其依据来自一项临床研究,该研究结果显示预防用药组显著降低了死亡率及胰腺感染性坏死发生率[26].有研究认为乳酸杆菌和双歧杆菌等益生菌可能有助于维持肠道屏障功能,限制致病菌群的生长[27,28].也有研究发现高负荷益生菌混合物可能对治疗有害[29].由于目前益生菌对SAP患者的影响存在较大争议,故还需要进一步的研究予以证明.
2 肠道菌群与慢性胰腺炎
慢性胰腺炎(chronic pancreatitis,CP)是一种以胰腺腺泡、导管和胰岛细胞持续性破坏及进行性纤维化为主要特征的慢性炎症性疾病,因为胰腺结构的破坏从而导致外分泌和内分泌功能受损[30,31].临床表现主要有腹痛、胰腺外分泌功能不全和高血糖等,严重影响生活质量[32],同时CP患者也表现出与病原菌生长相关的生物失调[33].
2.1 肠道菌群与CP的相互作用 和AP一样,肠道菌群与CP也存在着相互影响.有研究指出CP患者肠道菌群中拟杆菌的相对丰度显著增加,厚壁菌的相对丰度降低[34].CP通过影响胰腺外分泌功能,从而可以改变肠道菌群的种类和数量[35].肠道菌群的改变可以使肠道屏障功能受损及通透性增加,进而促使肠道菌群移位至胰腺,进一步加重CP[36-38](图1).目前肠道菌群具体通过什么途径进入胰腺还不清楚,需要进一步的研究.
2.2 胰酶替代疗法可以改善CP患者的肠道菌群 胰酶替代疗法(pancreatic enzyme replacement therapy,PERT)是胰腺外分泌不足(pancreatic exocrine insufficiency,PEI)治疗的基石.通常认为粪便排泄异常,脂肪泻和体重减轻的患者是PERT的适用人群,PERT可以帮助CP患者脂肪吸收,改善患者的营养状况[39].一些研究认为PERT可以直接改变肠道菌群,但具体机制目前仍不清楚.有研究发现用PERT治疗的小鼠中有相对丰富的阿克曼菌(Akkermansia muciniphila)和罗伊拉杆菌(Latobacillus reuteri).特别是阿克曼菌,在PERT组中发现高达58倍,,它可以通过促进粘液厚度和紧密连接蛋白表达来增强肠屏障功能,从而减少“肠漏”[40,41].综上,PERT可能有助于改善肠道菌群,从而缓解CP患者症状.
2.3 微生物制剂可能改善CP患者的临床症状 Dos Santos等[42]发现使用由干酪乳杆菌、鼠李糖乳杆菌、嗜酸乳杆菌、双歧杆菌和果寡糖组成的合生元能改变CP患者的肠道微环境,从而改善CP患者的临床和实验室结果.Dylag等[43]也认为益生元可以使双歧杆菌增多,致病菌减少,从而维持肠道微生态[44].这提示微生物制剂可能是一种治疗选择,但其临床相关性还需要更多的研究支持.
3 肠道菌群与自身免疫性胰腺炎
自身免疫性胰腺炎(autoimmune pancreatitis,AIP)是一种特殊类型的胰腺炎,常以梗阻性黄疸或腹痛为主要症状,且伴有胰腺组织淋巴浆细胞浸润及纤维化,治疗上对类固醇激素敏感[45,46].它有两种不同的表型,分为1型和2型.目前,1型AIP被认为是系统性免疫球蛋白G4相关疾病(IgG4-RD)的胰腺表现[47],它与血清IgG4浓度升高、淋巴浆细胞浸润和胰腺静脉炎有关.与1型AIP不同,2型AIP只影响胰腺,血清IgG4浓度正常,组织学上表现为中性粒细胞炎症[48].有研究指出AIP和CP的肠道菌群在门类水平上无明显差异,但是卵形拟杆菌、芦苇链球菌、戈登链球菌、乳酸发酵梭菌、拉瓦尔梭菌在CP患者中较AIP患者更常见[49](表1).

表1 胰腺炎患者肠道菌群的变化
3.1 肠道菌群可能与AIP相关 近期有人研究了幽门螺杆菌(Helicobacter pylori,H.pylori)感染与AIP之间的可能联系[50-53].Guarneri等[53]提出H.pylori感染可能通过分子模拟或抗体交叉反应在遗传个体中引发AIP(图1).Frulloni等[50]研究表明H.pylori的a-碳酸酐酶(a-CA)与人类的a-碳酸酐酶-Ⅱ(a-CA-Ⅱ)以及H.pylori的纤溶酶原结合蛋白(PBP)与胰腺腺泡上皮细胞的泛素蛋白连接酶E3-n识别蛋白2存在一定同源性,同区段含有DRB1*0405的结合序,大多数AIP患者也表现出IgG反应活性.同时,95%的AIP患者血清抗体PBP阳性,这提示H.pylori与胰腺自身蛋白的分子拟态可能是AIP发病的刺激因子.所以,H.pylori感染易感人群后可能会通过分子模拟诱发异常的免疫应答,造成严重的组织损伤,导致AIP发病.
3.2 肠道菌群的先天免疫反应参与了AIP的发展 先天免疫激活有助于AIP和IG4相关性疾病(IG4-RD)的发生发展[54-56].IG4-RD的特点是浆细胞样树突状细胞(pDCs)产生IFN-a和IL-33,从而介导慢性纤维炎症反应.有研究发现肠道菌群失调可以通过激活pDCs,从而增加对AIP的敏感性;另外,使用广谱抗生素可以抑制胰腺产生IFN-a和IL-33介导的血小板聚集,从而抑制AIP的发展[57].
4 未来展望
近年来已有一些关于肠道菌群与胰腺炎关系的研究报道(表2).肠道有益菌群可以通过维持肠道完整性和调节肠道屏障通透性可以抵御病原微生物,所以理论上菌群的调节可能有助于胰腺炎和相关并发症的治疗.但目前SAP患者是否应该使用益生菌治疗尚未达成共识.益生菌可能对于改善SAP的肠黏膜屏障有一定作用,但尚需进一步临床评价[58].另外,不同菌株的表现也不尽相同,因为不同的细菌有不同的粘附位点和不同的免疫效果[59,60].因此,益生菌的种类可能导致临床结果的差异.比如Cui等[61]发现类似于双歧杆菌的益生菌可以显著改善感染程度及减轻症状.而Gou等[62]认为益生菌对预测SAP患者的临床结局既无益处也无副作用;他们的研究还发现在益生菌的类型、剂量和治疗时间方面存在显著的异质性,这可能导致了临床结局的异质性.
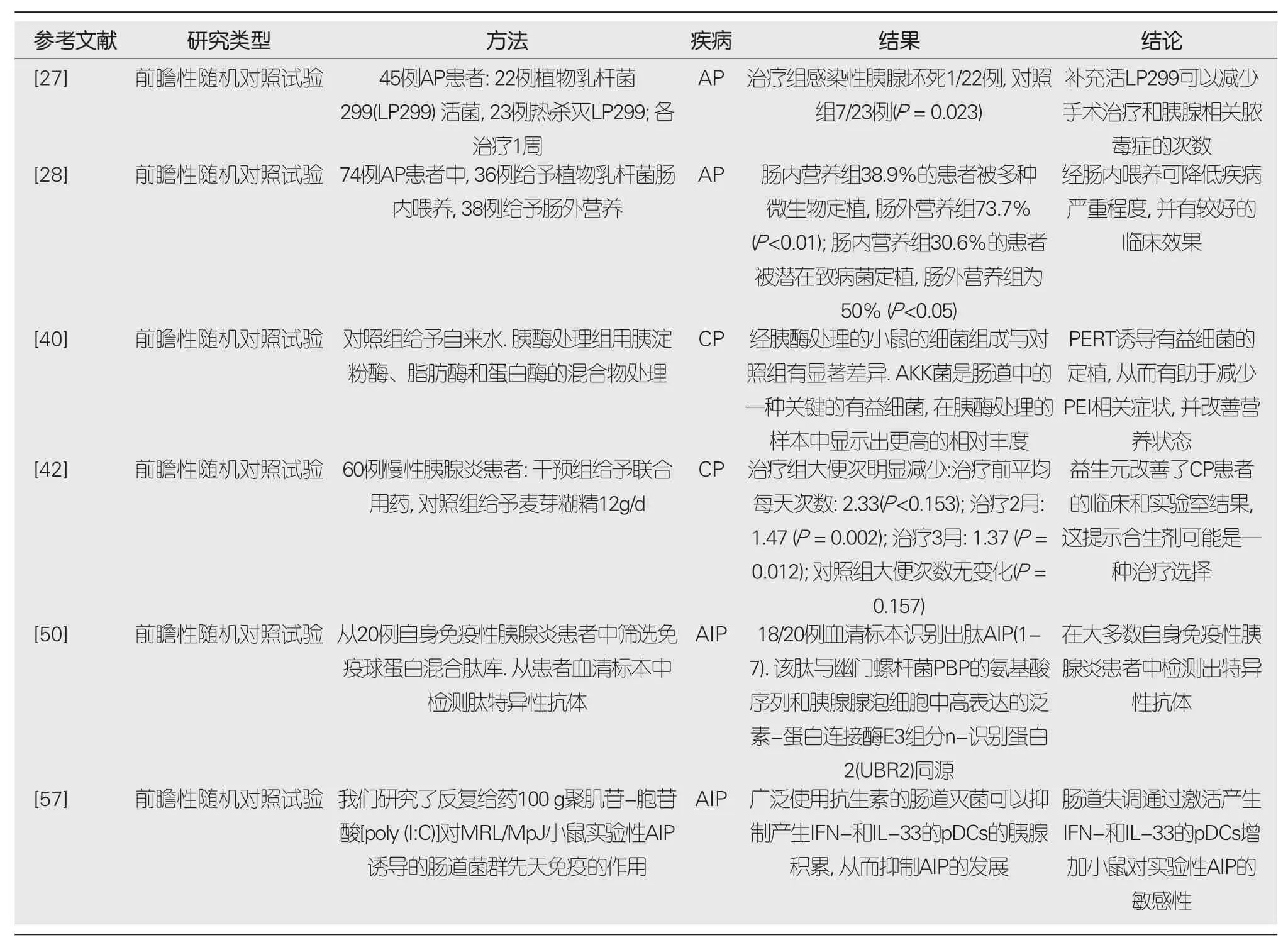
表2 肠道菌群与胰腺炎关系的研究
目前在不同研究中使用的益生菌类型和治疗策略还有较大差异,所以在进行临床试验之前,应考虑益生菌及其制剂的适当剂量和治疗时间.另外,考虑到一些益生菌的风险,进一步的临床试验应该仔细设计,以避免任何潜在的有害影响.同时,对胰腺炎相关菌群检测技术的选择及升级也很重要,菌群检测常见的方法有细菌培养、聚合酶链式反应技术(PCR)、基于PCR基础上的16SrRNA技术、荧光原位杂交、基因芯片、宏基因组测序以及单一菌株或者人体完整菌群的移植、用免疫系统确认致病原因、用机器学习等高级算法整合多组学数据等,有时候选择合适的检测技术及方法,往往能达到事半功倍的效果.当然,菌群特异性改变的分析还可以利用易于收集的样本,如根据血液、唾液和粪便等来开发出用于相应检测的新工具.

