普通肝素减少组蛋白诱导的小鼠肺组织多糖包被降解*
付似凤, 马晓春, 李 旭
(中国医科大学附属第一医院重症医学科,辽宁沈阳110001)
脓毒症是宿主对感染反应失调引起的多器官功能障碍,是一种危及生命的临床综合征[1]。尽管医学水平不断提高,仍缺乏有效的治疗方法。研究表明,组蛋白是促进脓毒症发生发展的主要介质[2],尤其是导致急性肺损伤的主要因素[3]。然而,组蛋白在脓毒症中具体的作用机制仍未明了。
近年来,多糖包被(glycocalyx)在脓毒症中的意义受到广泛关注。多糖包被是一层富含硫酸肝素的糖胺聚糖和蛋白聚糖,排列在血管内皮细胞表面,保护内皮细胞的稳定性[4]。多糖包被和内皮细胞是隔离血液和组织的第一道屏障,也是机体在脓毒症时最先受累的部位。脓毒症时,多糖包被大量降解,内皮细胞损伤,导致凝血活化,血管通透性增加,组织水肿,白细胞游走到血管外等,进而发生器官功能障碍,甚至导致患者死亡。黏结蛋白聚糖1(syndecan-1)是多糖包被的主要成分,脓毒症时被释放到血液中[5]。研究表明syndecan-1 水平能够预测感染性休克患者90 d 病死率[6]。由此可见,多糖包被结构与脓毒症的发生发展关系密切。
普通肝素(unfractionated heparin,UFH)是一种以抗凝血特性而闻名的糖胺聚糖。在脓毒症中除了抗凝作用外,还具有多种生物学活性,包括抑制炎症因子的产生和释放、保护多糖包被、降低血管通透性等[7-8]。本课题组前期研究表明,组蛋白能造成小鼠类似脓毒症样改变,普通肝素减轻组蛋白造成的肺损伤和凝血活化,进而抑制组蛋白的毒性[9]。然而,具体的作用机制尚不清楚。鉴于多糖包被破坏在脓毒症过程中的意义,及其在脓毒症凝血活化中的关键作用,组蛋白是脓毒症过程中重要的介质,但组蛋白是否破坏多糖包被进而影响凝血功能,目前尚未见报道。因此,本研究旨在探讨组蛋白对小鼠肺组织多糖包被的破坏及对肺凝血活化的影响,并探讨普通肝素的保护作用及机制,从而为其在脓毒症中的应用提供参考资料。
材料和方法
1 动物
1.1 实验动物及分组 32 只健康雄性 SPF 级C57BL/6 小鼠,质量20~25 g,8~12 周龄,均购于辽宁长生生物技术有限公司,许可证号为SCXK(辽)2015-0001。实验前于中国医科大学实验动物中心饲养1 周,常规饲料及饮水,昼夜交替12 h。将32 只小鼠按照随机数字表法将小鼠分为对照(control)组、普通肝素(UFH)组、组蛋白(histone)组及组蛋白+普通肝素(histone+UFH)组,每组8 只。所有的实验经中国医科大学实验动物中心伦理委员会批准,按照中国医科大学实验动物中心实验指南进行。(审批号:CMU2021066)
1.2 模型制备及处理 实验模型参照前期研究[9]。组蛋白组经小鼠尾静脉注射组蛋白(H9250)50 mg/kg;组蛋白+普通肝素组在注射组蛋白1 h 后经小鼠尾静脉注射普通肝素400 U/kg;普通肝素组给予普通肝素400 U/kg;对照组均给予等量生理盐水。
1.3 标本采集及处理 组蛋白注射4 h 后麻醉小鼠并迅速开胸取双肺,左肺测定检测组织因子(tissue factor,TF)、纤维蛋白原(fibrinogen,FIB)和syndecan-1 的mRNA 表达水平。取右肺上叶测定syndecan-1 的荧光表达水平;取右肺中叶立即置4%多聚甲醛中固定72 h,待病理学观察;取右肺下叶测定syndecan-1的蛋白表达水平;余肺叶立即置于无酶小离心管中,液氮保存24 h 后转移至-80 ℃冰箱留存备用。
2 方法
2.1 肺组织病理学观察 将充分固定的右肺经梯度乙醇(70%、80%、90%、95%、100%及100%)脱水、二甲苯透明、石蜡包埋后制片。将组织用切片机切成5 μm 连续切片以备染色。之后二甲苯脱蜡,苏木素核染色3 min,自来水清洗,1%的盐酸乙醇分化,自来水冲洗,伊红染色2 min,自来水冲洗,梯度乙醇脱水,二甲苯透明,晾干后中性树胶封片。苏木素-伊红(hematoxylin-eosin,HE)染色后,于光镜下观察小鼠肺组织形态学改变,并选取6~8 个随机视野分别就肺泡和间质炎症(白细胞浸润)、肺泡和间质水肿、肺泡壁增厚以及透明膜形成进行0~2 分半定量分析,累计各项评分的总分作为肺组织病理学评分[10]。
2.2 RT-qPCR 测定 TF、FIB 和 syndecan-1 的 mRNA表达水平 按照Trizol 试剂盒说明书提取总RNA,DEPC 水溶解,NanoDrop 进行纯度和浓度检测。按反转录试剂盒说明书操作步骤将所提RNA 反转录成cDNA,4 ℃保存,用于qPCR 反应。每个样本最少重复3 次,设置3 个复孔。反应条件为:预变性95 ℃30 s;95 ℃ 5 s,60 ℃ 45 s,40 个循环。所有实验步骤均遵循TB Green Premix Ex TapII 试剂盒(TaKaRa)。内参选用3-磷酸甘油醛脱氢酶(Glyceraldehyde Phosphate Dehydrogenase ,GAPDH),引物设计及合成由上海生工生物工程公司完成(表1)。使用2-ΔΔCT法计算TF、FIB和syndecan-1 mRNA 的表达量。
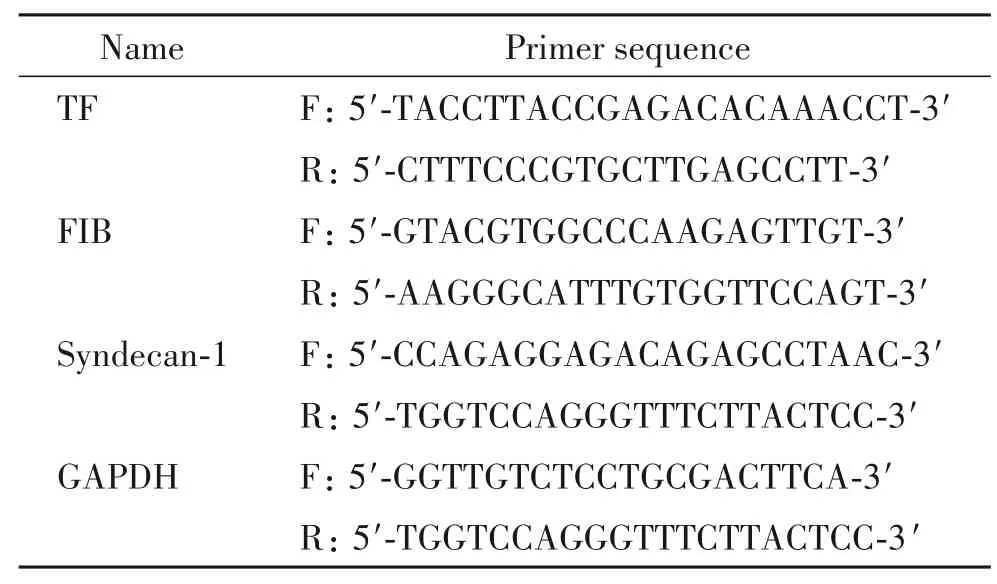
表1 RT-qPCR引物序列Table 1. Sequences of the primers for RT-qPCR
2.3 Western blot 检测syndecan-1 在肺组织的蛋白水平 采用异氟烷吸入麻醉小鼠,取右肺下叶。采用蛋白提取试剂盒(Beyotime)提取细胞核和细胞质蛋白,采用BCA 蛋白测定试剂盒(Beyotime)测定其浓度。将等量的蛋白质装入每孔(每孔30 μg),通过8%SDS-PAGE 分离,转移至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上。PVDF 膜用 TBST 洗涤(10 min ×3),然后用5%脱脂牛奶孵育2 h。PVDF 膜与稀释的Ⅰ抗(syndecan-1 和GAPDH)4°孵育过夜。用TBST 再次洗涤PVDF 膜,与酶标山羊抗兔IgG 在37 ℃孵育 2 h,ECL 化学液(Beyotime)显示 PVDF 膜上的蛋白带。成像仪扫描,应用图像分析软件(IamgeJ)进行分析。以GAPDH 蛋白表达为内参照,以目的蛋白和GAPDH 条带密度的比值表示目的蛋白的相对含量(灰度值比值=syndecan-1灰度值/GAPDH灰度值)。
2.4 免疫荧光检测肺组织中syndecan-1的表达 我们在4 μm 肺冰冻切片上进行处理,先用丙酮固定,在用PBS 洗涤切片,然后用抗syndecan-1 抗体37°恒温箱孵1 h。然后用磷酸盐缓冲液(phosphate buffer saline,PBS)清洗切片,用FITC 结合的Ⅱ抗室温孵育30 min。最后用DAPI染色细胞核。图像由荧光显微镜(Olympus BX53)获得。
3 统计学处理
采用SPSS 26.0 软件进行统计学分析,用Graph-Pad Prism 8 软件作图。计量资料采用均数±标准差(mean±SD)表示,组间均数比较采用重复测量方差分析或单因素方差分析(one-way ANOVA),组间两两比较方差齐时采用最小显著性差异法(LSD-t检验),方差不齐时采用Brown-Forsythe 和Welch ANOVE检验。以P<0.05为差异有统计学意义。
结 果
1 普通肝素对组蛋白诱导的肺组织病理学改变的影响
HE 染色显示,对照组和普通肝素组肺组织结构清晰,肺泡及毛细血管壁薄,肺泡腔无炎症细胞浸润,两组肺组织病理学评分无统计学意义(P>0.05);而组蛋白表现为肺泡间隔增宽,肺泡壁增厚,肺间质和肺泡腔出现炎症细胞,透明膜形成和红细胞大量渗出,肺组织病理学评分显著高于对照组(P<0.01);与组蛋白组相比,组蛋白+普通肝素组肺组织的肺泡结构可以辨认,肺泡间隔增宽、肺泡壁增厚和炎症细胞浸润均有所减轻,肺组织病理学评分显著降低(P<0.01),见图1。
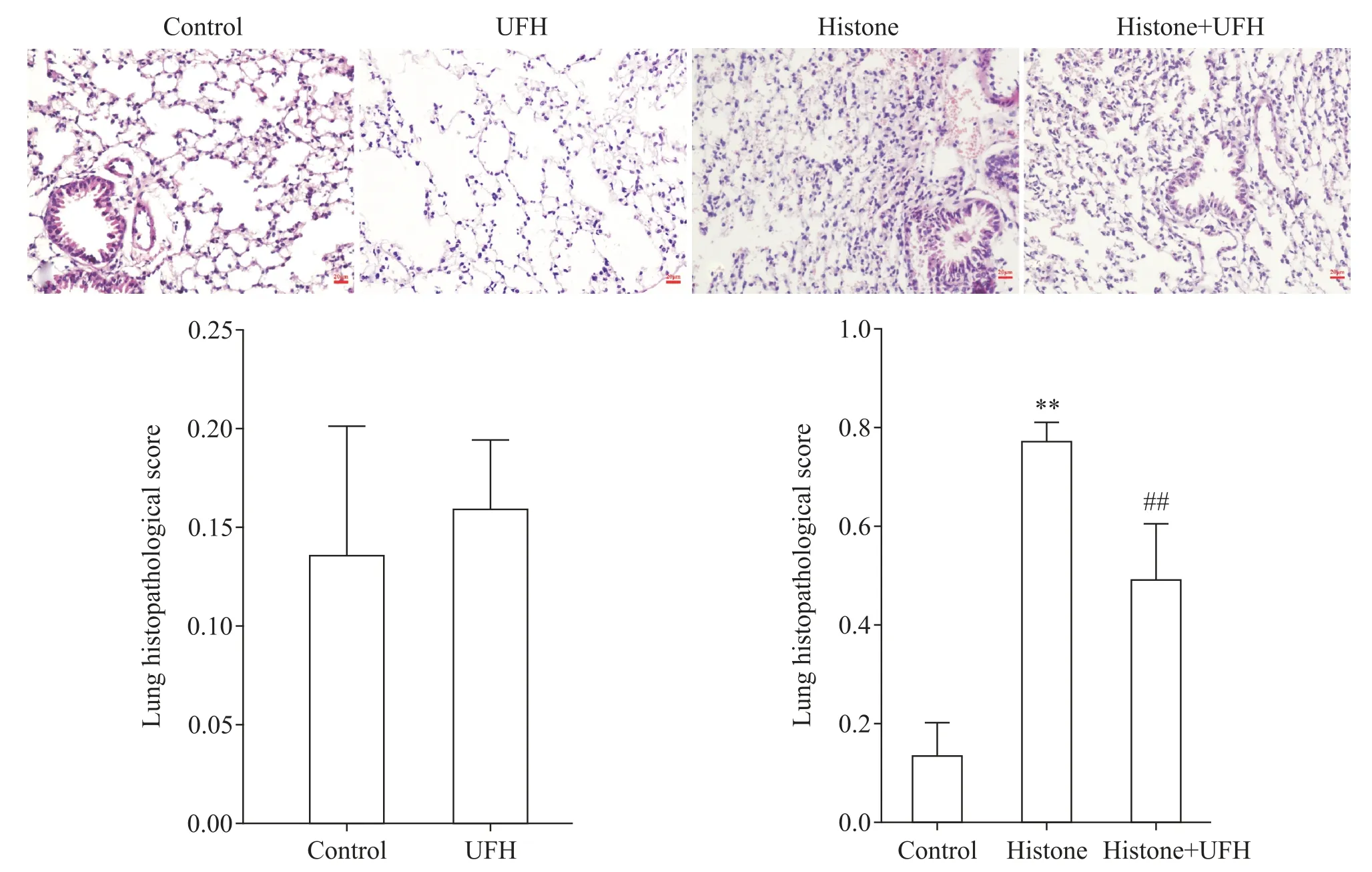
Figure 1. Representative photomicrograph of lung tissues(HE staining,scale bar=20 μm)and the histopathological scores of lung tissues in each group. The lung tissue showed complete alveolar structure in control group and unfractionated heparin(UFH)group. The lung tissue was significantly damaged in histone group,while the lung damage was significantly alleviated in histone+UFH group.图1 光镜下观察各组小鼠肺组织病理学改变
2 普通肝素对组蛋白诱导的肺组织TF、FIB 和syndecan-1 mRNA表达的影响
RT-qPCR 结果显示(表2),组蛋白组肺组织TF的mRNA 表达量较对照组的显著升高(P<0.01);组蛋白+普通肝素组TFmRNA 表达量约为对照组的3.57 倍(P<0.01),但较组蛋白组显著降低(P<0.01)。组蛋白组肺组织FIB的mRNA表达量较对照组显著升高(P<0.01);组蛋白+普通肝素组FIB 的mRNA 表达量约为对照组的9.72 倍(P<0.01),但较组蛋白组显著降低(P<0.01)。为进一步明确多糖包被的参与,我们检测syndecan-1 mRNA 水平的变化。结果组蛋白组肺组织syndecan-1 的mRNA 表达量较对照组的降低(P<0.01);组蛋白+普通肝素组syndecan-1 的 mRNA 表达量约为对照组的 0.74 倍(P<0.01),但较组蛋白组显著升高(P<0.01)。

表2 各组小鼠RT-qPCR结果Table 2. The results of RT-qPCR(Mean±SD. n=8)
3 普通肝素对组蛋白诱导的脓毒症小鼠syndecan-1蛋白表达的影响
Western blot结果显示,与对照组相比,组蛋白刺激后肺组织syndecan-1 蛋白表达显著降低(P<0.05);而普通肝素处理后,组蛋白刺激的肺组织syndecan-1的表达显著升高(P<0.01),见图2。

Figure 2. The protein expression of syndecan-1 in each group was detected by Western blot. UFH:unfractionated heparin. Mean±SD. n=8.*P<0.05 vs control group;##P<0.01 vs histone group.图2 Western blot检测各组小鼠肺组织syndecan-1蛋白表达
4 免疫荧光染色检测普通肝素对组蛋白诱导的脓毒症小鼠syndecan-1表达的影响
免疫荧光染色结果显示,对照组肺组织可见syndecan-1阳性表达;组蛋白组多处血管内皮细胞有少量syndecan-1 阳性表达,组蛋白刺激后syndecan-1明显脱落,syndecan-1蛋白在肺组织中表达显著低于对照组(P<0.05);而组蛋白+普通肝素组部分血管内皮细胞syndecan-1阳性表达较组蛋白组增多,普通肝素减少了组蛋白刺激的syndecan-1 脱落,syndecan-1的表达水平较组蛋白组显著升高(P<0.01),见图3。
讨 论
通过对组蛋白损伤小鼠模型的研究,我们证实组蛋白可导致小鼠肺损伤和肺凝血活化,表现为肺组织TF 和FIB 的mRNA 水平增高,进一步研究组蛋白毒性的机制,证实组蛋白增加多糖包被降解,表现为肺组织syndecan-1 mRNA 水平和蛋白水平及其在肺组织的表达均减少。组蛋白已经导致损伤后,普通肝素仍能发挥保护作用,抑制肺组织syndecan-1的降解,进而抑制肺凝血活化,减轻肺损伤严重程度,发挥保护作用。
脓毒症是重症监护病房(ICU)患者常见的临床综合征,发病率及病死率高,存活患者也因各种并发症导致生存质量显著下降[11-12]。因此,深入了解脓毒症的发病机制,寻找有效的治疗方法至关重要。包括炎症、免疫和凝血功能障碍等多系统参与,涉及细胞功能、代谢和微循环的改变[13-15],内皮细胞损伤和微血栓形成是脓毒症发生发展的两个主要部分[16]。组蛋白是存在于所有真核细胞中的阳离子蛋白,是核染色质的重要结构组成部分。细胞外组蛋白具有细胞毒性,可导致免疫损伤[17]。据报道,脓毒症患者循环中组蛋白浓度与病死率正相关[18]。组蛋白还能够造成小鼠发生类似脓毒症样改变,直接损伤内皮细胞和上皮细胞,活化凝血[19]。在急性肺损伤中,细胞外组蛋白是组织损伤和炎症的重要效应物,且组织损伤的程度与血栓形成的数量和时间呈正相关[20]。因此,组蛋白被认为是脓毒症过程中的关键介质[2],可能成为脓毒症新的生物标记物以及治疗的干预靶点。TF 和FIB 是参与机体凝血反应的重要因子,TF作为脓毒症凝血活化的始动因素,促进凝血酶的生成,进而导致FIB 转变为纤维蛋白,加速血液凝固,形成血栓。本研究首先检测组蛋白刺激下肺组织TF 和FIB mRNA 的表达情况,以明确组蛋白对凝血的活化的影响。结果表明,在给予组蛋白刺激后,小鼠发生了明显的肺损伤、肺凝血活化,与前期报道一致。我们进一步研究了组蛋白导致肺损伤及凝血活化的机制。
血管内皮表面覆盖一层绒毛样结构叫做多糖包被[21-22]。生理情况下,多糖包被保护血管内皮细胞,参与调节凝血稳态和血管通透性等过程[23]。Wiesinger 等通过体内和体外实验证实,在脓毒症模型中,多糖包被的厚度明显降低[24]。脓毒症时,多糖包被首先被破坏脱落入血。研究报道,脓毒症患者血浆中可检测到脱落的多糖包被成分,如syndecan-1和透明质酸,且与病情严重程度相关[25-26]。因此,多糖包被参与脓毒症发生发展,然而组蛋白是否能够破坏多糖包被,进而活化凝血,至今未见报道。本研究证实组蛋白造成小鼠肺组织syndecan-1降解,影响其mRNA 和蛋白表达,提示组蛋白可能通过破坏多糖包被进而活化凝血。普通肝素减少组蛋白造成的多糖包被破坏,减轻凝血活化,抑制组蛋白的毒性。
普通肝素不仅仅是一种抗凝剂[8]。多项临床研究、脓毒症动物模型和体外细胞实验都证明了普通肝素在脓毒症过程中发挥多种生物学活性[27-28]。本课题组前期研究表明普通肝素具有抗炎、改善内皮细胞通透性、减轻组蛋白毒性等多种生物学活性[29]。本研究中普通肝素可以减轻组蛋白介导的多糖包被损伤,抑制凝血活化,其发挥保护作用的机制可能是多方面的:第一,组蛋白带有正电荷,普通肝素带有负电荷,组蛋白能与带有10 个以上的硫酸肝素侧链的分子结合[30]。因此,普通肝素可能通过与胞外组蛋白直接结合,拮抗蛋白毒性,减轻其对多糖包被和内皮细胞的损伤;第二,脓毒症时肝素酶等生成增加,介导多糖包被成分硫酸乙酰肝素(HS)重构,促进多糖包被降解,普通肝素和HS 结构相似,对肝素酶有抑制作用[31],因此,普通肝素可能通过抑制肝素酶保护多糖包被;第三,基质金属蛋白酶(MMP)-9可以直接破坏多糖包被,普通肝素抑制MMP 活性,可能通过抑制MMP-9 进而保护多糖包被[32]。因此,普通肝素对组蛋白介导的多糖包被的保护作用机制还有待深入研究。
组蛋白是脓毒症的重要介质之一,本研究在组蛋白作用1 h 后给予普通肝素,更接近临床过程,以往的研究大多普通肝素预处理或与组蛋白同时注射[33-34]。多糖包被在脓毒症中的作用越来越受到关注,本研究证实普通肝素可以抑制组蛋白造成的多糖包被降解,发挥保护作用,因此可能为普通肝素的脓毒症中的应用提供参考资料。本项工作的局限之处:研究证实组蛋白能造成小鼠多糖包被损伤,普通肝素能够有效抑制组蛋白的毒性作用,但普通肝素对多糖包被的保护作用机制尚需进一步研究;本项工作仅观察了组蛋白损伤的单一时点(4 h),对于不同时间点多糖包被的动态变化以及普通肝素的保护作用值得进一步研究。
综上所述,本项工作证实组蛋白可导致小鼠肺损伤、凝血活化及肺组织多糖包被破坏;普通肝素能有效减轻组蛋白诱导的小鼠肺损伤、凝血活化和肺组织多糖包被破坏。

