SUMO蛋白质修饰化CRMP2在胶质瘤细胞中表达变化及对细胞增殖的影响
王垒垒,吉苏珍,刘志峰
1沧州市中心医院脑科院区神经外科,河北沧州061000;2沧州市中心医院西院区急诊ICU
胶质瘤是中枢神经系统最常见的恶性肿瘤。由于多数病例确诊较晚、治疗抵抗等原因,导致胶质瘤的复发率较高,患者中位生存期仅为14个月[1-4]。因此,进一步了解胶质瘤发病的分子机制对新的治疗靶点的开发有重要意义。CRMP2是一种微管相关蛋白,在神经组织中表达丰富,除了崁合于微管侧壁稳定微管促进微管组装之外,还作为细胞内信号分子参与细胞迁移、分化、突起生长、可塑和再生等病理生理过程。研究显示,CRMP2翻译后修饰在其功能调节中起到了至关重要的作用[5-10]。SUMO蛋白质修饰化是存在于各种细胞生物学过程中的翻译后调节,如转录调控、蛋白质稳定性和转运、细胞凋亡、应激反应和细胞周期等。Ucb9是一种缀合酶,近期研究人员发现,感觉神经元中存在CRMP2的蛋白修饰化位点,这一位点可被Ubc9修饰[11-13]。2020年6月—2021年8月,观察了SUMO蛋白质修饰化CRMP2在胶质瘤细胞中的表达变化及对细胞增殖的影响。
1 材料与方法
1.1 细胞与主要实验材料人胶质瘤细胞系 A172、U87、GL15购自中国科学院细胞库,培养于含10%胎牛血清的DMEM完全培养基中,培养条件为37 ℃、5%CO2、饱和湿度。CRMP2、SUMO1、UBE2I/UBC9、Human IgG一抗及β-actin抗体购自美国Abcam公司。人CRMP2的全长编码区基因购自美国OriGene公司。Q5®定点诱变试剂盒购自新英格兰生物实验室。Lipofectamine2000试剂购自美国Invitrogen公司。5-乙炔基-2′-脱氧尿苷(EdU)标记购自德国Sigma-Aldrich公司。红色荧光叠氮化物AlexaFluor®594购自美国赛默飞科技公司。
1.2 胶质瘤细胞中Ucb9、CRMP2、SUMO蛋白质修饰化CRMP2检测 采用Western blotting法。提取3种胶质瘤细胞总蛋白。取150 μg蛋白,100 g/LSDS-PAGE电泳分离蛋白,电转移至PVDF膜。0.05 g/mL脱脂奶粉封闭2 h,加入特异性兔抗人CRMP2(1∶1 000)、SUMO1(1∶1 500)、UBE2I/UBC9(1∶500)、IgG(1∶2 000)一抗,以β-actin作为内参,4 ℃过夜。加入小鼠抗兔IgG二抗(1∶1 000)孵育1 h。采用凝胶成像分析系统扫描.以目的蛋白条带灰度值与内参条带灰度值的比值表示目的蛋白相对表达量。选取能稳定表达胶质瘤所特有的细胞标志物,并已用于多种增殖相关细胞因子研究的GL15细胞进行后续实验[14]。
1.3 SUMO蛋白质修饰化CAMP2对胶质瘤细胞增殖影响的观察 将GL15细胞分为pCMV-CRMP2组、pCMV-CRMP2-K374A组及空白对照组。将pCMV质粒载体与人CRMP-2全长编码混合;使用Q5®定点诱变试剂盒通过定点诱变诱导突变的核苷酸,构建pCMV-CRMP2-K374A,使得细胞被SUMO蛋白质修饰化能力下降。pCMV-CRMP2为阳性对照。pCMV-CRMP2组、pCMV-CRMP2-K374A组、空白对照组分别使用Lipofectamine2000试剂转染pCMV-CRMP2、pCMV-CRMP2-K374A及pCMV质粒载体。pCMV-CRMP2、pCMV-CRMP2-K374A、空白对照组CAMP2相对表达量分别为1.18±0.067、1.21±0.071、0.81±0.043,pCMV-CRMP2组和pCMV-CRMP2-K374A组细胞中CAMP2表达均高于空白对照组(P均<0.05)。使用EdU(25 μg/mL)孵育细胞4 h后,甲醇固定细胞5 min,用磷酸盐缓冲盐水洗涤。红色荧光AlexaFluor®594叠氮化物用于显示结合的EdU,DAPI染核。蔡司显微镜下观察并采集图像,使用Image J软件进行分析。
1.4 Ucb9介导CAMP2的SUMO蛋白质修饰化对胶质瘤细胞增殖影响的观察 将GL15细胞分为对照组及Ucb9组,Ucb9组使用Lipofectamine2000试剂将Ucb9类似物t-CSM肽20 μmol/L转入GL15细胞,对照组转入同等量0.01%二甲基亚砜。提取两组总蛋白,采用Western blotting法检测Ucb9、CRMP2蛋白,对照组、Ucb9组细胞中CAMP2相对表达量分别为0.80±0.046、0.78±0.045,Ucb9相对表达量分别为0.64±0.040、1.05±0.061,Ucb9组细胞中Ucb9表达水平高于对照组(P<0.05)。细胞增殖实验检测细胞增殖能力。方法同“1.3”。

2 结果
2.1 胶质瘤细胞中Ucb9、CRMP2、CUMO蛋白质修饰化CRMP2表达情况 GL15、A172、U87细胞中均表达Ucb9、CRMP2、SUMO蛋白质修饰化CRMP。3种胶质瘤细胞CRMP2、Ucb9U表达由高到低依次为U87、GL15、A172细胞,两两相比,P均<0.05。见图1、表1。GL15、A172、U87细胞中CRMP2与Ucb9表达均呈正相关(r分别为0.87、0.79、0.81,P均<0.05),SUMO蛋白质修饰化CAMP2与Ucb9表达呈正相关(r分别为0.76、0.80、0.77,P均<0.05)。
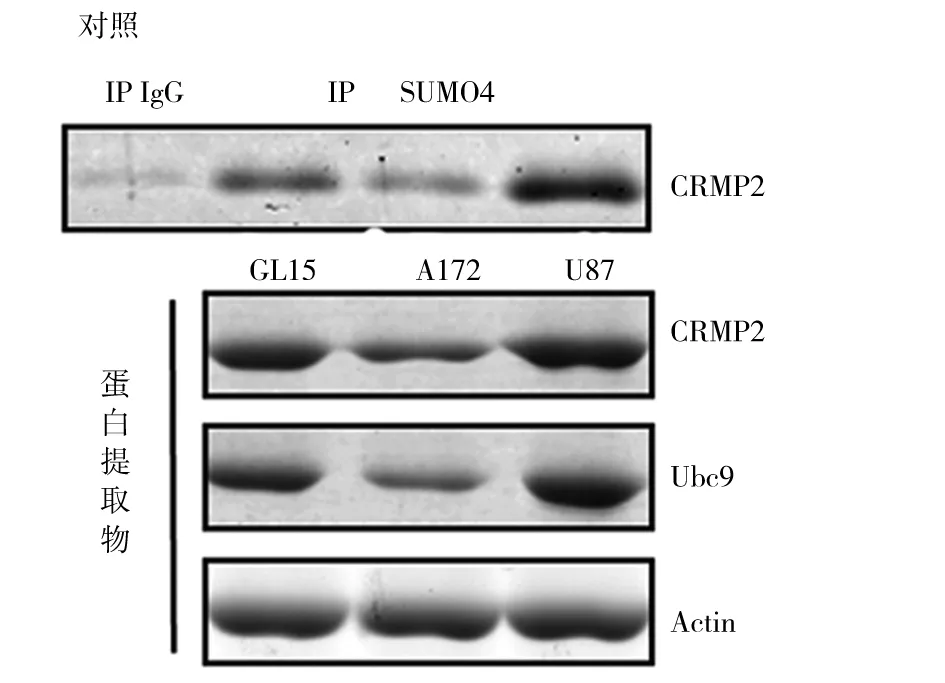
图1 GL15、A172、U87细胞中CRMP2、Ucb9及SUMO蛋白质修饰化CAMP2表达情况(Western blotting法)
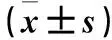
表1 GL15、A172、U87细胞中CRMP2、Ucb9及SUMO蛋白修饰化CRMP2表达情况
2.2 SUMO蛋白修饰化CRMP2对胶质瘤细胞增殖的影响 pCMV-CRMP2组、pCMV-CRMP2-K374A组、空白对照组细胞增殖能力分别为1.53±0.052、0.98±0.023、0.96±0.024。pCMV-CRMP2组细胞增殖能力高于pCMV-CRMP2-K374A组及空白对照组(P均<0.05)。见图2。
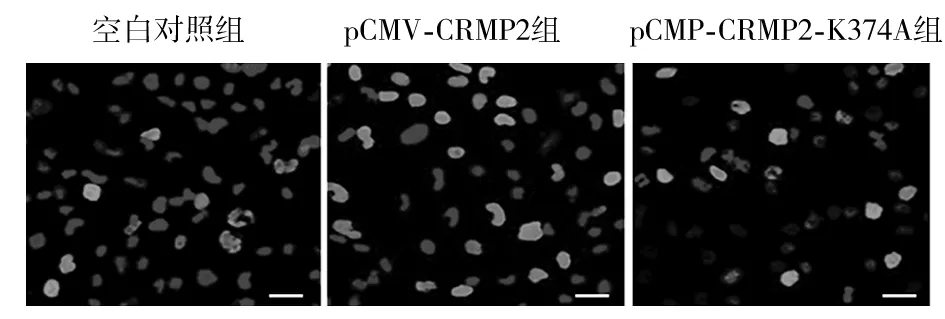
图2 pCMV-CRMP2组、pCMV-CRMP2-K374A组、空白对照组细胞增殖情况(CCK-8法)
2.3 Ucb9介导CRMP2的SUMO蛋白修饰化对胶质瘤细胞增殖的影响 Ucb9组、对照组细胞增殖能力分别为1.65±0.063、0.91±0.031,Ucb9组细胞增殖能力高于对照组(P<0.05)。见图3。
图3 Ucb9组、对照组细胞增殖情况(CCK-8法)
3 讨论
胶质瘤是发病率最高的颅内恶性肿瘤,因其放化疗耐受、浸润性生长、无限增殖的特性,使其成为恶性程度最高的肿瘤之一。如何有效抑制胶质瘤细胞的增殖、迁移、侵袭是胶质瘤基础研究的热点。研究表明,转录后修饰,尤其是磷酸化和SUMO蛋白修饰化,赋予CRMP2在神经系统中调节多种信号通路的能力。针对CRMP2磷酸化在恶性肿瘤中作用的研究结果显示,CRMP2基因丝氨酸522位点被CDK5磷酸化是GSK3B进一步磷酸化和SUMO蛋白修饰化所必需的,CRMP2磷酸化和蛋白修饰化可协同诱导恶性肿瘤细胞增殖[15,16]。有学者使用序列比对和结构分析,鉴定了CRMP2基因的赖氨酸374位点的SUMO蛋白修饰化点。有研究证明,Cdk5可使四聚体解体成单体,从而暴露SUMO蛋白修饰化位点。CRMP2在神经元极性、神经突向外生长、轴突导向、神经递质释放和神经元细胞死亡中起重要的调节作用。Rho相关蛋白激酶将CRMP2磷酸化,可抑制CRMP2结合微管蛋白异二聚体的能力,从而导致微管去稳定化,最终使轴突生长,因此,它被认为是阿尔茨海默病的潜在治疗靶点。有研究表明,CRMP2的SUMO蛋白修饰化可以调节儿茶酚胺A分化细胞的钠电流和NaV1.7转运,阻断CRMP2蛋白修饰化可降低NaV1.7钠电流,减轻神经性疼痛[17-19]。
本研究旨在探讨SUMO蛋白质修饰化CAMP2在胶质瘤中的表达变化及对细胞增殖的影响。结果显示,3种胶质瘤细胞CRMP2、Ucb9表达由高到低依次为U87、GL15、A172细胞,考虑表达差异与不同胶质瘤细胞恶性程度有关。3种胶质瘤细胞中CRMP2表达与Ucb9含量呈正相关,验证Ucb9对CRMP2有SUMO蛋白修饰化作用。本研究选取GL15细胞进行随后的实验研究,采取构建质粒载体及细胞转染的方法制备不同组别GL15细胞进行研究。细胞增殖实验结果表明,单纯CAMP2表达升高的胶质瘤细胞增殖能力较空白对照组明显升高,但当胶质瘤细胞CRMP2的SUMO蛋白修饰化位点发生突变后其增殖活性下降。这些结果表明,CRMP2及其SUMO蛋白修饰化在胶质瘤细胞增殖中起到了一定作用。
Ubc9是一种E2 SUMO缀合酶,可介导CRMP2的SUMO蛋白修饰化[20]。我们假设,通过靶向调节Ucb9进而调节CRMP2的SUMO蛋白修饰化是胶质瘤潜在的治疗策略。本研究采取细胞转染的方法制备Ucb9表达明显升高的胶质瘤细胞,进一步的细胞增殖实验结果显示,Ucb9表达升高后,胶质瘤细胞的增殖能力也明显增强,表明Ucb9介导的CRMP2 SUMO蛋白修饰化在胶质瘤细胞增殖中起到正性作用。
综上所述,CRMP2及其SUMO蛋白修饰化在胶质瘤细胞恶性生物学行为中存在协同作用。CRMP2及其SUMO蛋白修饰化可介导胶质瘤细胞增殖,通过调节CRMP2表达或使其SUMO蛋白修饰位点突变,可改变胶质瘤细胞增殖活性。以往研究结果显示,CRMP2在恶性肿瘤细胞中普遍表达,可促进细胞增殖,磷酸化可使这一作用增强。本研究结果显示,在胶质瘤细胞中,Ucb9介导的CRMP2 SUMO蛋白修饰化使得磷酸化CRMP2的生物学作用进一步增强,从而驱动胶质瘤细胞增殖。以上结果进一步阐述了胶质瘤的发病机制,通过靶向抑制CRMP2 SUMO蛋白修饰化有望成为胶质瘤治疗的新策略。

