积雪草苷对小鼠糖尿病心肌病的干预作用及机制探讨
杨勇,魏东明,乔锐,刘洋,杨剑
1渭南市中心医院胸心外科,陕西渭南714099;2空军军医大学西京医院心血管外科
糖尿病心肌病(DCM)是常见的糖尿病并发症,可引起心律失常、心力衰竭甚至心源性猝死,是糖尿病患者的主要死亡原因之一[1-2]。DCM是一种慢性心肌功能障碍,微血管病变是造成DCM病理改变的主要原因,可通过心肌细胞凋亡等机制造成心脏结构和功能损害,但具体发病机制尚不明确[3-4]。Notch通路是一种进化保守的信号通路,在多种组织中参与维持细胞多能性,在胚胎发育、细胞再生中起关键作用[5-7]。多项研究表明,Notch信号通路是糖尿病及其并发症发病的关键分子,其介导的相关凋亡和自噬与DCM心肌损伤关系密切[8-10]。目前DCM的治疗缺乏针对性药物,多以对症为主,缺乏有效的治疗靶点。中药提取物积雪草苷(ASI)具有较强的抗氧化应激、抑制心肌纤维化作用,可通过不同机制修复心肌损伤。2021年1月—8月,本研究观察了ASI对DCM小鼠心肌损伤的干预作用,并从细胞凋亡和Notch1/Hes1信号通路方面探讨相应机制,现报告如下。
1 材料与方法
1.1 实验动物与主要材料 8周龄健康雄性C57/BL小鼠60只,体质量(22.07±1.03)g,购自空军军医大学实验动物中心,许可证号SYXK(陕)2019-001。Bcl-2、Bax、Caspase-3、Notch1、Hes1、β-actin抗体及ASI购于美国Sigma公司。链脲佐菌素(STZ)购于天津泰泽兴业生物科技有限公司。肌酸激酶同工酶(CK-MB)试剂盒、结缔组织生长因子(CTGF)试剂盒购于美国R&D Systems公司。FV2000激光共聚焦显微镜购于日本奥林巴斯公司。Vevo2100小动物超声仪购于美国VisualSonics公司。
1.2 动物分组、给药方法及模型诱导 60只小鼠按照随机数字表法随机分4个组,每组15只,即对照组(Sham组)、DCM组、ASI干预组(ASI+DCM组)和ASI与Notch1抑制剂DAPT联合干预组(ASI+DAPT+DCM组)。Sham组以普通饲料喂养,其余组高脂饲料喂养至实验结束。喂养1个月后,DCM组、ASI+DCM组、ASI+DAPT+DCM组禁食12 h,腹腔注射STZ 72 h,测尾静脉空腹血糖>16.7 mmol/L为造模成功。ASI+DCM组腹腔注射ASI 10 mg/(kg·d),ASI+DAPT+DCM组腹腔注射ASI 10 mg/(kg·d)和DAPT 10 mg/(kg·d),DCM组给予相同体积生理盐水,共给药5个月进行后续实验。
1.3 心功能评价 每组取15只小鼠,各组小鼠经2%异氟烷麻醉后,固定小鼠,将小鼠四肢固定于Vevo2100超声仪电极上,温度设定为37 ℃。用探头在乳头肌水平位置用M型取样线检测,通过软件测量并计算得出左心室射血分数(LVEF)、左心室短轴缩短率(FS)、左心室舒张末期容积(LVEDV)、左心室收缩末期容积(LVESV)、左心室舒张期前壁厚度(LVAWd)等指标。
1.4 心肌损伤及纤维化观察
1.4.1 血清CK-MB、CTGF检测 每组取6只小鼠,各组小鼠经2%异氟烷麻醉后,固定小鼠,剪开并剥离小鼠颈部皮肤、皮下组织,暴露小鼠颈动脉,以组织剪剪开快速取血2 mL至EP管中,3 000 r/min离心15 min,取上层血清。按照CK-MB、CTGF检测试剂盒说明书检测血清CK-MB、CTGF。
1.4.2 心肌结构及纤维化程度观察 每组取5只小鼠,各组小鼠经2%异氟烷麻醉后迅速剪下心脏,冷PBS缓冲液冲洗3遍,洗净残余血细胞后,以多聚甲醛(40 g/L)固定72 h,石蜡包埋、切片,行HE、Masson染色,在光学显微镜下观察并拍摄。
1.5 心肌细胞凋亡观察 每组取5只小鼠,各组小鼠心肌组织石蜡切片按TUNEL试剂盒说明书染色后,在荧光显微镜下观察并拍摄图像,每张切片随机选取10个高倍视野进行盲法观察。DAPI染色的每1个阳性点均作为1个细胞计数,与之重叠的绿点为凋亡细胞,用盲测凋亡细胞数除总细胞数反映心肌细胞凋亡程度。采用RT-PCR法检测心肌组织中的Bax、Caspase-3 mRNA。用TRIzol试剂从心肌组织中分离总RNA,逆转录实验生成cDNA。用BIO-RAD分光光度法测定RNA和cDNA的浓度和纯度。采用Primer Premier6.0软件设计并由上海吉凯基因有限公司合成引物。Bax mRNA上游引物序列为5′-AGGGTTTCATTCCAGGATCGAGC-3′,下游引物序列为5′-AGGCGGTGAGGACTCCAGCC-3′;Caspase-3 mRNA上游引物序列为5′-CCTGAAATGGGCTTGTGT-3′,下游引物序列为5′-TGTCTCAATACCGCAGTC-3′;内参GAPDH上游引物序列为5′-GGCACAGTCAAGGCTGAGAATG-3′,下游引物序列为5′-TGGTGGTGAAGACGCCAGTA-3′。进行PCR扩增,以2-ΔΔCt表示目的基因相对表达量。采用Western blotting法检测心肌组织中的Bcl-2、Bax、Caspase-3蛋白。各组小鼠心肌组织取相同质量放入离心管中,加入预冷PBS,剪碎心肌组织,4 ℃下3 000 r/min离心10 min,弃上清。沉淀中加入含蛋白酶抑制剂的RIPA强裂解液,冰上充分研磨并裂解30 min,4 ℃下12 000 r/min离心30 min,取上清。BCA法蛋白定量,电泳并用湿转法将蛋白转移至PVDF膜,5%脱脂奶粉室温下封闭2 h,裁剪目的条带,放入对应一抗(Bcl-2 1∶1 000、Bax 1∶1 000、Caspase-3 1∶1 000)和β-actin抗体(1∶5 000),4 ℃摇床孵育过夜。TBST洗脱5次,5分钟/次,将目的条带放入山羊抗兔或山羊抗鼠二抗(1∶5 000)中室温摇床孵育2 h,TBST洗脱5次,每次5 min。ECL化学发光液避光检测,Image Lab软件分析灰度值。
1.6 心肌组织中Notch1/Hes1信号通路蛋白检测 每组取6只小鼠,采用Western blotting法检测心肌组织中的Notch1、Hes1蛋白,方法参考“1.5”。

2 结果
2.1 各组小鼠心功能指标比较 DCM组LVEF、FS、LVEDV低于Sham组,LVAWd高于Sham组(P均<0.05);ASI+DCM组LVEF、FS、LVEDV高于DCM组,LVAWd低于DCM组(P均<0.05);ASI+DAPT+DCM组LVEF低于ASI+DCM组,LVEDV高于ASI+DCM组(P均<0.05)。详见表1。
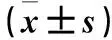
表1 各组小鼠心功能指标比较
2.2 各组小鼠心肌损伤及纤维化情况比较 DCM组血清CK-MB、CTGF水平高于Sham组,ASI+DCM组血清CK-MB、CTGF水平低于DCM组和ASI+DAPT+DCM组(P均<0.05)。见表2。Sham组小鼠心肌组织纤维排列整齐、无断裂,结构清晰,无或少有纤维化;DCM组可见细胞核多逸出,心肌结构排列紊乱,肌纤维断裂明显;与DCM组相比,ASI+DCM组肌纤维排列整齐,纤维化程度改善;与ASI+DCM组相比,ASI+DAPT+DCM组心肌纤维化程度明显增加,排列紊乱。见图1。
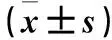
表2 各组小鼠血清CK-MB、CTGF比较
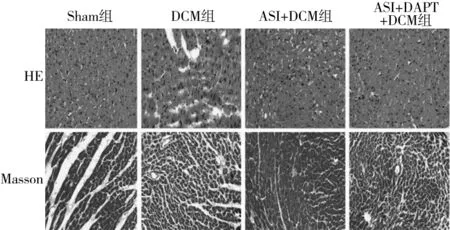
图1 各组小鼠心肌结构及组织纤维化情况
2.3 各组小鼠心肌组织凋亡相关指标比较 Sham组、DCM组、ASI+DCM组、ASI+DAPT+DCM组凋亡率分别为3.0%±1.2%、21.8%±3.0%、11.0%±1.6%、20.6%±2.7%,DCM组、ASI+DCM组、ASI+DAPT+DCM组细胞凋亡率高于Sham组,ASI+DCM组细胞凋亡率低于DCM组、ASI+DAPT+DCM组(P均<0.05)。见图2。DCM组心肌组织Bax、Caspase-3 mRNA表达高于Sham组,ASI+DCM组Bax、Caspase-3 mRNA表达低于DCM组、ASI+DAPT+DCM组(P均<0.05)。DCM组心肌组织中Bcl-2蛋白表达低于Sham组,Bax、Caspase-3蛋白表达高于Sham组(P均<0.05);ASI+DCM组Bcl-2蛋白表达高于DCM组、ASI+DAPT+DCM组,Bax、Caspase-3蛋白表达低于DCM组和ASI+DAPT+DCM组(P均<0.05)。见表3。
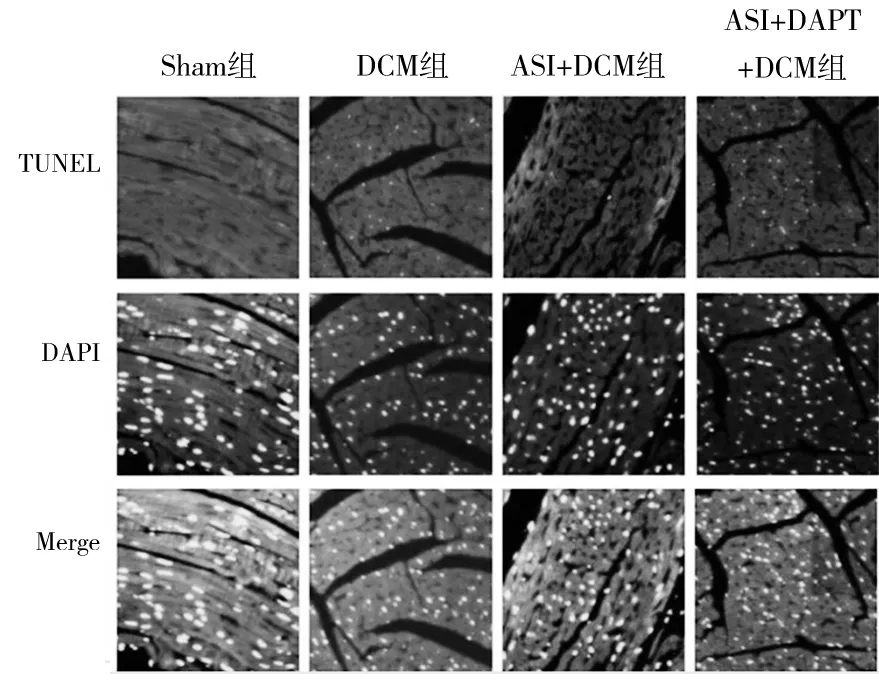
图2 各组小鼠心肌细胞凋亡情况
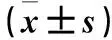
表3 各组小鼠心肌组织Bax mRNA、Caspase-3 mRNA及Caspase-3、Bcl-2、Bax、Notch1、Hes1蛋白相对表达量比较
2.4 各组小鼠心肌组织中Notch1/Hes1信号通路蛋白表达比较 DCM组心肌组织中Notch1、Hes1蛋白表达低于Sham组,ASI+DCM组Notch1、Hes1蛋白表达高于DCM组、ASI+DAPT+DCM组(P均<0.05)。见表3。
3 讨论
糖尿病患者心肌组织功能和结构变化普遍存在。DCM发病机制目前还不完全清楚。研究表明,包括心肌细胞自噬、线粒体功能障碍和凋亡在内的多种生物学过程参与其发病和进展[9-10]。ASI是一种中药提取物,具有包括抗氧化和抗纤维化在内的心脏保护作用。DCM是糖尿病微循环系统的并发症之一,严格控制糖尿病患者血糖及抗凋亡有助于减少、减轻糖尿病心脏并发症[11-12]。Notch信号通路与血管发育、内环境稳定和炎症反应有关[11,13-14]。Notch受体(Notch1-4)是一种跨膜蛋白,在细胞表面表现为异二聚体。Notch通路是一种进化上保守的信号通路,可调节细胞的自我更新、组织的生长发育[15]。Notch1信号通路的下游基因包括Hes1和HRT,通路激活可减少心肌细胞凋亡。Notch1/Hes1信号通路在心血管系统细胞增殖、修复中具有重要作用[16-17],但其在DCM诱发心肌损伤中对凋亡的调控作用仍未明确。
本研究制作了DCM小鼠模型,给予ASI干预,结果显示,ASI+DCM组心功能指标优于DCM组和ASI+DAPT+DCM组,心肌损伤指标CK-MB、纤维化指标CTGF低于DCM组和ASI+DAPT+DCM组,提示ASI可显著改善心肌收缩和舒张功能,减轻心肌损伤和心肌纤维化。进一步观察凋亡情况发现,ASI+DCM组细胞凋亡率低于DCM组、ASI+DAPT+DCM组;ASI+DCM组Bax、Caspase-3 mRNA和蛋白表达低于DCM组、ASI+DAPT+DCM组,Bcl-2蛋白表达高于DCM组、ASI+DAPT+DCM组。这表明ASI的心肌保护作用可能与抑制细胞凋亡有关。
Notch1和Hes1已被证明能通过多种途径抑制细胞凋亡、促进细胞存活以保护心脏的结构和功能[18-19]。Notch通路在心脏缺血期间起着关键作用,激活Notch1/Hes1信号可减轻缺血再灌注损伤,而这些保护作用也随着Hes1的抑制而消失[13]。正常生理条件下,成年大鼠心脏中缺乏Notch信号因子,在心肌梗死边缘区或压力负荷心脏中Notch信号被激活,心脏组织中特异性下调Notch1可导致心肌肥大、收缩功能抑制、心肌梗死和心肌细胞凋亡[14]。由于Notch1直接靶向Hes1,ASI可能通过激活Hes1在DCM模型中发挥心肌保护作用。本研究结果显示,在DCM小鼠模型中,Notch1、Hes1蛋白表达均下调,而ASI干预后Notch1和Hes1蛋白表达上调,高于DAPT联合干预组,提示ASI的作用可能与调节Notch1/Hes1信号通路有关。DAPT是一种有效的特异性抑制剂,已被广泛应用于特异性阻断Notch1通路功能[3,20]。因此,抑制Notch1/Hes1通路可能部分消除ASI对高糖诱导的心肌细胞的保护作用。DAPT还可以部分消除ASI通过Notch1/Hes1通路对细胞凋亡的影响。这进一步佐证了ASI与Notch1/Hes1信号通路的关联。
结合上述研究结果,我们认为,ASI可减轻糖尿病心肌病小鼠心肌损伤,减轻心肌纤维化,作用机制可能与抑制Notch1/Hes1信号通路、减少心肌细胞凋亡有关。以上结果进一步阐明了DCM的发病机制,为预防和治疗DCM药物的研究提供了参考。

