Tfh、Tfr及N-末端脑钠肽前体在不完全川崎病诊治中的表达
纪小琳,沈伟锋,汤冬梅,施佳卿
(嘉兴学院附属第一医院/嘉兴市第一医院 1.检验科;2.儿科,浙江 嘉兴 314000)
川崎病(Kawasaki disease,KD)是一种急性、自限性和以全身性血管炎性病变为主要特征的疾病,近年来该病发生率呈上升趋势。KD可以累及小动脉等全身血管,最常见的是冠状动脉受累。冠状动脉损伤(coronary artery lesion,CAL),甚至淀粉样脑血管病(cerebral amyloid angiopathy,CAA)的发生,已成为发达国家儿童后天获得性心脏病的重要原因,也是成年后易患冠状动脉粥样硬化的危险因素[1]。KD大多为完全川崎病(complete Kawasaki disease,CKD),而不完全川崎病(incomplete Kawasaki disease,IKD)占13%~30%。IKD临床特征不明显,目前尚未找到具有明显特异性的指标[2]。研究发现,滤泡辅助T(follicular helper T,Tfh)细胞在多种自身免疫性疾病及血管炎性疾病中呈高表达[3],滤泡调节性T细胞(follicular regulatory T cell,Tfr)降低导致炎性因子的释放及自身免疫抗体的激活[4]。阿司匹林联合丙种球蛋白治疗KD是一种安全有效的方法[5]。那么,Tfh及Tfr的表达是否与阿司匹林联合丙种球蛋白治疗CKD、IKD及并发CAL的治疗效果存在关联值得研究。本研究通过分析IKD、CKD患儿经阿司匹林及丙种球蛋白治疗后临床疗效、实验室生化指标及Tfh、Tfr表达变化,以期为临床有效区分诊断IKD、CKD以及预测药物治疗效果提供研究方向和依据。
1资料与方法
1.1一般资料
选取2014年1月至2019年12月于嘉兴市第一医院接受治疗的272例川崎病患儿为研究对象,其中男152例,女120例,年龄6个月至7岁。收集患儿发热病程、住院期间首次完成超声心动图的冠脉损伤的时间等一般资料以及实验室检查指标,包含血常规、尿常规、血小板计数、红细胞沉降率(erythrocyte sedimentation rate,ESR)、C-反应蛋白(C-reactive protein,CRP)、心肌酶谱、N-末端脑钠肽前体(N-terminal pro-brain natriuretic peptide,NT-proBNP),心脏彩超测量冠脉内径。根据诊断标准分为完全川崎病组(CKD组,n=184)和不完全川崎病组(IKD组,n=88)。两组研究对象在年龄、性别方面差异无统计学意义(P>0.05),数据具有可比性。排除标准:①猩红热、风湿热等结缔组织疾病和不明原因发热;②临床资料不全;③有冠状动脉瘤、血栓形成、药物过敏等。所有研究对象的监护人均知情同意自愿参与研究。
1.2诊断标准
CKD诊断标准:根据美国心脏病学会诊断标准[6],持续发热时间大于5天(应用抗生素无效),同时以下5项临床表现具有4项及以上者,排除其他疾病后,即可以诊断:①四肢变化:急性期手足掌跖出现红斑,手足硬性水肿,而恢复期指趾端膜状脱皮;②出现双侧眼球结合膜充血;③出现多形性皮疹;④颈部淋巴结肿大,以单侧淋巴结肿大较为多见;⑤口腔黏膜弥漫性出血,口唇充血皴裂,舌乳头突出呈现草莓状;如不足4项,但出现心脏受累表现,亦诊断为CKD。IKD诊断标准:参照美国心脏病学会诊断标准[6],发热≥5天,具备KD症状中2~3项特征,C-反应蛋白>30mg/L且同时伴有以下项目中3项方可确诊为IKD:①白蛋白≤30g/L;②肝功能异常;③贫血;④发病超过7天后血小板增多,血小板>450×109;⑤尿常规检查白细胞>10个/HP。冠状动脉损害:①冠状动脉内径:6个月~3岁小于2.5mm,3~9岁在3.0mm及以上;②冠脉内膜回声增强。
1.3治疗方法
所有患儿急性期口服阿司匹林泡腾片(国药准字H32029199),50mg·kg-1·d-1,分为3次口服,至发热消退后根据患者的病情酌情减至3~5mg·kg-1·d-1,分为3次口服;静脉滴注丙种球蛋白(深圳市卫光生物制品股份有限公司,批号:140822)1.0g·kg-1·d-1,持续静脉滴注8~12h,同时在8~12h内再次给予一次冲击治疗,连续应用2d。
1.4疗效观察
比较两组患儿的临床疗效,具体根据临床表现及小儿川崎病诊疗标准,对患儿进行综合评价。判定标准:①显效:经治疗后,患儿发热、黏膜充血等症状基本消失,ESR、心肌酶谱、CRP等指标恢复正常;②有效:经治疗后,患儿发热、黏膜充血等临床症状显著改善,ESR、CRP等实验室指标基本恢复正常;③无效:经治疗后患儿各项症状未明显得到改善。总有效率=(显效+有效)例数/总例数×100%。观察各组研究对象经治疗后临床症状改善情况,包括发热、黏膜充血、手足肿胀和淋巴结肿大;记录各组患者治疗前后血小板(platelet,PLT)、白细胞计数(white blood cell,WBC)、肌酸激酶同工酶(creatine kinase-myocardial band,CK-MB)、ESR、CRP及NT-proBNP;记录IKD患者冠状动脉损害恢复情况。
1.5 Tfh、Tfr及检测
采集两组研究对象治疗前后空腹时静脉血各5mL,经肝素抗凝,采用密度梯度离心法分离获取外周单个核细胞,将单个核细胞(1×106个每管)洗涤后加入含有荧光素标记的单克隆抗体,4℃避光孵育30min。PBS洗3遍后固定,采用流式细胞术检测Tfh和Tfr细胞比率。
1.6统计学方法

2结果
2.1两组患儿治疗前后临床疗效及实验室指标比较
CKD组患儿治疗后显效120例,有效55例,无效9例,总有效率为95.11%;IKD组患儿显效50例,有效34例,无效4例,总有效率为95.45%;两组患儿总有效率方面差异无统计学意义(χ2=0.016,P>0.05)。IKD组临床症状消退时间(发热、黏膜充血、皮疹、手足肿胀、淋巴结肿大)短于CKD组,差异有统计学意义(t值分别为7.037、5.421、4.117、5.824、6.126,P<0.05),见表1。

表1 两组研究对象性别、年龄及临床症状消退时间比较Table 1 Comparison of gender,age and clinical symptoms regression time between the two
治疗后,CKD组及IKD组WBC、CK-MB、NT-proBNP、CRP、ESR、Tfh比率及Tfh/Tfr均较治疗前降低,Tfr比率较治疗前升高,差异均有统计学意义(P<0.05)。治疗后,IKD组患儿Tfh比率高于CKD组,差异均有统计学意义(t=10.336,P<0.05),其余所有指标差异均无统计学意义(P>0.05),见表2及表3。
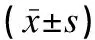
表2 两组研究对象实验室生化指标治疗前后变化情况比较Table 2 Comparison of changes of laboratory biochemical indexes between the two groups before and after
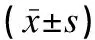
表3 两组研究对象Tfh、Tfr及其比率比较Table 3 Comparison of Tfh,Tfr and ratio
2.2治疗后两组冠状动脉损害与相关生化指标的关系
治疗前,CKD组CAL发生率10.33%(19/184)低于IKD组36.36%(32/88),差异有统计学意义(χ2=25.936,P<0.05);治疗后CKD组CAL患儿为0,IKD组CAL患儿3例,占3.41%(3/88),两组间差异无统计学意义(χ2=3.602,P>0.05)。以治疗前后CKD组、IKD组伴CAL进行研究,结果显示,治疗后CKD组伴CAL、IKD组伴CAL患者WBC、CK-MB、NT-proBNP、CRP、ESR、Tfh比率及Tfh/Tfr均较治疗前降低,Tfr比率较治疗前升高,差异均有统计学意义(P<0.05)。治疗后,IKD组伴CAL患儿NT-proBNP、Tfh比率及Tfh/Tfr高于CKD组伴CAL患儿,Tfr比率低于CKD组伴CAL患儿,差异均有统计学意义(t值分别为11.336、5.891、18.613、4.221,P<0.05),见表4及表5。

表4 两组患者合并CAL与实验室相关生化指标的关系Table 4 Relationships of combined CAL and related laboratory biochemical indexes in the two

表5 两组患者合并CAL与Tfh、Tfr及其比率的关系Table 5 Relationships of combined CAL and Tfh,Tfrand their ratio in the two
2.3 ROC曲线分析
以是否为IKD作为因变量(IKD=1,CKD=0),以治疗前的Tfh、Tfr及NT-proBNP指标为自变量,绘制受试者工作曲线。结果显示,治疗前Tfh比率、Tfh/Tfr及NT-proBNP对IKD具有较高的诊断价值,见图1及表6。

图1 治疗前Tfh比率、Tfh/Tfr及NT-proBNP对IKD诊断的ROC曲线Fig.1 ROC curve of Tfh cells ratio,Tfh/Tfr andNT-proBNP before treatment in the diagnosis of IKD

表6 治疗前Tfh比率、Tfh/Tfr及NT-proBNP对IKD诊断效能分析Table 6 Analysis of the effects of Tfh cells ratio,Tfh/Tfr and NT-proBNP before treatment in the diagnosis of IKD
2.4 COX模型分析
以IKD合并CAL为因变量,以治疗后CKD组与IKD组差异有统计学意义的变量为自变量行COX回归模型分析。结果显示,Tfh比率、Tfh/Tfr及NT-proBNP是IKD合并CAL的影响因素,其OR值及95%CI分别为1.792(1.204~7.552)、2.334(1.745~6.032)、2.072(1.690~8.444),均P<0.05。
3讨论
3.1研究背景
KD近年来已成为儿童时期获得性心血管疾病的重要原因之一。临床相当一部分KD患儿为典型特征,但仍有一部分患儿体征出现较晚或不出现,临床表现在达不到CKD 6条标准中的4条时即称之为IKD。IKD因其早期临床诊断困难,已成为目前儿科领域的研究热点。临床研究发现,未经治疗的KD患儿约有30%出现CAL,在我国KD病死率在1%左右[7]。由于KD发病机制不明确,尚缺少针对病因的特异性治疗手段,普遍认同的治疗方法是在阿司匹林治疗的基础上静脉注射人丙种免疫球蛋白。阿司匹林联合丙种球蛋白治疗KD均能取得较为理想的治疗效果,且治疗IKD患儿的效果优于CKD患儿[8]。
3.2治疗前后临床症状及生化指标变化情况
本研究发现,IKD患儿经治疗后临床症状消退时间明显快于CKD组。临床研究发现,IKD组患儿除发热以外,在淋巴结肿大、口腔黏膜充血、皮疹、手足肿胀方面较CKD组发生率低,因此笔者认为,IKD组患儿经阿司匹林联合丙种球蛋白治疗效果优于CKD组患儿。美国心脏病学会在制定KD的标准时,提出了有关IKD的诊断标准,综合考虑IKD与CKD存在一致性的病理性改变,提出将WBC、CRP、ESR等指标纳入到IKD的临床诊断指南中,但是这些指标灵敏度及特异性并不是很高,因此该指南未能受到较为普遍的认同和应用[6]。通过本研究发现,CKD组与IKD组在治疗前后WBC、CRP、ESR之间差异无统计学意义,因此课题组研究认为,AHA将WBC、CRP、ESR纳入IKD诊断尚缺少足够的证据,但本研究样本量较少,仍有待于临床大数据研究进行佐证。
3.3相关生化指标对IKD的诊断价值
近年来,国内外均有研究显示,NT-proBNP对IKD具有较高的诊断价值。本研究也发现,治疗前NT-proBNP对IKD具有较高的诊断价值,治疗后的NT-proBNP与CKD组比较也仍然存在一定差异,且为IKD患者预后的影响因素,提示NT-proBNP可能是区分IKD、CKD的参考指标。KD与多种病原微生物感染及炎症因子大量释放有关。Tfh是近年来新发现的CD4+T细胞亚群,正常生理条件下,Tfh可辅助B细胞产生抗体从而抵抗病原微生物,而其过表达将导致免疫性疾病的发生[9]。另外,Tfh具有分泌白介素-21(interleukin-21,IL-21)的功能,而IL-21是一种多效细胞因子,对血管内皮细胞功能具有直接作用。已有研究显示,IL-21可促进Th17和Th1细胞并抑制Treg表达,导致血管内皮细胞功能损伤[10]。研究发现,高血压患者中Tfh分泌的IL-21与IL-17A、IFN-γ增加有关[11]。Tfr是一类特化的调节性T细胞,其低表达导致体液免疫活化及自身抗体的产生[12]。本研究显示治疗前Tfh比率、Tfh/Tfr对IKD也有较高的诊断价值,治疗后Tfh比率、Tfh/Tfr水平在IKD、CKD患儿中也存在表达差异,提示Tfh比率、Tfh/Tfr对于IKD的诊断也存在一定价值,可能为阿司匹林联合丙种球蛋白治疗判断预后的生物学指标。
3.4冠状动脉损害与相关生化指标的关系
以往研究表明,IKD并发CAL的发生率显著高于CKD伴CAL患者[13]。本研究也发现IKD患儿在治疗前后CAL的发生率显著高于CKD组。为了探讨阿司匹林联合丙种球蛋白治疗KD患儿伴有CAL的机制,本研究进一步分析了Tfh比率、Tfr比率、Tfh/Tfr等指标与药物治疗后的关系。研究发现,伴CAL的基础上治疗前CKD组与IKD组之间Tfh比率、Tfr比率、Tfh/Tfr表达存在差异,而治疗后仍存在差异。课题组认为,IKD组并发CAL发生率高的原因可能与Tfh比率增高,而Tfr比率降低有关。通过COX模型分析显示,NT-proBNP、Tfh比率及Tfh/Tfr为IKD合并CAL的影响因素,提示NT-proBNP、Tfh比率及Tfh/Tfr与阿司匹林联合丙种球蛋白治疗IKD合并CAL预后有关。
3.5本研究局限性
需要提出的是,本研究初步阐明了治疗前NT-proBNP、Tfh/TfrTfh比率及Tfh/Tfr对IKD的诊断作用,而治疗后NT-proBNP、Tfh比率及Tfh/Tfr对IKD合并CAL有一定的预测作用,但是入选的样本量较小,未进行大数据的随访研究,后续需要进一步加大临床样本量的收集、联合多中心进行研究,进一步观察药物治疗效果及作用机制。
综上,NT-proBNP、Tfh比率及Tfh/Tfr对IKD具有较高的诊断作用,且为阿司匹林联合丙种球蛋白治疗IKD伴CAL的影响因素,建议临床进一步深入研究。

