磷酸盐分步沉淀不锈钢酸洗污泥浸出液铬铁镍
施春红,张喜玲,杨春雪
(1 北京科技大学能源与环境工程学院,北京 100083;2 工业典型污染物资源化处理北京市重点实验室,北京 100083)
不锈钢是一种环境友好型材料,具有耐腐蚀性能强、维护成本低、使用寿命长、回收价值高等优势,广受人们青睐。2019 年全球不锈钢粗产量约5221.8万吨,中国不锈钢粗钢产量占全球不锈钢总产量的56.3%,约2940 万吨[1]。根据每吨不锈钢产生3%~5%酸洗污泥估算[2],2019 年我国酸洗污泥产生量约117.6 万吨。酸洗污泥含有大量酸和金属化合物,具有较高毒性和腐蚀性[3],已被列入国家危险废物名录(HW17、HW22)[4]。我国酸洗污泥的堆存量随着不锈钢产量逐年上升,不锈钢酸洗污泥资源化利用已经成为我国不锈钢企业绿色发展的重要走向。
不锈钢酸洗污泥主要含有铁、铬、镍三种金属,可资源化利用价值高,国内外不锈钢酸洗污泥中金属资源化利用研究可归纳为三类[5]:湿法回收技术[6]、火法还原技术[7]、固化/稳定化处理技术。火法还原技术的产物可作为原料直接用于高炉生产,实现酸洗污泥铁铬镍金属的资源化利用[8],但具有成本高、能耗大的缺点;固化/稳定化处理技术将不锈钢酸洗污泥中有害的重金属离子固定,做水泥添加料[9]、制砖[10]、陶粒[11]、微晶玻璃[12]等建筑材料。虽然可以消纳大量的不锈钢酸洗污泥,缓解了环境压力,但不锈钢酸洗污泥中的有价组分未得到有效的利用,且未能消除有害组分带来的环境风险问题[13]。湿法技术研究较多的是萃取法和沉淀法。萃取法分离多组分、高酸度混合液金属离子,分离效率低;沉淀法操作条件要求高,易造成其他金属离子的损失[14],分离得到的金属纯度难以达到要求。
不锈钢酸洗污泥浸出液中铁含量较高,国内外学者多侧重于优先去除铁再回收铬、镍的研究[15],因铁、铬性质相似,存在共沉淀、吸附等现象,导致铬的沉淀率较高。25℃时,CrPO4溶度积常数ksp=1.0×10-17;Fe3(PO4)2在pH 大于6 溶液中,其溶度积常数ksp=1.0×10-36,但在pH 小于3 的弱酸介质中易水解为溶解度较高的FeHPO4;FePO4溶度积常数ksp=1.0×10-22,在强酸介质中较为稳定;Ni3(PO4)2在酸性介质中几乎不生成沉淀[16],理论上可以优先将Cr3+从Fe2+、Ni2+溶液中分离。因此,鉴于不锈钢污泥的物化特性和CrPO4、Fe3(PO4)2、FePO4、Ni3(PO4)2在酸性条件下的溶度积常数的差异,本文提出优先分离回收铬的新思路,采用磷酸盐沉淀法分梯级回收不锈钢酸洗污泥浸出液中铬、铁金属,达到了不锈钢酸洗污泥中金属离子分步沉淀回收的目标。
1 材料和方法
1.1 材料
不锈钢酸洗污泥来自江苏某公司不锈钢酸洗工艺,是基于硫酸平衡的酸洗废酸资源化循环利用技术浓缩控制结晶产生,得到的不锈钢酸洗污泥以硫酸亚铁为主,如图1所示。
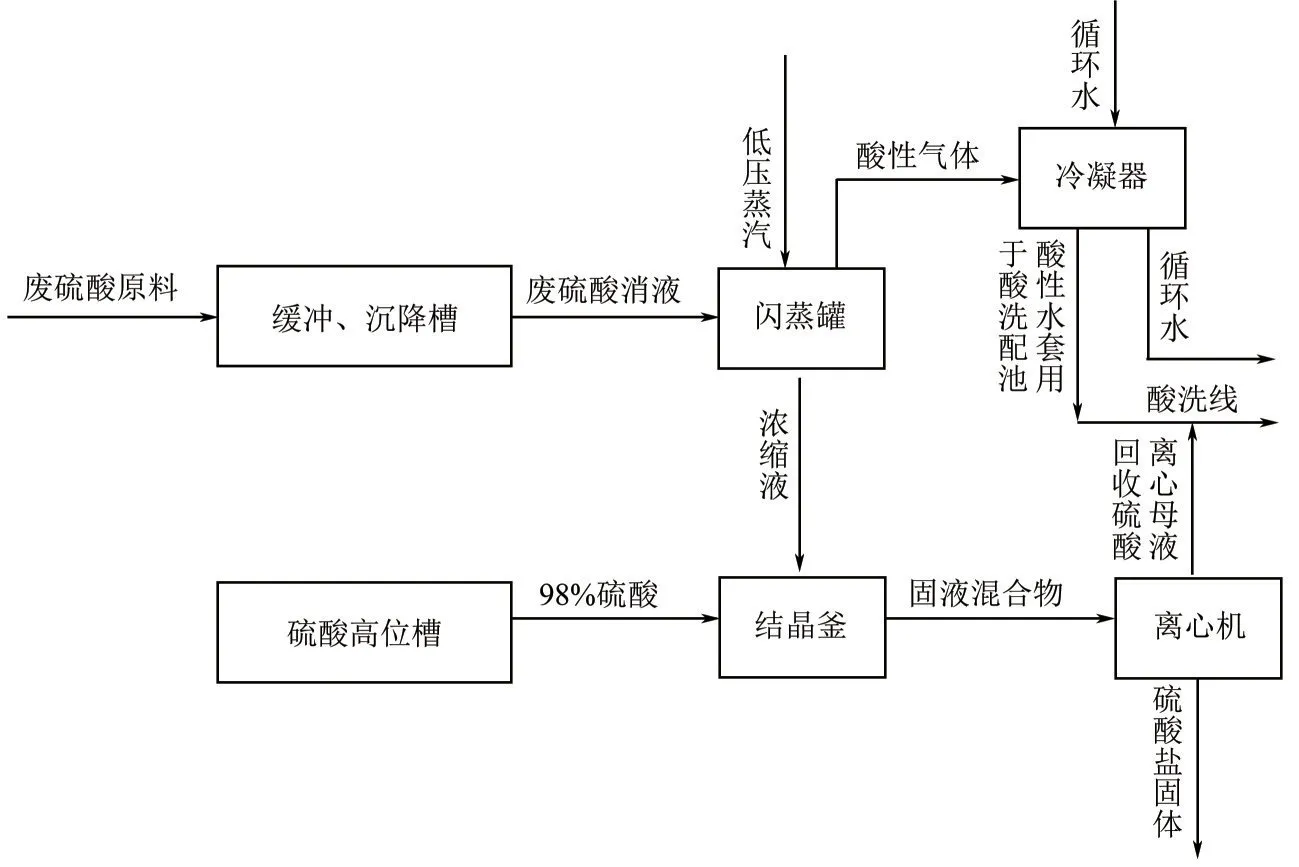
图1 不锈钢酸洗污泥产生工艺流程
将不锈钢酸洗污泥置于烘箱中105℃烘干4h,研磨过筛(200目)进行XRF分析,酸洗污泥主要金属元素质量分数见表1。不锈钢酸洗污泥化学成分复杂,约38.26%金属元素,其中铁、镍、铬质量分数分别为24.16%、3.29%、2.07%。X 射线衍射仪和扫描电子显微镜分析结果如图2 和图3 所示,由图2可见,不锈钢酸洗污泥的主要结晶相为硫酸亚铁、硫酸铬和硫酸镍。由图3可见,不锈钢酸洗污泥微观结构呈颗粒状,金属元素相互掺杂,其主要化学元素是S、Fe、Cr、Ni、Mn。酸洗污泥中Co、Cu、Al、Mo 等其他金属离子浓度过低,回收价值低。因此,主要研究Fe、Cr、Ni 三种金属离子的分步沉淀回收情况。
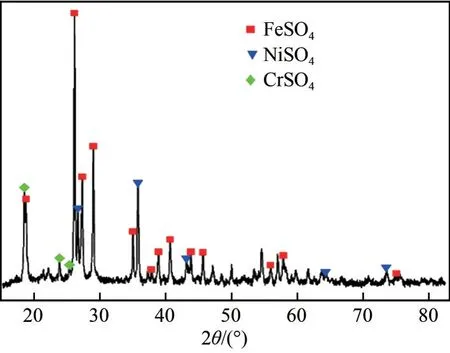
图2 不锈钢酸洗污泥XRD图谱
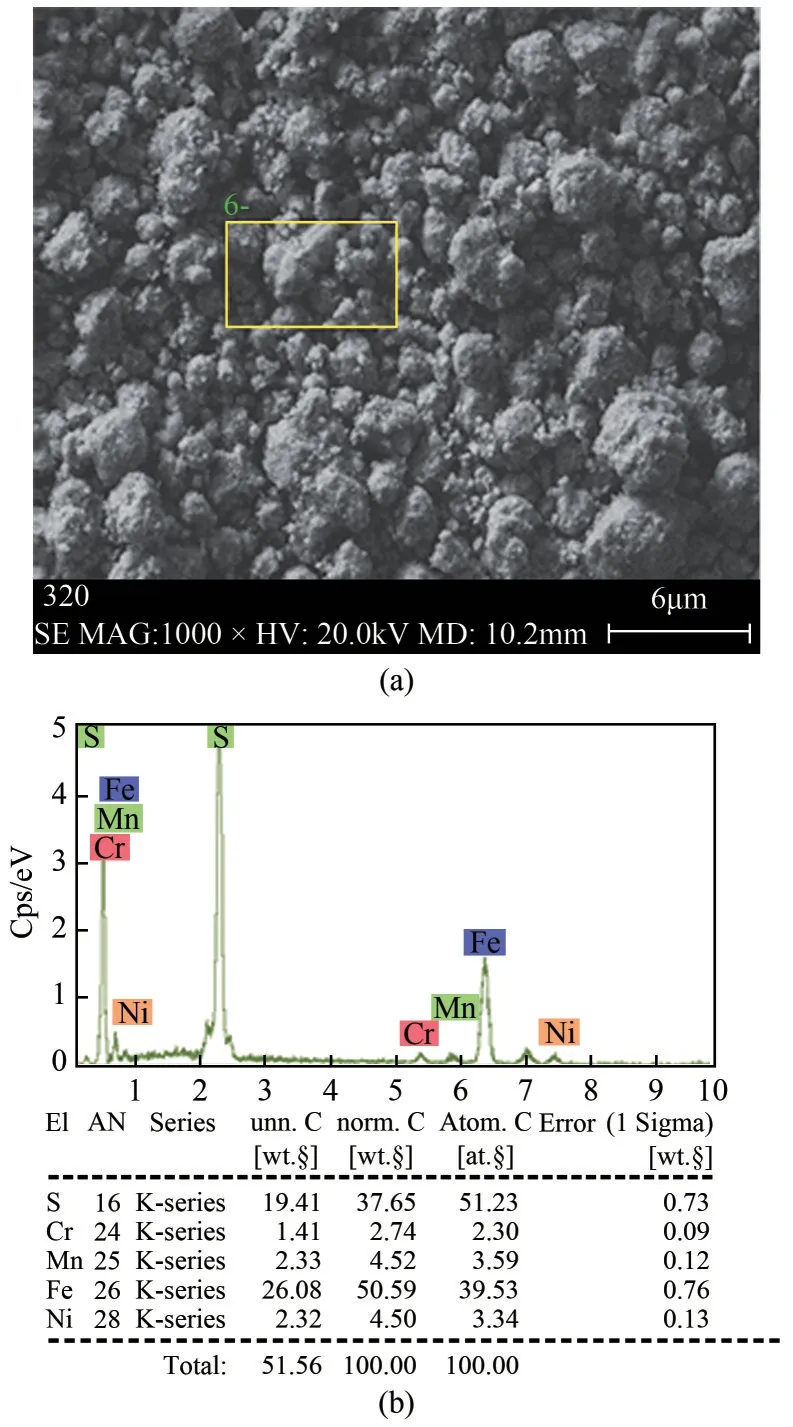
图3 酸洗污泥SEM-EDS图谱
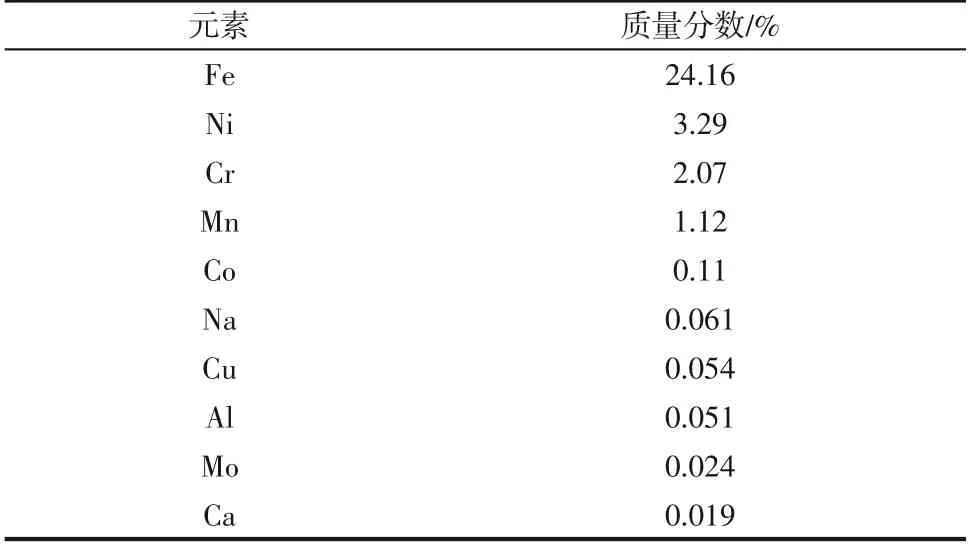
表1 不锈钢酸洗污泥主要金属元素质量分数
1.2 试剂及仪器
无水磷酸三钠(分析纯);亚硫酸钠(分析纯);氢氧化钠(分析纯);硫酸(98%);双氧水(35%)。
HJ-3数显恒温磁力搅拌器;电热鼓风干燥箱;循环水式多用真空泵;原子吸收分光光度仪(AA-6300C);pH计(pHS-25cw);电子天平(AL204);X 射线衍射仪(Rigaku);扫描电子显微镜及取向分析系(LEO1450)。
1.3 研究方法
1.3.1 铬沉淀实验
称量100.0000g(105℃,4h)不锈钢酸洗污泥于烧杯中,加入去离子水溶解定容1L,pH为0.89。通过原子吸收分光光度仪测定浸出液中Fe2+、Cr3+、Ni2+浓度分别为0.43mol/L、0.04mol/L、0.056mol/L。加入亚硫酸钠保持溶液中Fe2+价态,调整浸出液初始pH,滴加与Cr3+等物质的量浓度的Na3PO4溶液,400r/min 转速搅拌一段时间后抽滤,pH 为0.80 硫酸洗涤定容,测定溶液中Fe2+、Cr3+、Ni2+浓度,根据式(1)计算Fe2+、Cr3+、Ni2+沉淀率,以研究Fe2+、Cr3+、Ni2+离子分离最佳条件。
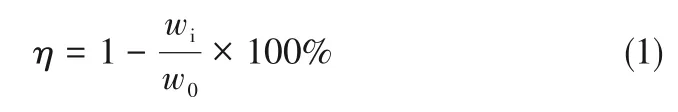
式中,η为金属离子沉淀率,%;wi为滤液中金属离子浓度,g/L;w0为浸出液中金属离子的浓度,g/L。
1.3.2 铁沉淀实验
将上述沉淀溶液通过真空抽滤机进行过滤酸洗,滤液调节pH 为2.00 左右,H2O2将Fe2+氧化为Fe3+,调节溶液pH,加入一定量40g/L Na3PO4溶液,不同温度下搅拌一段时间后抽滤洗涤定容,测定溶液中Fe3+、Ni2+质量浓度,计算Fe3+、Ni2+沉淀率,确定最佳沉淀条件,达到Fe3+、Ni2+离子最佳分离效果。
2 结果与讨论
2.1 铬沉淀条件优化
2.1.1 Na3PO4对Fe2+、Cr3+、Ni2+分离效果的影响
在初始pH=0.89、反应温度为80℃、搅拌时间60min 的条件下,以0.04mol/L 磷酸三钠为沉淀剂,考察了Na3PO4/Cr3+不同摩尔比对Fe2+、Cr3+、Ni2+沉淀效果的影响,结果如图4 所示。Cr3+的沉淀率与Na3PO4量成正比,Fe2+的沉淀率也随之升高,Ni2+沉淀率相对稳定,在Na3PO4/Cr3+摩尔比1.00 时,Cr3+沉淀率为91.12%,Fe2+、Ni2+沉淀率分别为0.82%、1.50%。
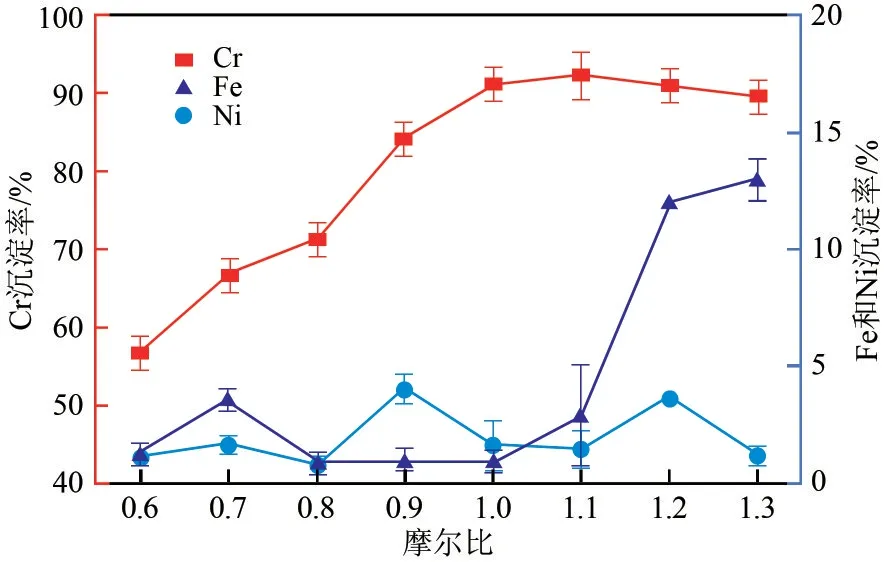
图4 Na3PO4对Fe2+、Cr3+、Ni2+分离效果的影响
2.1.2 初始pH对Fe2+、Cr3+、Ni2+分离效果的影响
加入Na3PO4会影响溶液的pH、在Na3PO4/Cr3+摩尔比为1.00、反应温度为80℃、搅拌时间60min的条件下,考察了不同初始pH 对Fe2+、Cr3+、Ni2+沉淀效果的影响,如图5 所示。Fe2+、Cr3+、Ni2+的沉淀率随着溶液pH 升高有递增趋势,pH 在0.50~1.00 之间,Fe2+和Ni2+的沉淀率较小,因为溶液中H+对PO43-水解产生HPO42-产生了抑制作用,促进PO43-和Cr3+沉淀。当溶液初始pH 大于1.00 时,Fe2+、Ni2+的沉淀率明显增加,是因为Na3PO4加入导致溶液pH 升高,促进了金属离子水解[15]。在初始溶液pH 为1.00,此时Cr3+沉淀率为90.36%,Fe2+、Ni2+沉淀率分别为1.76%、0.75%。
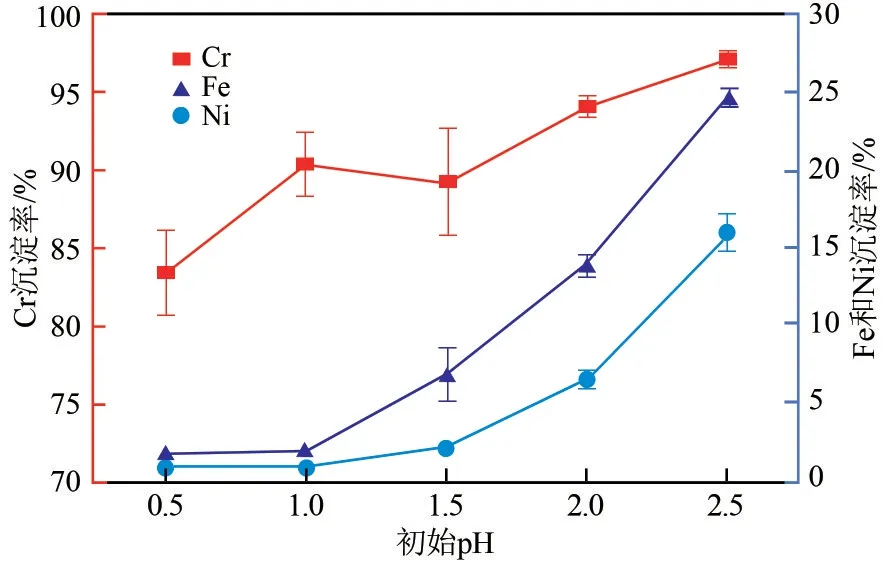
图5 初始pH对Fe2+、Cr3+、Ni2+分离效果的影响
2.1.3 温度对Fe2+、Cr3+、Ni2+分离效果的影响
Cr3+与PO43-生成的CrPO4为胶体物质[14],受温度影响大。在初始Na3PO4/Cr3+摩尔比为1.0,初始pH为1.00,搅拌时间60min的条件下,考察了不同温度下Fe2+、Cr3+、Ni2+沉淀效果,结果如图6 所示。Cr3+沉淀率随着温度的升高而增大,Fe2+、Ni2+沉淀率基本不受温度的影响,反应最佳温度为90℃,此时Cr3+沉淀率为91.53%,Fe2+、Ni2+沉淀率分别为0.84%、0.53%。
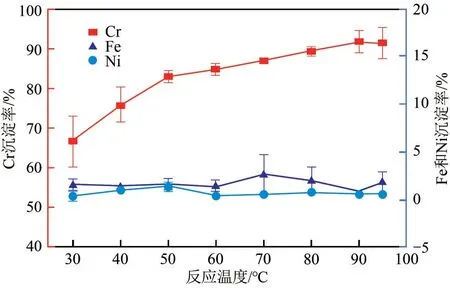
图6 反应温度对Fe2+、Cr3+、Ni2+分离效果的影响
2.1.4 时间对Fe2+、Cr3+、Ni2+分离效果的影响
在初始Na3PO4/Cr3+摩尔比为1.00、初始pH 为1.00、温度为90℃的条件下,考察搅拌时间对Fe2+、Cr3+、Ni2+沉淀效果影响,如图7所示。加热时间对Fe2+、Cr3+、Ni2+沉淀率影响不大,但加热时间为50 min以上时,Fe2+、Cr3+、Ni2+沉淀实验效果不稳定,误差值相对较高。综合考虑,选择加热时间为70min,此时Cr3+沉淀率最高为94.37%,Fe2+、Ni2+最低沉淀率分别为0.18%、0.55%。
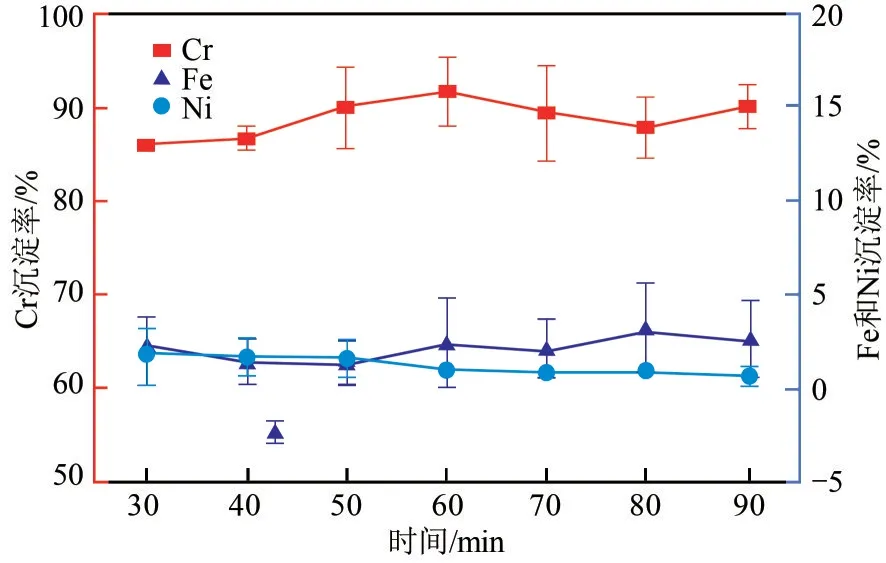
图7 反应时间对Fe2+、Cr3+、Ni2+分离效果的影响
2.1.5 铬沉淀物表征
在最优条件下,即Na3PO4/Cr3+摩尔比为1.00,初始pH为1.00,反应温度为90℃,反应时间70min,开展三组平行实验,结果见表2。Cr3+平均沉淀率为94.47%,Fe2+、Ni2+平均沉淀率为0.88%、0.78%,实现了优先分离铬的目标。
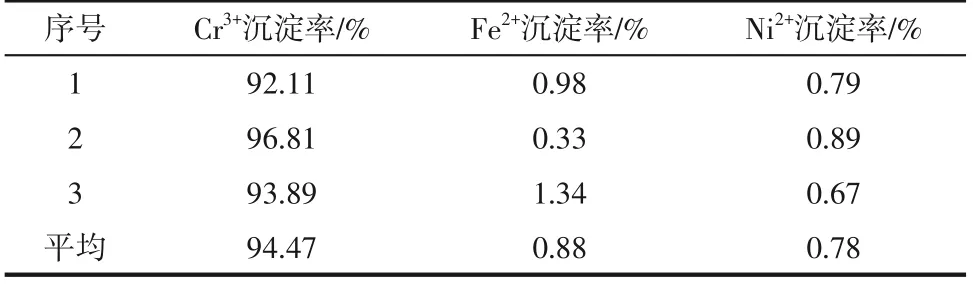
表2 综合条件实验结果
Cr3+沉淀物XRD 和SEM-EDS 定量分析结果如图8 所示。由图8(a)可见,XRD 图谱峰呈弥散桥状,说明生成的Cr3+沉淀物为非晶体粉末,为胶体颗粒[14]。对Cr3+沉淀物进行SEM-EDS定量分析,结果如图8(b),Cr3+沉淀物为CrPO4,纯度大于78%,CrPO4含量达到了染料、陶瓷生产工业原料标准,也可以进一步提纯生产Cr(OH)3、Cr2O3。含有少量的Fe 和Ni、Mn,说明不锈钢酸洗污泥浸出液中Fe2+、Ni2+对Cr3+沉淀效果影响较小,可以实现Cr3+优先分离。
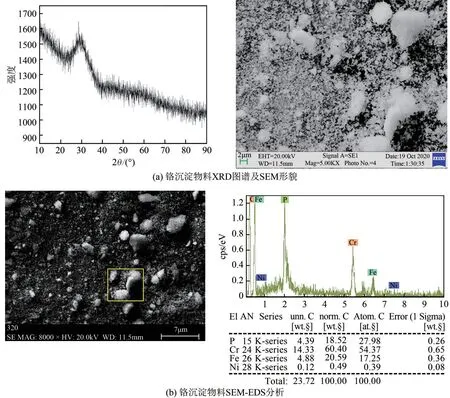
图8 铬沉淀物料XRD图谱和SEM-EDS分析结果
2.2 铁沉淀条件优化
2.2.1 Na3PO4对Fe3+、Ni2+分离效果的影响
在初始pH=1.00、反应温度为60℃、搅拌时间60min 的条件下,以40g/L Na3PO4为沉淀剂,通过控制Na3PO4/Fe3+不同体积比对Fe3+、Ni2+沉淀分离效果的影响,如图9 所示。随着Na3PO4增多,Fe3+和Ni2+沉淀率逐渐增加。当Na3PO4/Fe3+体积比大于0.80时,Fe3+沉淀率趋于稳定,镍的沉淀率也有所增加,因为Na3PO4加入提高溶液中pH,促使部分Fe3+水解产生氢氧化铁胶体,吸附Ni2+造成损失[13]。在Na3PO4/Fe3+体积比为0.80时,Fe3+沉淀率为97.80%,Ni2+沉淀率稳定在1.45%。

图9 磷酸钠用量对Fe3+、Ni2+分离效果的影响
2.2.2 初始pH对Fe3+、Ni2+分离效果的影响
研究了不同初始pH对浸出液中Fe3+、Ni2+沉淀分离效果的影响,Fe3+和Ni2+沉淀率如图10 所示。初始pH由0.50增加至2.00,Fe3+沉淀率先增加后降低,而Ni2+沉淀率呈现增长趋势。pH 增大,Fe3+发生水解,OH-和PO43-产生了配位竞争,部分Fe3+转化为氢氧化铁胶体,吸附Ni2+,胶体颗粒较小,难以通过滤纸分离[18],导致Ni2+沉淀率升高的现象。在初始pH 为1.00,Fe3+沉淀率最高为97.68%,Ni2+沉淀率最低为1.95%,实验误差值小。
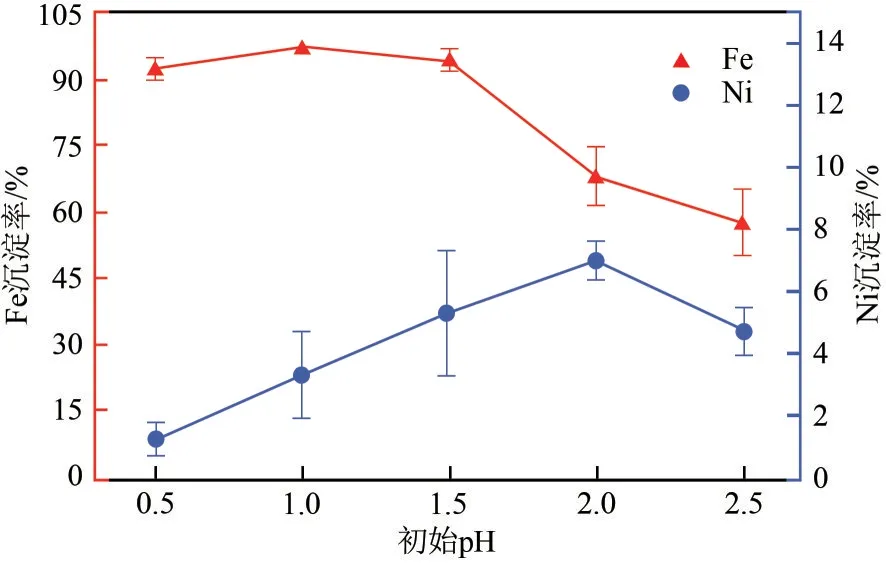
图10 初始pH对Fe3+、Ni2+分离效果的影响
2.2.3 温度对Fe3+、Ni2+分离效果的影响
研究了不同反应温度对浸出液中Fe3+、Ni2+沉淀分离效果的影响,Fe3+和Ni2+沉淀率如图11所示。温度在20~60℃范围内,Fe3+和Ni2+沉淀率基本不变,但当温度大于80℃时,Fe3+沉淀率误差较大,这是因为高温促进FePO4水解[19],降低了实验的稳定性。考虑实验能耗,实验选择反应温度为40℃,此时Fe3+沉淀率最高为99.32%,Ni2+沉淀率稳定在0.98%。
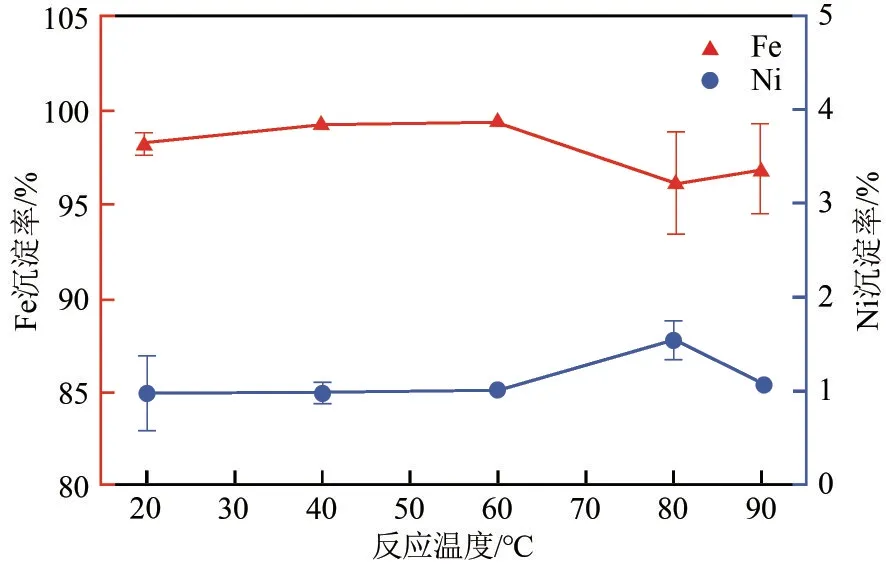
图11 反应温度对Fe3+、Ni2+分离效果的影响
2.2.4 时间对Fe3+、Ni2+分离效果的影响
研究了不同反应时间对浸出液中Fe3+和Ni2+沉淀效果的影响,Fe3+和Ni2+沉淀率如图12 所示。反应时间增加对Fe3+和Ni2+沉淀率影响较小,实验搅拌混合15min,Fe3+基本完全沉淀,但Ni2+沉淀率误差较大,稳定性较差。综合考虑Fe3+、Ni2+沉淀率,选择反应时间为60min,此时Fe3+沉淀率最高为99.83%,Ni2+沉淀率稳定在0.51%,实验效果稳定。
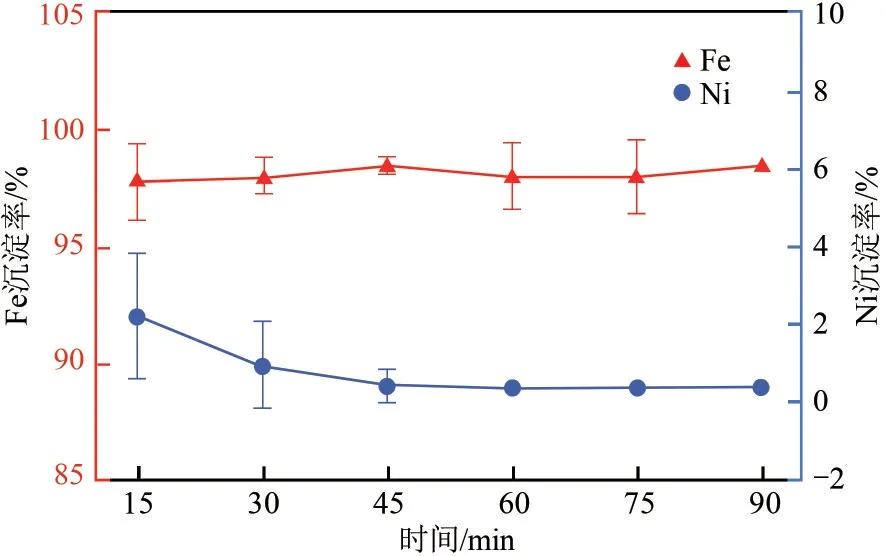
图12 反应时间对Fe3+、Ni2+分离效果的影响
2.2.5 铁沉淀物表征
根据上述实验结果,在最佳工艺条件(Na3PO4/Fe3+体积比0.80,初始pH为1.00,反应温度为45℃,搅拌时间为60min)下,对Fe3+沉淀物进行SEM-EDS定量分析,结果如图13 所示。Fe3+沉淀物中P、Fe为主要元素,含有少量的Ni,几乎不含Cr,沉淀物主要成分是FePO4,纯度大于90%,说明不锈钢酸洗污泥浸出液中Fe3+沉淀效果较好,Ni 沉淀率低,被保留在溶液中。证明了磷酸盐沉淀法可以实现不锈钢酸洗污泥浸出液中Fe、Cr、Ni分离回收。
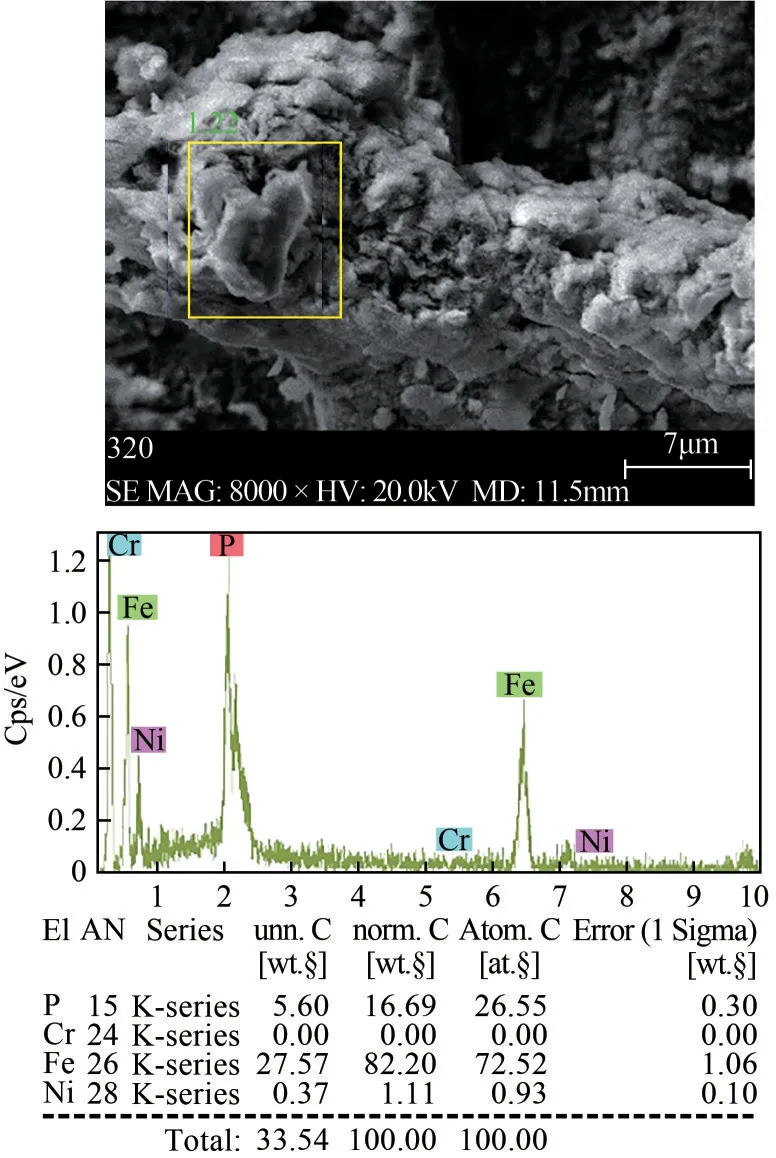
图13 铁沉淀物SEM-EDS分析结果
3 结论
(1)不锈钢酸洗污泥主要含有硫酸亚铁、硫酸铬和硫酸镍,酸洗液pH 为0.89,酸性较大。铁、铬、镍金属以Fe2+、Cr3+、Ni2+金属离子存在于浸出液中,根据三种金属离子磷酸盐的特性,可以实现分步沉淀。
(2)在Na3PO4/Cr3+摩尔比为1.00、初始pH 为1.00、温度为90℃、反应时间70min的优化条件下,Cr3+沉淀率为94.47%,Fe2+、Ni2+平均沉淀率为0.88%、0.79%,沉淀物主要成分为CrPO4,纯度达到78%,CrPO4含量达到了染料、陶瓷生产工业原料标准,实现了优先沉淀铬的目的。
(3)滤液被H2O2氧化后,在最佳工艺条件下,即Na3PO4/Fe3+体积比0.80、初始pH为1.00、反应温度为45℃、搅拌时间为60min,Fe3+沉淀率最高为99.81%、Ni2+沉淀率稳定在0.68%,沉淀物FePO4纯度大于90%,证明磷酸盐可以优先沉淀铬,再分步沉淀铁,实现不锈钢酸洗污泥浸出液金属离子分步沉淀回收的目的。

