高血压伴低钾血症1例
骆睿翔 吴 旸 张 晨
1.北京中医药大学第二临床医学院,北京 100029;2.北京中医药大学东方医院心内科,北京 100078;3.北京中医药大学第三临床医学院,北京 100029
原发性醛固酮增多症(primary aldosteronism,PA)是因肾上腺皮质分泌的醛固酮过多,而出现水钠潴留,排钾增多,肾素-血管紧张素系统(renin-angiotensin system,RAS)活性受抑,引起以高血压和低血钾为主要临床表现的一类疾病[1-2]。PA 是最常见的内分泌紊乱导致的高血压,在普通人群中的患病率为5%~10%[3]。可导致肾、血管、心脏等严重并发症,增加死亡率[4]。目前,我国对PA 的认识和诊断技术不足,故通过筛查而诊断的PA 比例较低[5]。临床上常以高血压和低钾血症作为判断PA 的初级标准,这极大增加了PA 的误诊率。该患者正是出现了血钾持续偏低,同时血压明显升高,而最终并非PA。通过对本病例的报道分析,可提高临床医生对PA 的认识,并强调详细询问病史的重要性。
1 病例资料
患者,男,76 岁,主因“间断头晕乏力3 个月”于2020 年10 月11 日收入院。患者近3 个月无明显诱因出现头晕、乏力,嗜睡状态,无胸闷胸痛,无咳嗽咳痰,无恶心呕吐,纳可,眠多,小便多,大便干。既往高血压病史20 余年,血压最高达180/120 mmHg(1 mmHg=0.133 kPa),口服氯沙坦钾氢氯噻嗪片62.5 mg qd,自诉血压控制可;2 型糖尿病10 余年;高脂血症20 余年;3 年前发作癫痫1 次;脑梗死病史1 个月,并于北京市朝阳医院置入支架;吸烟史40 年,20 支/d,戒烟1 个月,余无特殊。入院时体格检查:体温:36℃,脉搏:92 次/min,呼吸:18 次/min,血压:128/75 mmHg。嗜睡状态,反应迟钝,面具脸,运动迟缓,形态偏胖,双侧肌张力增高,双侧肌力Ⅳ级,生理反射存在,病理反射未引出;心肺及腹部查体未见异常。入院后全血细胞分析+C 反应蛋白(C-reactive protein,CRP),结果见表1。治疗经过:患者于2020 年10 月11 日入院,长期口服氯沙坦钾氢氯噻嗪片62.5 mg qd,血压控制良好。入院后发现血钾偏低,低至1.88 mmol/L,见表2。24 h 尿钾:132.2 mmol/24 h(参考值25~125 mmol/24 h),考虑噻嗪类药物引起的低钾血症,遂停用氯沙坦钾氢氯噻嗪片,改用非洛地平缓释片5 mg qd 口服,同时予氯化钾缓释片1 g tid 口服和氯化钾9 g/24 h 泵入补钾,血钾可见回升但依然偏低;同时监测血压,发现血压升高明显,日间收缩压:140~150 mmHg,夜间收缩压:160~180 mmHg(血压监测,见图1)。随后加用螺内酯20 mg qd 口服,停用氯化钾泵,血钾逐步维持在正常水平;但血压仍高,收缩压波动于140~160 mmHg。查醛固酮(aldosterone,ALD):151.5 pg/ml(参考值10~160 pg/ml);血浆肾素活性(plasma renin activity,PRA):4.89 pg/mL(参考值4~24 pg/ml);血管紧张素Ⅱ:70.03 pg/L(参考值25~129 pg/ml),ALD 与PRA 的比值>30。初步怀疑PA?告知患者及家属病情,拟行肾上腺静脉采血(adrenal venous sampling,AVS)检查以明确诊断,患者及家属表示,理解但拒绝此项检查,行肾上腺增强CT 检查,结果提示:左侧肾上腺稍增粗,增生不除外(图2)。继续以降血压和维持血钾治疗为主,2020 年10 月23 日改非洛地平缓释片5 mg bid 口服,继续螺内酯20 mg qd 口服,改氯化钾缓释片0.5 g tid 口服。其他治疗:如抗感染、脑梗死二级预防、降糖等贯穿始终。2020 年10 月25 日测血钾,已恢复正常水平,停用氯化钾缓释片;监测血压,日间收缩压120~140 mmHg,基本恢复正常。出院前复测血钾,可维持在4~5 mmol/L,出院后随访,患者血压正常维持在120~130 mmHg。

图1 日平均血压监测水平
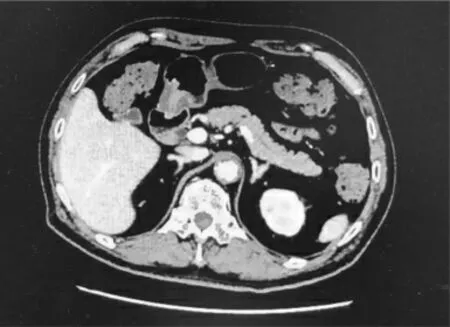
图2 肾上腺增强CT
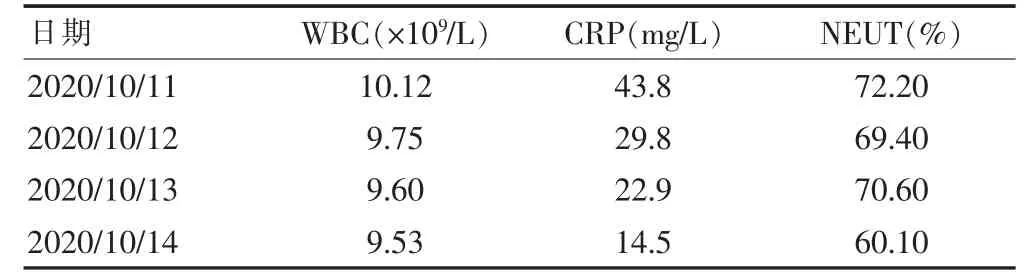
表1 入院后全血细胞分析+CRP 结果
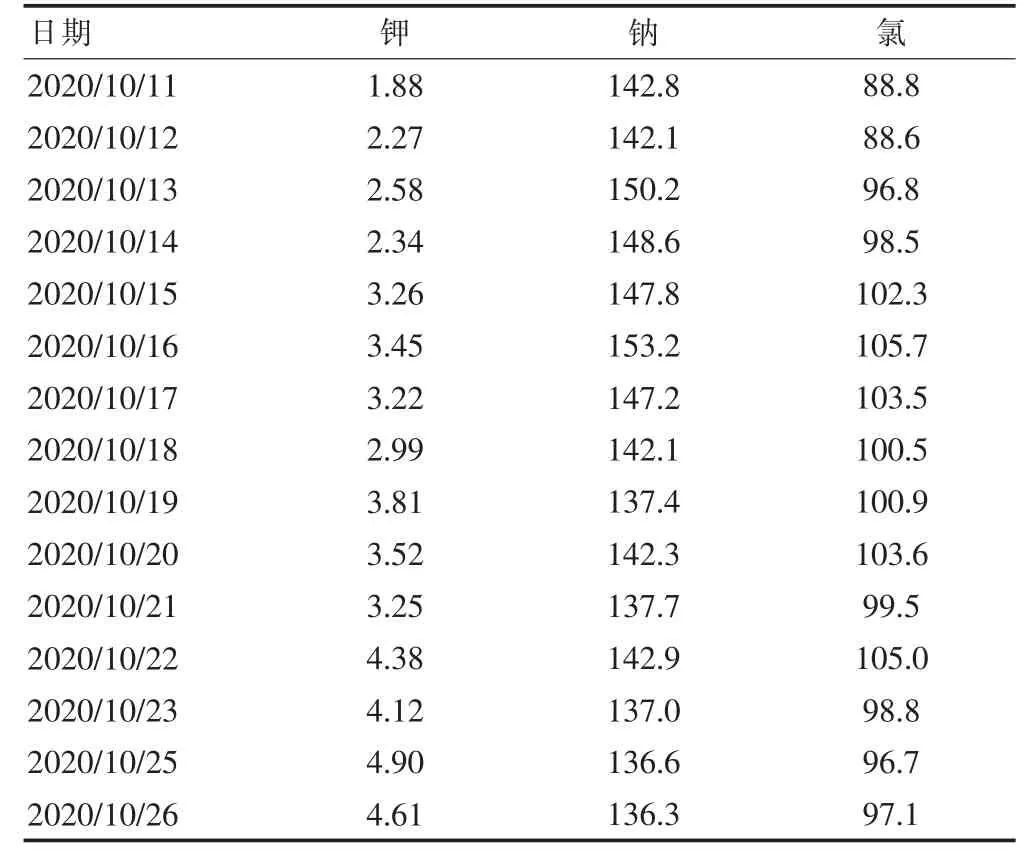
表2 入院后血电解质结果(mmol/L)
2 讨论
高血压和低血钾是PA 的两大主要临床表现,但能否确诊PA,有待进一步探讨[6]。本病例患者高血压病史已20 余年,病史明确且既往血压控制良好,考虑原发性高血压的可能性较大[7]。至于入院后血压控制不佳,可能与更换降压药有关,患者由单片复方制剂氯沙坦钾氢氯噻嗪片改为非洛地平缓释片是其主要原因,且加用常规剂量的螺内酯后,血压逐渐恢复至正常水平,也验证了这一可能。低钾血症,一方面是摄入不足;另一方面是排泄过多。摄入不足:可能与患者院前生活习惯相关;排泄过多:患者入院时血钾重度偏低,考虑与长期服用排钾类利尿药氢氯噻嗪有关,但停用后血钾恢复并不明显。此外,患者未出现恶性心律失常,提示慢性失钾可能,并非短期内急性失钾。详细追溯患者入院前治疗及服药史后,发现患者1 个月前自北京朝阳医院出院后(住院期间未告知低血钾诊断)因肝功能异常服用复方甘草酸苷保肝治疗(入院后肝功未见明显异常,未服用)。查阅相关资料发现[8-9],该药与噻嗪类利尿剂同时使用时可能出现低钾血症、假性醛固酮症等不良反应,可出现脱力感、肌力低下、肌肉痛、四肢痉挛、麻痹等横纹肌溶解症的症状,其机制可能与该药中的甘草酸通过竞争性抑制肝脏内的代谢酶而延长醛固酮的作用时间,增强醛固酮的保钠排钾作用有关,故不排除药物性低钾可能。结合患者入院后未服复方甘草酸苷,且经补钾降压等对症治疗后,血钾及血压可逐渐恢复正常水平,因此,药物性低钾可能性大。醛固酮增高,应当首先排除继发性因素,患者既往有高血压、糖尿病、肾病等可能是一系列基础疾病激活了RAS 系统。该患者ALD 与PRA 两者的比值>30,可提示PA[10]。由于患者无法配合立位,故以上结果均为卧位值,且患者未行AVS 检查,因此,诊断PA 的资料不全。综上所述,该患者既往高血压病史明确,药物治疗可控,未出现血压较难控制的情况,基本可确定药物性低钾。
与原发性高血压比较,PA 患者的心脑血管事件发生率及靶器官损害风险均明显增加[11]。因此,为降低心血管事件发生率,PA 的早期诊断至关重要[12]。对于PA 的诊断分三大部分:其一,指南推荐PA 筛查首选ARR,即血浆ALD 与PRA 的比值;其二,PA 确诊推荐盐水负荷试验(salt load test,SIT)、卡托普利抑制试验(captopril control test,CCT)、氟氢可的松抑制试验(fluhydrocortisone control test,FST)及口服钠负荷试验(sodium load test,SLT);其三,AVS 被公认为是诊断PA 分型及定位诊断的金标准,但目前并未得到广泛普及[13-15]。虽然肾上腺CT 的敏感性和特异性不够,但因操作简便、价格低廉,是PA 分型诊断的基础,在临床上得到广泛应用[16]。掌握PA 的诊断标准不仅可以快速准确诊断出PA 患者,而且能够减少PA的误诊[17]。复方甘草酸苷的主要成分是甘草酸[18]。甘草酸是甘草的重要活性成分,现代药理学研究表明甘草酸具有保肝、抗病毒等作用[19-20]。过量摄入甘草类制剂可能会导致假性醛固酮增多症,进而导致高血压和低钾血症[21-22]。发生机制可能与抑制周围皮质醇氧化酶11β-羟基类固醇脱氢酶2 型或直接激活盐皮质激素受体(MR)相关[23]。因此,在使用甘草类制剂时,应密切监测血药浓度,以防药物性高血压和低钾血症的发生。
临床上,在高血压患者中,PA 的患病率仅有5%~10%,但9%~37%的PA 患者常出现低钾血症[24-25]。因此,出现高血压伴低钾血症时,通常会考虑PA[6]。但除了某些疾病可导致高血压和低血钾外,某些药物也有可能,这正是临床医生容易忽视的地方[26]。上述的病例报道就掉入了这一“陷阱”。这也提醒临床医生,在今后的临床诊治过程中,应详细询问患者病史尤其是既往用药史,并应具备全方位、多角度、多维度的思维方式及诊疗模式。

