不同细胞培养基对抗破伤风毒素人源单抗关键质量属性的影响
王建锋,汪艳艳,郭岚,叶星,南建军,安晨,宋兰兰,陈继军,毛晓燕
兰州生物制品研究所有限责任公司甘肃省大分子蛋白生物药工程研究中心甘肃省疫苗工程技术研究中心,甘肃兰州 730046
CHO 细胞以其独有的优势己成为生物技术药物最重要的表达或生产系统[1-2]。细胞培养介质是维持细胞正常代谢及稳定表达产物的保证。不同的细胞株和克隆对营养成分的需求各不相同。适应性良好的培养基对抗体表达量、工艺控制以及抗体质量至关重要。随着抗体人源化技术的日益成熟,人源单抗取代抗破伤风毒素人免疫球蛋白成为趋势。珠海泰诺麦博生物技术有限公司研发的抗破伤风毒素全人源抗体作为全球第1 个抗破伤风毒素人源单抗获得澳洲HREC / TGA 批准进行Ⅰ期临床实验。本研究使用的工程细胞株是兰州生物制品研究所第四研究室自主构建的抗破伤风毒素人源单抗。本研究选取Growth A、Dynamis、T54 这3 种商用培养基,在Fed-batch 模式下培养抗破伤风毒素人源单抗工程细胞株,通过观察细胞生长状态及产生抗体的关键质量属性,分析细胞株对不同培养基的适应性,为抗破伤风毒素人源单抗工程细胞株培养基的开发奠定基础。
1 材料与方法
1. 1 细胞株 抗破伤风毒素人源单抗工程细胞株由兰州生物制品研究所有限责任公司第四研究室构建。
1. 2 主要试剂及仪器 Growth A medium 购自美国欧文公司(货号:94120);Dynamis medium 购自美国Gibco 公司(货号:A26615-1);T54 medium 购自上海瀚康生物医药有限公司;碘乙酰胺、精氨酸和尿素均购自美国Sigma-Aldrich 公司;亚氨基二乙酸购自上海天演生物技术有限责任公司;cIEF Peptide Marker Kit、cIEF GEL、PA 800 plus SDS-MW Analysis Kit、Neutral Capillary、Capilla-rytube、毛细管电泳仪PA800 plus和Universal Vial Caps 均购自美国Beckman Coulter 公司;Pharmalyte 3-10 for IEF 购自美国GE Healthcare公司;氢氧化钠购自西陇化工股份有限公司;磷酸、乙酸、NaH2PO4·2H2O、Na2HPO4·12H2O、氯化钠、NaOH和无水乙醇均购自国药集团化学试剂有限公司;HPLC 仪、进样瓶和内衬管购自美国Waters 公司;SEC色谱柱和SEC 保护柱购自日本TOSHO 公司。
1. 3 抗破伤风毒素人源单抗工程细胞株在不同培养基中的培养 复苏细胞株,用3 种不同培养基Growth A medium、Dynamismedium、T54 medium 适应性培养。待细胞适应性良好时,以相同的细胞密度(0. 8 × 106个/ mL)分别用3 种培养基接种于500 mL 细胞摇瓶中,接种体积为200 mL,37 ℃,5%CO2,125 r / min 培养,按培养基使用说明隔天添加Fed 培养基,葡萄糖消耗低于2 g/L 时添加至6 g/L。活细胞密度低于75%终止培养,离心收集培养上清,第1 步protein A 亲和层析,第2 步阴离子交换层析得到纯化蛋白。
1. 4 不同培养基培养的细胞表达单抗的纯度分析
1. 4. 1 SEC-HPLC 分析 色谱柱:TOSHO(0022854);流动相:0. 2 mol / L 磷酸盐缓冲液;pH 6. 7;流速:0. 7 mL / min;上样量:50 μL(1. 0 mg / mL);柱温:30 ℃;样品池温度:6 ℃;检测波长:280 nm;检测时间:30 min。用Waters 高效液相分析,系统工作站对实验结果进行数据处理,面积归一化法计算纯度[3]。不同样品重复3 次。
1. 4. 2 CE-SDS 分析 将供试品用Loading buffer 稀释至1. 0 mg / mL,取稀释后样品95 μL,非还原样品加5 μL 碘乙酰胺(800 mmol / L),还原样品加5 μL 2-巯基乙醇,斡旋充分混匀,非还原样品70 ℃金属浴加热5 min,还原样品70 ℃金属浴加热15 min;放置至室温,4 700 × g 离心10 min,取75 μL 加入离心管上机测试。上样电压5 KV;非还原样品上样时间40 s,还原样品上样30 s;分离电压15 KV;分离时间40 min;毛细管温度和样品温度均为20 ℃;检测波长为214 nm。32 Karat 软件分析实验结果,通过设置合理积分参数积分所需要的目标峰,计算单体、重链、轻链以及非糖基化重链比例[4]。
1. 5 不同培养基培养的细胞表达单抗的pI 及电荷变异体分析 采用毛细管等电聚焦(capillary isoelectric focusing,CIEF)。将供试品用去离子水稀释至5 mg / mL,配制电泳体系:200 μL 3 mol / L 尿素-Cief Gel;12 μL Pharmalyte 3-10 for IEF;20 μL 阴极稳定液;2 μL 阳极稳定液;2 μL pI 10. 0 的标准marker,2 μL pI 7. 0 的标准marker,2 μL pI 4. 1 的标准marker;稀释样品5 μL;UV 检测器,280 nm 检测波长;毛细管温度及样品温度均为20 ℃;25 psi 压力进样99. 9 s;聚焦电压25 KV,聚焦15 min;30 KV电压分离30 min。32 Karat 软件分析实验结果,以marker 迁移时间和pI 值绘制标准曲线,曲线拟合度大于0. 999 可对样品峰定量,对碱性峰、主峰、酸性峰进行积分分析电荷变异体分布[5]。
2 结 果
2. 1 细胞株在不同培养基中培养的活细胞密度及细胞活率 训化适应性良好的细胞分别接种于Growth A medium、Dynamis medium、T54 medium,培养前3 d,在Growth A medium 中活细胞密度最高,在T54 medium 中次之,在Dynamis medium 中最低;第4 ~10 天,在Growth A medium 中活细胞密度仍最高,在Dynamis medium中次之,在T54 medium 中最低。从整个培养过程来看,Growth A medium 活细胞密度在同一时间均高于其他培养基,最大活细胞密度为8. 0 × 106个/ mL。见图1。3 种培养基培养的细胞活率随着培养天数的增加均呈递减趋势,在培养的前6 d,3 种培养基递减趋势基本一致,在第7 ~10 天,T54 medium 培养的细胞活率递减速率最快,Dynamis medium 递减速率最慢,Growth A medium次之。见图2。

图1 不同培养基对活细胞密度的影响Fig. 1 Effect of different media on viable cell density
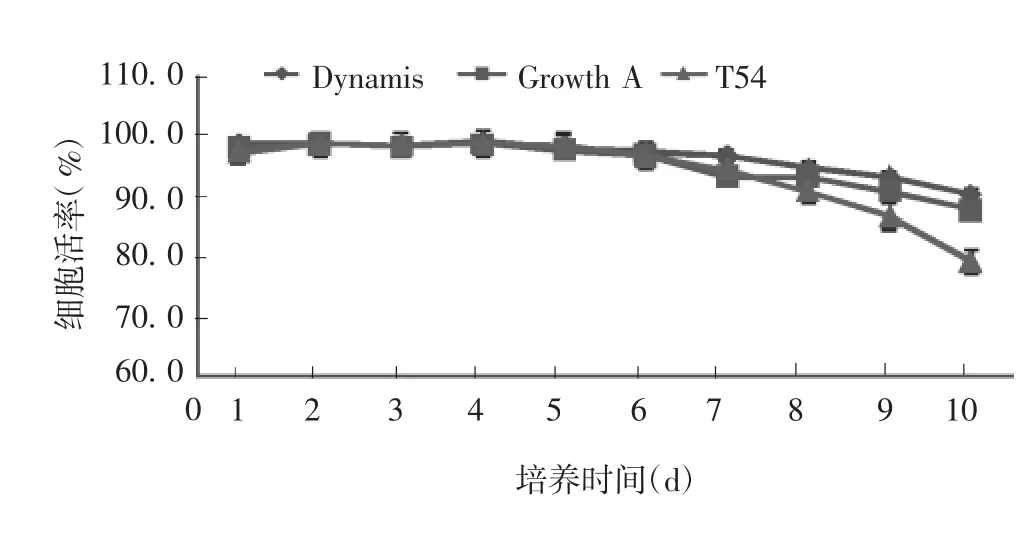
图2 不同培养基对细胞活率的影响Fig. 2 Effect of different media on viability of cells
2. 2 不同培养基培养的细胞表达单抗的纯度
2. 2. 1 SEC-HPLC 分析 Growth A medium 培养细胞上清抗体单体纯度为(98. 62 ± 0. 23)%,二聚体为(1. 38 ± 0. 05)%;Dynamis medium 培养细胞上清抗体单体纯度为(97. 08 ± 0. 25)%,二聚体为(2. 12 ±0. 12)%;T54 medium 培养细胞上清抗体单体纯度为(90. 37 ± 0. 18)%,同时出现二聚体、四聚体等聚集现象。比较3 种培养基培养细胞上清SEC-HPLC分析结果,Growth A medium 培养上清单体纯度最高,抗体很少聚集;T54 medium 培养上清抗体单体纯度最低,抗体聚集结构复杂,出现二聚体、四聚体等聚集现象;Dynamis medium 处于Growth A medium和T54medium 之间。见图3。

图3 不同培养基培养的细胞表达抗体的SEC-HPLC 纯度分析Fig. 3 Analysis of purity of McAbs expressed in cells cultured in different media by SEC-HPLC
2. 2. 2 CE-SDS 分析 非还原CE-SDS 结果显示,3种不同培养基培养细胞表达的抗体电泳图谱基本一致,但不同峰校正峰面积比例差异明显,Growth A medium 抗体单体纯度最高,为(94. 22 ± 0. 56)%,3 / 4 抗体和重链二聚体分别占(2. 03 ± 0. 08)%和(2.44±0.12)%,轻链和重链分别占(1.13±0.06)%和(0. 18 ± 0. 09)%;T54 medium 抗体单体纯度为(80. 77 ± 0. 72)%,3 / 4 抗体和重链二聚体分别占(10. 32 ± 0. 91)%和(2. 66 ± 0. 09)%,轻链和重链分别占(4. 86 ± 0. 76)%和(0. 82 ± 0. 03)%;Dynamis medium 抗体单体纯度为(77. 83 ± 0. 83)%,3 / 4 抗体和重链二聚体分别占(7. 09 ± 0. 42)%和(11. 81 ±0. 98)%,轻链占(2. 63 ± 0. 48)%,未检测到寡重链。见图4。

图4 不同培养基培养的细胞表达抗体的非还原CE-SDS纯度分析Fig. 4 Analysis of purity of McAbs expressed in cells cultured in different media by CE-SDS
还原CE-SDS 结果显示,3 种培养基表达抗体峰型一致,明显分离出重链、轻链以及非糖基化重链,其中重链和轻链比例3 者之间无明显差异,非糖基化重链比例3 种培养基差异显著,Growth A medium为(0. 57±0. 03)%,T54 medium 为(0. 43±0. 02)%,Dynamis medium 为(0. 37 ± 0. 02)%。见图5。1. 47)%;T54 medium 单抗主峰占(68. 83 ± 2. 78)%,1 个碱性峰占(6.22±0.74)%,8 个酸性峰占(24.89 ±2. 01)%。见图7。

图5 不同培养基培养的细胞表达抗体的还原CE-SDS 纯度分析Fig. 5 Analysis of purity of McAbs expressed in cells cultured in different media by reduced CE-SDS

图7 不同培养基培养的细胞表达抗体电荷异质性的cIEF 分析Fig. 7 Analysis of charge heterogeneity of McAbs expressed in cells cultured in different media by cIEF
2. 5 不同培养基培养的细胞表达抗体的关键质量属性 3 种培养基对应抗体的关键质量属性见表1。
表1 3 种不同培养基对应抗体的关键质量属性(±s,n = 3)Tab. 1 Critical quality attribute of McAbs expressed in cells cultured in three media(±s,n = 3)

表1 3 种不同培养基对应抗体的关键质量属性(±s,n = 3)Tab. 1 Critical quality attribute of McAbs expressed in cells cultured in three media(±s,n = 3)
培养基pI纯度(%)电荷变异体(%)SEC-HPLC非还原CE-SDS还原CE-SDS酸性峰主峰碱性峰Growth A98. 62 ± 0. 2394. 22 ± 0. 560. 57 ± 0. 038. 41 ± 0. 0122. 53 ± 1. 0267. 50 ± 2. 389. 99 ± 0. 86 Dynamis97. 08 ± 0. 2577. 83 ± 0. 830. 37 ± 0. 028. 42 ± 0. 0131. 41 ± 1. 4765. 88 ± 2. 162. 70 ± 0. 74 T5490. 37 ± 0. 1880. 77 ± 0. 720. 43 ± 0. 028. 42 ± 0. 0124. 89 ± 2. 0168. 83 ± 2. 786. 22 ± 0. 74
2. 3 不同培养基培养的细胞表达单抗的pI cIEF 分析显示,Growth A medium 单抗的pI 为(8.41±0. 01),Dynamis medium 单抗的pI 为(8. 42 ± 0. 01),T54 medium 单抗的pI 为(8. 42 ± 0. 01),见图6。

图6 不同培养基培养的细胞表达抗体pI 的cIEF 分析Fig. 6 Determination of pI values of McAbs expressed in cells cultured in different media by cIEF
2. 4 不同培养基培养的细胞表达单抗的电荷异质性 Growth A medium 单抗主峰占(67.50±2.38)%,2 个碱性峰占(9.99±0.86)%,6 个酸性峰占(22.53 ±1.02)%;Dynamis medium 单抗主峰占(65.88±2.16)%,1 个碱性峰占(2.70±0.74)%,7 个酸性峰占(31.41±
3 讨 论
截止2020 年,全球已有70 多个单抗药物上市,市场销售额高达25 亿,其中绝大多数产品均由CHO细胞生产[6]。常用于抗体药物生产的CHO 细胞系有CHO-K1、CHO-DG44 和CHO-S 等[7-8]。抗体药物生产细胞培养工艺一般有batch、Fed-batch、Perfusion 3 种不同培养模式,不同企业根据细胞株属性及工艺要求选择培养模式[9-11]。不同的培养工艺、培养介质一般会对抗体表征及理化性质产生明显差异[12-13],这些抗体表征的差异会影响药品临床使用的安全性和疗效。本研究的目的是筛选适应本实验室开发的抗破伤风毒素人源单抗细胞株的培养基,选取的3 种商用培养基为Growth A medium、Dynamis medium、T54 medium,3 种商用培养基均为无血清培养基,Fed-batch 培养模式,通过考察最大活细胞密度、抗体纯度、pI 及电荷变异体综合评价3 种培养基是否适合工程细胞,获得适应性良好的培养介质。目前,单抗药物生产采用无血清培养基,添加胰岛素、转铁蛋白、乙醇胺和二氧化硒取代血清成分[14]。不同的培养基添加物比例各有差异,对不同的CHO 细胞最大活细胞密度、抗体表达量、抗体结构完整性、蛋白表征以及糖基化修饰也不尽相同。因此,细胞株培养基优化筛选应从最大活细胞密度、抗体属性综合考虑。本研究中的3 种商业化培养基是前期初步筛选出的,对该细胞株可适应性培养。从最大活细胞密度来看,细胞株在Growth A medium 中最大活细胞密度达8. 0 × 106个/ mL,明显高于Dynamis medium 和T54 medium,表明Growth A medium 维持高细胞密度效果显著,适合抗破伤风毒素人源单抗细胞株早期培养。
抗体聚集是抗体生产过程中不可避免的现象,其可能发生在培养、纯化、下游工艺或储存运输过程中,抗体聚集包括物理性聚集和化学键的形成[15-17]。此外,不同的培养基营养成分、离子强度、渗透压不同,所表达的抗体表面所带电荷不同,因此形成聚体的程度不同。聚体影响抗体药物的疗效、安全性、稳定性,抗体药物生产过程中需严格控制聚体比例。Growth A medium 培养物聚体含量最低,主要以二聚体为主,比例约占1. 38%,Dynamis medium 和T54 medium 培养物聚体含量均较高,T54 medium 培养物聚体出现二聚体和四聚体两种聚体,表明Growth A medium 抗体聚体控制效果较显著。单抗碎片关系到产品稳定性,一直备受生产企业关注,单抗药物为生物大分子,由两个重链和两个轻链通过二硫键连接,在生产过程中,宿主蛋白酶切割作用引起铰链区断裂产生不同的碎片,这些抗体碎片影响治疗的有效性和安全性[18-19]。酸性环境易造成抗体碎片形成,有研究报道,抗体pH 值从6 调至4,于40 ℃放置28 d,抗体碎片从2. 8%增至31. 2%[20]。在培养过程中,葡萄糖代谢产生乳酸,培养体系pH 降低,而培养基不仅提供细胞生长所需营养物质,同时对培养体系有重要的缓冲作用,不同培养基缓冲效果各不相同。《中国药典》三部(2020 版)明确规定,单抗药物碎片检测采用CE-SDS 法[21],本研究利用CESDS 分析Growth A、Dynamis、T54 3 种培养基抗体单体纯度,分别为94. 22%、77. 83%、80. 77%,表明Growth A medium 维持培养效果较好,细胞宿主蛋白酶切割作用得到有效抑制。
单抗药物在生产、储存、运输过程中,不同的理化性质、环境因素均可能导致产生变异体,产生的变异体按净电荷分布不同分为电荷变异体。表观pI小于主峰为酸性变异体,pI 大于主峰为碱性变异体。其影响抗体药物重要质量属性,如稳定性、溶解性、药效和药代,从而潜在影响药物临床使用的安全性和有效性[22-23]。引起酸性变异体的因素主要有门冬酰胺脱酰胺化、糖基化修饰,引起碱性变异体的因素有赖氨酸截断、N-末端谷氨酰胺的不完全环化、门冬氨酸异构化以及甲硫氨酸氧化等。cIEF 由于其高灵敏度、重复性被广泛应用于抗体药物电荷异质性的分析[24]。本实验采用cIEF 分析3 种培养基培养的细胞表达抗体的电荷变异体情况,结果显示,3 种培养基Growth A、Dynamis 和T54 电荷变异体主峰比例分别为(67. 50 ± 2. 38)%、(65. 88 ± 2. 16)%、(68. 83 ± 2. 78)%,主峰占比差异不大,Growth A medium 有6 个酸性峰,Dynamis medium 有7 个酸性峰,T54 medium 有8 个酸性峰,而且Growth A medium酸性峰占比最低,为(22. 53 ± 1. 02)%,三者碱性峰差异不显著。表明3 种培养基在抗体生产过程中Growth A medium 产生的电荷变异体数量较少,较适合抗体生产。
综上所述,本研究采用Growth A、Dynamis、T54 3 种培养基,Fed-batch 培养模式,通过比较抗体的关键质量属性,从细胞的生长状态、抗体纯度(聚体及抗体碎片分布)、pI、电荷异质性综合比较发现,Growth A、Dynamis、T54 3 种培养基表达抗体的关键质量属性存在差异,Growth A medium 更适合抗破伤风毒素人源单抗工程细胞株的培养。本研究对工程细胞株培养基的开发及筛选具有一定的指导意义。

