静注COVID-19 人免疫球蛋白(pH 4)原料血浆筛选用试剂盒(ELISA)的确定及其定量检测方法的建立、验证及应用
周志军,邢延涛,梁小龙,肖龙,曾双迎,李璞,邓琨,王月,喻剑虹,李陶敬,胡勇,韩韧,李策生
1. 国药集团武汉血液制品有限公司,湖北武汉 430207;2. 北京天坛生物制品股份有限公司,北京 100024
新型冠状病毒肺炎(coronavirus disease 2019,COVID-19)是一种由重症急性呼吸综合征冠状病毒(severe acute respiratory syndrome coronavirus 2,SARSCoV-2)感染引起的急性传染性疾病[1]。SARS-CoV-2是具有包膜的单股正链RNA 病毒,冠状病毒科β 属,是目前感染人类的冠状病毒家族中的第7 个成员[2-4]。COVID-19 临床以发热、干咳、乏力为主要表现,部分患者出现呼吸困难、腹泻等症状,可进展为急性呼吸窘迫综合征、脓毒症休克和出凝血功能障碍等,严重者可致患者死亡,其康复者体内可产生能够中和病毒的特异性抗体,因此康复者血浆在重大疫情紧急救治中发挥着重要作用[5]。COVID-19 暴发早期,国药集团武汉血液制品有限公司(简称武汉血制)以康复者恢复期血浆为原料尝试制备了COVID-19 人免疫球蛋白,是一种高纯度、高比活[6]、安全性好且不受血型限制的高特异性靶向治疗COVID-19 的血液制品,但其原料血浆来源稀缺且不可持续[7]。当前国内新型冠状病毒疫苗已陆续附条件上市,其安全性和有效性[8-10]已获得大量数据支撑,采用新型冠状病毒疫苗免疫后健康人血浆大规模制备COVID-19人免疫球蛋白已成为可能。
特异性免疫球蛋白的制备工艺与普通免疫球蛋白类似,其关键点或技术瓶颈是建立快速高通量的高效价中和抗体血浆筛选方法,以及获得含高效价中和抗体的原料血浆[11],在实际生产中通常采用ELISA 法、凝集法、免疫扩散法等方法[12-13]。选择合适检测方法筛选含高滴度抗SARS-CoV-2 IgG 抗体的新型冠状病毒疫苗免疫后血浆尤为重要。厂家A最早开发了与新型冠状病毒中和抗体相关的受体结合位点(receptor binding domain,RBD)作为抗原检测康复者恢复期血浆新型冠状病毒IgG 抗体的试剂盒,经测试,该试剂盒敏感度高、线性好,但与普通静注人免疫球蛋白及其他常见特异性人免疫球蛋白有一定的交叉反应。随着新型冠状病毒体外诊断试剂研发的进展,已有多家新型冠状病毒抗体ELISA 检测试剂在中国食品药品检定研究院(简称中检院)报批生产文号。
本文共测试了5 种基于RBD-IgG 检测的试剂盒,对其检测新型冠状病毒疫苗免疫后血浆的适用性进行研究,最终确定一家性价比高的试剂盒建立定量检测方法,经验证后,可尝试用于新型冠状病毒疫苗免疫后血浆的检测。
1 材料与方法
1. 1 内控标准品 COVID-19 康复者恢复期病毒灭活血浆(批号:2020021702)由武汉血制制备,中检院采用假病毒中和试验及新型冠状病毒蚀斑减少中和试验检测的中和抗体滴度分别为1 ∶160 及1 ∶178。经多家ELISA 试剂盒标定其滴度为1 ∶32,即32 倍稀释后,按照不同试剂盒说明书进行操作,其A450>Cutoff。
1. 2 待检样本 COVID-19 康复者恢复期混合血浆pool4、5、6、7、8、9、10 及静注COVID-19 人免疫球蛋白原液y4、y7,新型冠状病毒疫苗免疫后血浆样本pool11-1 及pool11-2,均由武汉血制提供,其中部分样品经中检院进行了假病毒中和试验检测;静注人免疫球蛋白(批号:201801001、201801003、201912041、201912043、202001002)、巨细胞人免疫球蛋白原液(批号:20100701)、破伤风人免疫球蛋白(批号:2019-1102)、乙型肝炎人免疫球蛋白(批号:20190701)和狂犬病人免疫球蛋白(批号:20200201),均为武汉血制产品。
1. 3 主要试剂及仪器 新型冠状病毒(2019-nCoV)IgG 抗体检测试剂盒由厂家A(武汉某生物技术有限公司,批号:20200327)、厂家B(北京某生物药业股份有限公司,批号:NCOG2020223B、NCOG2020020-4B、NCOG20200307B)、厂家C(珠海某试剂股份有限公司,批号:2020040508)、厂家D(北京某生物技术有限公司,批号:20200601)提供;新型冠病毒RBDIgG 检测试剂盒由厂家E(北京某临床诊断试剂有限公司,批号:20201011)提供;各厂家试剂盒反应条件见表1。酶标仪购自美国MD 公司,型号Spectro MAX plus384,软件SoftMax 5. 2。
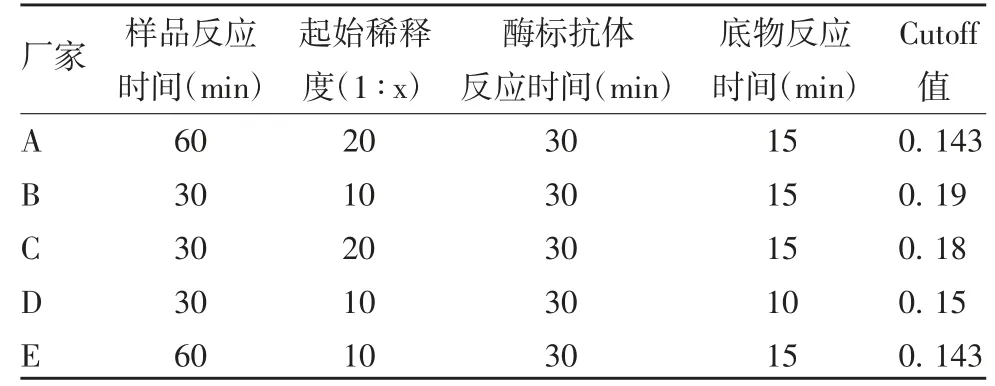
表1 不同厂家试剂盒的反应条件Tab. 1 Reaction conditions of kits from various manufacturers
1. 4 试剂盒的确定
1. 4. 1 线性及范围 将具有中和活性的COVID-19康复者恢复期病毒灭活血浆(批号:2020021702)作为内控标准品。为消除稀释液和稀释误差,仅使用厂家B 试剂盒样品稀释液进行2 倍系列稀释,至少7 个浓度(S1 ~S7 分别为1 ∶10 ~1 ∶640),分别加至5 个厂家试剂盒的酶标板中,100 μL / 孔,按试剂盒说明书进行后续操作。
比较5 个厂家试剂盒检测内控标准品系列稀释度的结果,以不同试剂盒的Cutoff 值判断各厂家分别能检出几个倍比稀释度(即线性范围);比较内控标准品在不同试剂盒的最高浓度样品S1 的A450值(即敏感度);将5 个厂家检测结果分别进行双对数拟合曲线,比较曲线之间的平行性及斜率,判断各厂家试剂盒的相关性及优劣。
1. 4. 2 定量检测方法的建立 根据上述5 个厂家试剂盒的线性及范围,选用线性范围一致的厂家A、B 和E 试剂盒建立定量检测方法。用厂家A、B 和E试剂盒各自附带的样品稀释液将内控参考品进行2倍系列稀释,至少7 个浓度(S1 ~S7 分别为1 ∶10 ~1 ∶640),分别加至厂家A、B 和E 试剂盒的酶标板中,100 μL / 孔,按试剂盒说明书进行后续操作。读取A450值,采用SoftMax 5.2 软件,以抗SARS-CoV-2-IgG孔外稀释度为横坐标,A450值为纵坐标,四参数方程拟合标准曲线,得出R2值。计算各浓度回算值的回收率,标准曲线线性的可接受标准为R2>0. 99,各浓度的稀释度回收率应在目标值± 15%范围内。
孔外稀释度为样品稀释后取100 μL 加至包被板孔中,而试剂盒要求样品按10 倍(10 μL 样品+100 μL 样品稀释液)或20 倍(5 μL 样品+100 μL 样品稀释液)稀释后上样,因此样品稀释度= >Cutoff的最高孔外稀释度/ 起始稀释度。
1. 4. 3 厂家A、B 和E 试剂盒阴性样本的定量检测检测常见特异性人免疫球蛋白及普通静注人免疫球蛋白的滴度,确定试剂盒的特异性。厂家A 按照试剂盒说明书1 ∶20 稀释上样,厂家B、E 按照试剂盒说明书1 ∶10 稀释上样,后续操作按各自说明书进行。
1. 4. 4 厂家B 和E 试剂盒阳性样本的定量检测 检测COVID-19 康复者恢复期混合血浆及其制备的静注COVID-19 人免疫球蛋白原液和新型冠状病毒疫苗免疫后血浆样品。厂家B 和E 试剂盒起始稀释倍数为10 倍,若样品初试所得的孔外稀释度>160 则需进行复试,增加稀释倍数使其结果落在线性范围内。计算3 家试剂盒检测阳性样品结果与中和试验的相关性。确定一家试剂盒进行定量检测方法的验证。
1. 5 厂家B 试剂盒定量检测方法的验证
1. 5. 1 内控标准品稀释度的确定 用样品稀释液对内控标准品孔外进行2 倍系列稀释,至少7 个浓度(S1 ~S7 分别为1 ∶10 ~1 ∶640),按照厂家B 试剂盒说明书进行检测,以超过Cutoff(A450= 0. 19)的最高稀释度/起始稀释度作为其标定的稀释度赋值。
1. 5. 2 线性及范围 按照1. 5. 1 项方法重复检测6次,读取A450值,并用Softmax 5. 2 软件,以抗SARSCoV-2-IgG 稀释度为横坐标,A450值为纵坐标,四参数方程拟合标准曲线,公式为Y =(A - D)/[1 +(X /C)B]+D,并计算R2。计算各浓度的稀释度回算值的回收率,标准曲线的可接受标准为R2>0. 99,各浓度的稀释度回收率应在目标值±20%范围内。
1. 5. 3 准确度 将内控标准品孔外进行1 ∶15、1 ∶30、1 ∶60、1 ∶120、1 ∶240 稀释,制备高、中、低5 个浓度质控品(C1 ~C5),按照建立的方法进行检测,每个浓度做3 个平行孔,至少在2 d 进行至少3 个分析批的检测,可接受标准为各浓度质控品的稀释度平均值的回收率在目标值± 20%范围内。
1. 5. 4 精密度 将内控标准品孔外进行1 ∶15、1 ∶30、1 ∶60、1 ∶120、1 ∶240 稀释,制备高、中、低5 个浓度质控品(C1 ~C5),按照建立的方法进行检测,每个浓度做3 个平行孔,至少在2 d 进行至少3 个分析批的检测,精密度可接受标准为各浓度质控品的稀释度CV ≤20%。
1. 6 血浆筛查模式的建立 为节约成本,所有待检样品及内控标准品7 个系列样品均单孔加样,此操作模式有验证数据支持。初试时按照试剂盒要求10 μL样品+ 100 μL 样品稀释液上样,超出线性范围(孔外稀释度160)的样品进行复试,复试样品先后进行40、100 和160 倍的孔外稀释,最后确定一次性能检测更大范围的稀释度。
2 结 果
2. 1 不同厂家线性范围的比较 结果显示,从S1 的A450值来看,试剂盒敏感度厂家D >E >A >B >C;虽然厂家D 试剂盒S1 的A450值最高,但斜率约为3,导致其线性范围可用稀释度仅为3 个(S1 ~S3),线性范围太窄;厂家A 可用稀释度为6 个,但其起始稀释度是厂家B 和E 的2 倍,因此,实际可用稀释度与厂家B 和E 相同,仅为5 个。从双对数的平行性来看,厂家A、E 和B 试剂盒的线性和范围接近,斜率在1 ± 0. 2 之内,表明A450值的变化与稀释度的变化基本等比,线性范围更宽,可进行定量检测的尝试。见表2 和图1。

图1 5 个厂家试剂盒检测内控标准品的平行性比较Fig. 1 Comparison of parallelism of kits from five manufacturrers for internal control standard
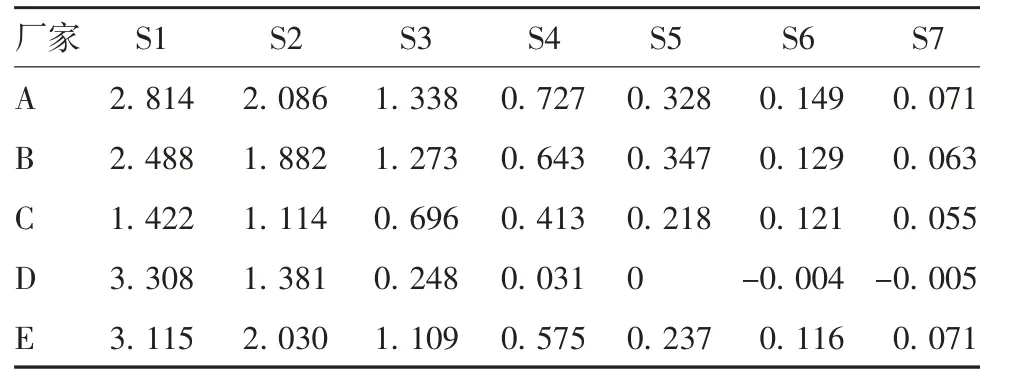
表2 不同厂家试剂盒检测内控标准品系列稀释样品的A450 值Tab. 2 A450 of serially diluted internal control standard determined by kits from various manufacturers
2. 2 厂家A、B、E 试剂盒定量检测方法的建立 结果显示,厂家A 试剂盒检测的内控标准品的最高孔外稀释度为640,厂家B 和E 检测的内控标准品的最高孔外稀释度为320,3 个厂家去除起始稀释度的样品稀释度均为32。以S1 ~S6 建立的四参数方程标准曲线R2>0. 99,各稀释度的回收率在目标值±20%范围内。线性范围为稀释度1 ~32,可用该标准曲线定量计算不同样品的稀释度。见表3。

表3 3 个厂家试剂盒建立标准曲线的数据汇总Tab. 3 Data summary of standard curve of kits from three manufacturers
2. 3 厂家A、B、E 试剂盒的特异性比较 结果显示,厂家B 和E 试剂盒特异性优于厂家A。由于静注人免疫球蛋白类产品的IgG 浓度至少为血浆的5 倍,将其稀释5 倍后的检测结果显示,厂家B 和E 均为阴性,而厂家A 仍为阳性,表明该试剂盒特异性有待提高。见表4。

表4 3 个厂家试剂盒检测非COVID-19 人免疫球蛋白的结果Tab. 4 Determination results of non-COVID-19 human immunoglobulin by kits from three manufacturers
2. 4 厂家A、B、E 试剂盒检测阳性样本结果的相关性结果显示,与假病毒中和试验的相关性均在0.9 以上,见表5 和表6,因此可采用RBD-IgG 的间接ELISA试剂盒来筛选新型冠状病毒阳性样品。厂家A 试剂盒特异性较差,综合考量(成本和操作方式)后,选择厂家B 试剂盒进行定量检测方法的验证。

表5 3 个厂家试剂盒及中和试验检测阳性样本的稀释度Tab. 5 Dilutions of positive samples determined by kits from three manufacturers and by neutralization test

表6 3 个厂家试剂盒与中和试验检测结果的相关性Tab. 6 Correlation between determination results by kits from three manufacturers and by neutralization test
2. 5 厂家B 试剂盒定量检测方法的验证
2. 5. 1 内控标准品稀释度的确定 3 个批次厂家B试剂盒检测结果显示,内控标准品的孔外稀释度最高为320 时,其A450>0. 19(Cutoff 值),因此稀释度为32(320 / 10),内控标准品的后续检测均按照稀释度32 赋值。见表7。

表7 内控标准品的稀释度确定Tab. 7 Determination of dilution of internal control standard
2. 5. 2 线性范围的确定 用厂家B 试剂盒(NCOG-20200307B)在2 d 内重复检测内控标准品7 个稀释度的结果显示,6 个分析批的数据用Softmax 5. 2 软件拟合四参数方程成立,R2>0. 99,见图2;6 个分析批检测的内控标准品的2 倍系列稀释度中,前6 个浓度S1 ~S6 用四参数方程拟合的标准曲线重复性好,6 个曲线均满足内控标准品各浓度回收率在目标值± 20%范围内。因此,确定试剂盒定量检测方法的线性范围为稀释度1 ~32。见表8。

表8 内控标准品系列稀释样品的A450 值及线性拟合后的各浓度回收率(%)Tab. 8 A450 of serially diluted internal control standard and recovery rates of various concentrations after linear fitting(%)

图2 6 个分析批的四参数方程拟合曲线汇总Fig. 2 Four-parameter equation fitting curves of six analysis batches
2. 5. 3 准确度 5 个质控值的回收率在91. 31% ~121. 41%之间,其中1 ∶15 稀释的C1 准确度稍超标,因此,将线性范围确定在稀释度1 ~16 之间结果更加可靠。见表9。

表9 准确度验证(%)Tab. 9 Validation for accuracy(%)
2. 5. 4 精密度 5 个质控值检测结果的批内CV 在2. 3% ~12. 4%之间,批间CV 在3. 70% ~8. 18%之间,符合要求。见表10。

表10 精密度验证(%)Tab. 10 Validation for precision(%)
2. 6 血浆筛查模式 确定单孔检测后,1 个96 孔板可检测80 多份样品,内控标准品6 个稀释品及阴阳性对照放在固定位置。根据样品来源可设计检测稀释度,如康复者恢复期血浆因其抗体水平较高,初次检测时可5 μL 样品+ 100 μL 样品稀释液上样,稀释度为2,初试超出线性范围者复试可用10 倍稀释,再次超出可用40 倍稀释,最高稀释度可达640 ~1 280,这个范围也可用作COVID-19 人免疫球蛋白的检测稀释度。对于疫苗免疫后血浆,因其抗体水平普遍较康复者恢复期血浆低,初次检测时可10 μL样品+ 100 μL 样品稀释液上样,稀释度为1,初试超出线性范围者复试可用16 倍稀释,稀释度范围为16 ~512。
3 讨 论
COVID-19 康复者体内含有对抗病毒的中和抗体,将康复者血浆提取制备而成的静注COVID-19人免疫球蛋白,属于高比活、高纯度、高特异性的新型冠状病毒靶向治疗药物。随着国内新型冠状病毒疫苗的研制成功,接种疫苗后含有新型冠状病毒抗体的人群数量远多于新型冠状病毒康复者,用疫苗免疫后正常献浆员来获得高效价的新型冠状病毒抗体血浆并以此为原料制备COVID-19 人免疫球蛋白,比新型冠状病毒康复者来源更稳定,因此检测疫苗免疫后血浆滴度就成为关键步骤。
中和抗体效价是静注COVID-19 人免疫球蛋白的关键质量指标之一。检测金标准为中和试验,一般采用细胞病变抑制法[14]。目前中检院采用假病毒法中和试验,中国科学院武汉病毒所采用蚀斑法中和试验。上述方法可对该项目进行准确检定,但由于方法限制,检定时间长,需1 ~2 周,因此需要一种更为快速可靠的检测方法。ELISA 法具有通量高、成本低、操作便捷等优势,在研发过程中应用广泛。
ELISA 试剂盒根据其包被抗原的种类又可分为N 蛋白、全长S 蛋白和RBD,其中位于S1 蛋白的病毒棘突受体结合结构域RBD 是病毒入侵机体细胞的关键位点[15]。选用RBD 抗原制备的ELISA 试剂盒,更能反映中和抗体水平。目前市售的5 家试剂盒除厂家D(纯化的病毒裂解物,WB 显示主要成分为RBD 蛋白)外,均宣称使用重组表达纯化的RBD蛋白,均针对的是新型冠状病毒中和抗体。但在实际使用中,需对各厂家试剂盒的适用性(特异性、敏感度、线性范围)进行评估。2020 年4 月,国药血制用仅有的厂家A 和B 试剂盒检测了某公司复工人员血清108 份,通过假阳性率来判断试剂盒的特异性,发现厂家A 试剂盒的假阳性(8 / 108)高于厂家B(3 / 108);2020 年9 月,用仅有的厂家B、C、D 试剂盒检测了应急使用新型冠状病毒灭活疫苗免疫后不同时间采集的血清样本的新型冠状病毒IgG 抗体,以阳性率来判断试剂盒的敏感度,发现厂家B >C >D;2020 年11 月,集齐5 个厂家试剂盒后,对其IgG抗体检测试剂盒进行了全面筛选(厂家A 因缺货仅用前期数据进行回顾性比较),最终选定一家试剂盒用于静注COVID-19 人免疫球蛋白制备所需原料血浆的检测。
选用COVID-19 暴发前制备的静注人免疫球蛋白、人血白蛋白(原料血浆采集时间在2019 年5 月前)等制品进行检测,是为了排除高浓度IgG 对间接ELISA 方法学上的影响,验证该方法的特异性,结果显示,厂家E 和B 试剂盒特异性优于厂家A。厂家D试剂盒线性范围太窄,不太适合定量检测的要求。厂家A、B、E 试剂盒的敏感度和线性范围接近,但厂家A、E 试剂盒反应时间长于厂家B,在不影响实验结果的情况下,基层用户更倾向于操作时间短的试剂,且厂家E 试剂盒尚在优化过程中,不同批号结果差异较大。早期厂家A 试剂盒检测结果与中和试验检测结果具有一定的相关性,而厂家B 与A 的平行性几乎重合,为了与前期结果一致,并解决厂家A试剂盒非特异性不好的问题,综合考虑我们选择了厂家B 试剂盒。
目前IgG 检测均为间接ELISA 试剂盒,仅能定性或者半定量。武汉血制早期康复期血浆筛选使用的是厂家A 试剂盒的半定量检测,即将待检血浆稀释4 个浓度(1 ∶80、1 ∶160、1 ∶320、1 ∶640),1 个试剂盒最多检测23 个样品。后期我们选用一个有中和试验结果的血浆作为内控标准品,确定了试剂盒的线性范围并建立了定量检测方法,验证后仅需做6 ~7 个稀释度的内控标准品,每个待检样品仅需做1 个稀释度,1 个试剂盒最多可检测87 个样品,可一次性确定稀释度1 ~16 的样品,超过线性范围的样品仅需集中起来进行1 次更高稀释度(16 ×)的复试即可确定其最终稀释度,这样就大大节省了试剂盒成本和人力。
厂家B 试剂盒的定量检测方法也可用于原液和半成品的内部控制检测,但样品需做多个稀释度,与内控标准品的稀释度一起进行双对数拟合,用平行线法计算得到的结果更准确。

