无血清悬浮培养MDCK 细胞系的建立及生物反应器高密度培养
赵彩红,王美皓,李自良,靳冬武,马花,马忠仁,,乔自林,陈宏,张家友,王家敏
1. 西北民族大学生物医学研究中心甘肃省动物细胞技术创新中心,甘肃兰州 730030;2. 西北民族大学生命科学与工程学院,甘肃兰州 730030;3. 兰州百灵生物技术有限公司,甘肃兰州 730010;4. 吉林冠界生物技术有限公司,吉林梅河口 135000;5. 武汉生物制品研究所有限责任公司,湖北武汉 430000
哺乳动物细胞系可广泛应用于重组蛋白、单克隆抗体以及疫苗等生物制品的生产[1-2]。MDCK 传代细胞系作为生产流感疫苗最为常用的细胞基质,在过去几十年已进行了详细的研究[3-4]。已建立的MDCK 细胞系为贴壁培养型细胞[5],在企业生产中可借助微载体、片状载体或细胞工厂等媒介进行规模化培养,这不仅增加了生产成本,更不利于工业生产的便捷操作[6-9]。随着新兴培养基的开发以及新细胞系的研究,MDCK 悬浮细胞已投入研究及工业生产中[10-14]。悬浮培养方式不仅较贴壁培养节省了生产成本,大大减少了人力物力,降低了外源污染的风险,还减少了产品的批间差异,简化了下游的纯化工艺[15]。但这些上述报道的MDCK 悬浮细胞系在相应的培养基中比生长速率、生长密度以及对病毒的敏感性均较低,因此,仍在开发高密度、快速生长且对病毒较敏感的MDCK 悬浮细胞。另外,细胞在实验室阶段的高密度生长与工业生产不一定存在线性关系,尤其是对剪切力更为敏感的悬浮细胞系。
本研究旨在将MDCK 贴壁细胞驯化为无血清培养的悬浮细胞系,验证其对流感病毒的敏感性,并进一步探讨该细胞逐步扩大工业化生产的可行性,以期建立1 株能在生物反应器中高密度、快速生长且易感的MDCK 细胞系。
1 材料与方法
1. 1 细胞及病毒 贴壁培养型MDCK 细胞从ATCC引进,由甘肃省动物细胞技术创新中心按《中国药典》三部(2010 版)要求建立主细胞库(MDCK-M-60,P60)和工作细胞库(MDCK-W-63,P63);甲型流感病毒A / California / 7 / 2009 X-179A(简称H1N1)和乙型流感病毒B / Phuket / 3073 / 2013(简称B / P)均来源于NIBSC;禽流感病毒H5N1 Re-11(简称H5N1)来源于哈尔滨兽医研究所。
1. 2 主要试剂及仪器 DMEM 培养基(20180423)和MDCK-SFM-03 无血清培养基(20181223)购自兰州百灵生物技术有限公司;NBS(20150901)购自兰州民海生物工程有限公司;TrypLE 胰蛋白酶替代物购自美国Gibco 公司;台盼蓝和DMSO 购自美国Sigma公司;1.2 L DASGIP 四联平行生物反应器购自和5 L BioFlo®320 生物反应器购自美国Eppendorf 公司;75 L 生物反应器购自上海日泰医药设备工程有限公司;葡萄糖测定仪购自深圳市西尔曼科技有限公司;CK-41 倒置相差显微镜购自日本OLYMPUS 公司;Countstar 细胞计数仪购自上海睿钰生物科技有限公司。
1. 3 MDCK 细胞无血清全悬浮驯化及建库 将贴壁型MDCK 细胞用含10% NBS 的DMEM 培养基于T25 细胞培养瓶中贴壁培养,采用逐步降低血清的方式将血清降至3%培养,连续传代5 代。用MDCKSFM-03 培养基直接替代3%低血清培养基继续进行贴壁培养的无血清驯化,在传代过程中用TrypLE胰蛋白酶替代物取代普通的胰蛋白酶进行消化。待细胞完全适应MDCK-SFM-03 无血清培养基后,再将其转入150 mL 摇瓶中进行无血清全悬浮驯化培养,在摇床(5% CO2)上,按200 × 104个/ mL 的密度,50 ~100 r / min 先低速悬浮培养,待细胞生长稳定后逐步增加转速至120 r / min。将驯化后的MDCK 无血清悬浮细胞系命名为MDCK-XF03,连续传代培养,待稳定后扩大冻存,建立MDCK 悬浮细胞主库和工作库。
1. 4 MDCK-XF03 细胞对病毒敏感性的检测 复苏工作库MDCK-XF03 细胞,待细胞生长至(800 ~1 000)×104个/mL 时,稀释至(300 ~400)×104个/mL,加入2.5 μg/mL TPCK 胰蛋白酶,分别按1%(v/v)、0. 1%(v / v)、0. 1%(v / v)的比例接种H1N1 流感病毒、B / P 流感病毒、H5N1 禽流感病毒,置于34 ℃,5% CO2,110 r / min 摇床上分别培养,分别于培养24、48、72 h 观察细胞形态和病变程度,测定血凝(HA)效价,并绘制不同时间的HA 效价图。试验重复3 次。
1. 5 MDCK-XF03 细胞初始接种密度的筛选及生长特性分析 将摇瓶培养的MDCK-XF03 细胞分别按50 × 104、100 × 104、150 × 104、200 × 104个/ mL 的初始密度接种至1. 2 L DASGIP 四联平行生物反应器,培养体积为1 L,设置搅拌转速为120 r / min,温度36. 8 ℃,pH(7. 0 ± 0. 2),DO 30%,批式培养5 d,培养期间不再额外添加任何营养物质,试验重复3 次。培养过程中每隔12 h 取样,利用细胞计数仪检测活细胞密度、细胞活率、细胞直径和细胞结团率,绘制各参数变化曲线,并按下式计算细胞倍增时间和比生长速率。同时将收取的样品175 × g 离心5 min后取上清,于-20 ℃保存,批培养结束后,利用葡萄糖测定仪检测葡萄糖浓度,绘制葡萄糖代谢曲线。
倍增时间= T / A,A = log2(Y/X)
式中X 为初始接种细胞数,Y 为细胞最大増殖密度前1 d 的细胞数,T 为培养时间。
比生长速率=(lnXn/Xn-1)/(tn- tn-1)
式中X 为活细胞密度,t 为培养时间,n 和n-1为2 个取样计数时间点。
1. 6 MDCK-XF03 细胞在生物反应器中的线性放大培养 以1. 2 L DASGIP 四联平行生物反应器的结果为依据,选择最适初始接种细胞密度进行培养,反应器培养参数设置为搅拌转速120 r / min,温度36. 8 ℃,pH(7. 0 ± 0. 2),DO 30%。5 L 生物反应器(培养体积为3. 5 L)培养至48 h,转罐至75 L 生物反应器(培养体积为50 L)培养至48 h,接种B / P流感病毒。试验重复3 次。
2 结 果
2. 1 MDCK 细胞无血清全悬浮驯化及建库 MDCK贴壁细胞经3%低血清培养后,细胞生长变慢,状态良好(图1A),细胞形态与10%血清培养相比,无明显差别;用MDCK-SFM-03 培养基直接取代3%低血清培养基连续贴壁培养5 代,至细胞能稳定生长,细胞形态变圆(图1B);再用MDCK-SFM-03 培养基低速悬浮培养,培养初期细胞结团较严重(图1C)。
将驯化后的MDCK-XF03 细胞第1 代记为XFP1,连续培养5 代,细胞在XF-P1 ~XF-P2 代结团较严重,活率较低,采用离心换液的方式再继续培养。细胞从XF-P5 代后恢复生长,结团细胞减少,细胞大小较为均一(图1D)。XF-P10 代细胞密度达952.33×104个/ mL,活率为98. 6%,状态良好,见图2。建立MDCK-XF03 主细胞库100 支和工作细胞库200 支,细胞冻存活率为98. 6%。细胞复苏后,活率为96. 8%,大小均一,均质透明,无明显结团现象,见图3。

图1 MDCK 细胞驯化过程中的形态观察Fig. 1 Morphology of MDCK cells during domestication

图2 MDCK-XF03 细胞连续传代驯化Fig. 2 Continuous subculture of domesticated MDCK-XF03 cells

图3 MDCK-XF03 细胞复苏后的形态观察Fig. 3 Morphology of MDCK-XF03 cells after resuscitation
2. 2 MDCK-XF03 细胞对病毒的敏感性 悬浮培养型MDCK-XF03 细胞接种3 种不同型别的流感病毒后,病毒均能很好的增殖。接种病毒24 h 后,细胞出现接团现象,细胞变大;接种病毒48 h,完整细胞少,细胞变大,大部分破碎;接种病毒72 h,基本无完整活细胞,细胞基本破裂。见图4。

图4 流感病毒(B / P)致MDCK-XF03 细胞病变观察Fig. 4 CPE of MDCK-XF03 cells caused by influenza virus(B / P)
接种甲型H1N1 流感病毒的HA 效价(Log2)在48 h 达最高,为6;接种H5N1 禽流感病毒和B / P流感病毒的HA 效价(Log2)均在72 h 达最高,分别为8 和9。见图5。

图5 流感病毒在MDCK-XF03 细胞上增殖不同时间的HA 效价Fig. 5 HA titers of influenza virus proliferated in MDCKXF03 cells for various hours
2. 3 MDCK-XF03 细胞初始接种密度的筛选及生长特性 以不同初始密度接种MDCK-XF03 悬浮细胞后,细胞在不同培养时期的形态存在一定差异,在平台期及其之前,细胞状态与复苏后一致,大小均一,均质透明,无明显结团现象;当处于衰亡期时,细胞变大,表面不够光滑,甚至有的活率低的细胞已出现破裂。
将不同初始密度的MDCK-XF03 悬浮细胞接种至四联平行生物反应器中,细胞均会经历潜伏期、对数生长期、平台期和衰亡期4 个阶段,细胞的生长曲线均呈“S”形,细胞活率在平台期及其之前均在94%以上,当细胞处于衰亡期时,活细胞密度和细胞活率均降低。在细胞增殖过程中,培养的前84 h,以不同初始细胞密度接种的增殖浓度均存在差异,且差异均有统计学意义(t = 0. 018 ~0. 150,P = 0. 009 ~0. 034),但各组的最大增殖浓度之间差异无统计学意义(t = 0. 042 ~1. 940,P = 0. 072 ~0. 318),密度均能达1 000 × 104个/ mL。见图6。
根据工业化生产简便的模式,比较了细胞每24 h的比生长速率,发现除初始接种密度200×104个/mL外,其他初始密度接种的MDCK-XF03 悬浮细胞均在48 h 具有最大比生长速率。初始接种密度为150 ×104个/mL 时,细胞在48 h 的最大比生长速率较初始接种密度为100 × 104个/ mL 低,但差异无统计学意义(t = 0. 16,P = 0. 110),且倍增时间也更长,差异有统计学意义(t = 0. 052,P = 0. 015);初始接种密度为100 × 104个/ mL 时,细胞在48 h 的比生长速率较初始接种密度为50 × 104个/ mL 低,倍增时间也更长,但差异均无统计学意义(t 分别为0. 077 和1. 172,P 分别为0. 091 和0. 122),继续培养后,该组细胞也能达到1 206. 67 × 104个/ mL 的高密度;初始接种密度为50 × 104个/ mL 时,细胞在48 h 时具有最大比生长速率,且倍增时间最短,但此时活细胞密度明显低于其他3 组(t = 0. 013 ~0. 420,P =0. 004 ~0. 028 之间)。见图6、图7 和表1。
表1 不同初始接种密度MDCK-XF03 悬浮细胞的比生长速率(h-1,±SD,n = 3)Tab. 1 Specific growth rates of MDCK-XF03 suspension cells at various initial inoculating densities(h-1,±SD,n = 3)

表1 不同初始接种密度MDCK-XF03 悬浮细胞的比生长速率(h-1,±SD,n = 3)Tab. 1 Specific growth rates of MDCK-XF03 suspension cells at various initial inoculating densities(h-1,±SD,n = 3)
注:a 表示与200 × 104 个/ mL 组48 h 比较,P <0. 05。
细胞初始接种密度(× 104个/ mL)50100150200 240. 040 ± 0. 0050. 041 ± 0. 0030. 032 ± 0. 0050. 039 ± 0. 005 480. 045 ± 0. 003a0. 044 ± 0. 003a0. 040 ± 0. 004a0. 028 ± 0. 004 720. 039 ± 0. 0050. 015 ± 0. 0030. 011 ± 0. 0020. 011 ± 0. 002 960. 009 ± 0. 0040. 005 ± 0. 0060. 003 ± 0. 0050. 002 ± 0. 003 120-0. 012 ± 0. 006-0. 013 ± 0. 001-0. 011 ± 0. 012-0. 022 ± 0. 006时间(h)

图7 不同初始接种密度MDCK-XF03 悬浮细胞的倍增时间Fig. 7 Doubling time of MDCK-XF03 suspension cells at various initial inoculating densities
随着培养时间的延长,细胞的结团率逐渐上升,最后在平台期达最大,当细胞处于衰亡期时,活细胞密度及细胞活率均降低,细胞的结团率也呈下降趋势,初始接种密度50 × 104个/ mL 组在培养过程中各时间点与其他3 组差异均有统计学意义(t =0. 044 ~0. 735,P = 0. 005 ~0. 041),初始接种密度100 × 104个/ mL 组与150×104个/mL 组差异无统计学意义(t = 1. 810,P = 0. 063)。见图6 和图8。

图6 不同初始接种密度MDCK-XF03 悬浮细胞的活细胞密度及细胞活率变化Fig. 6 Live cell densities and survival rates of MDCK-XF03 suspension cells at various initial inoculating densities
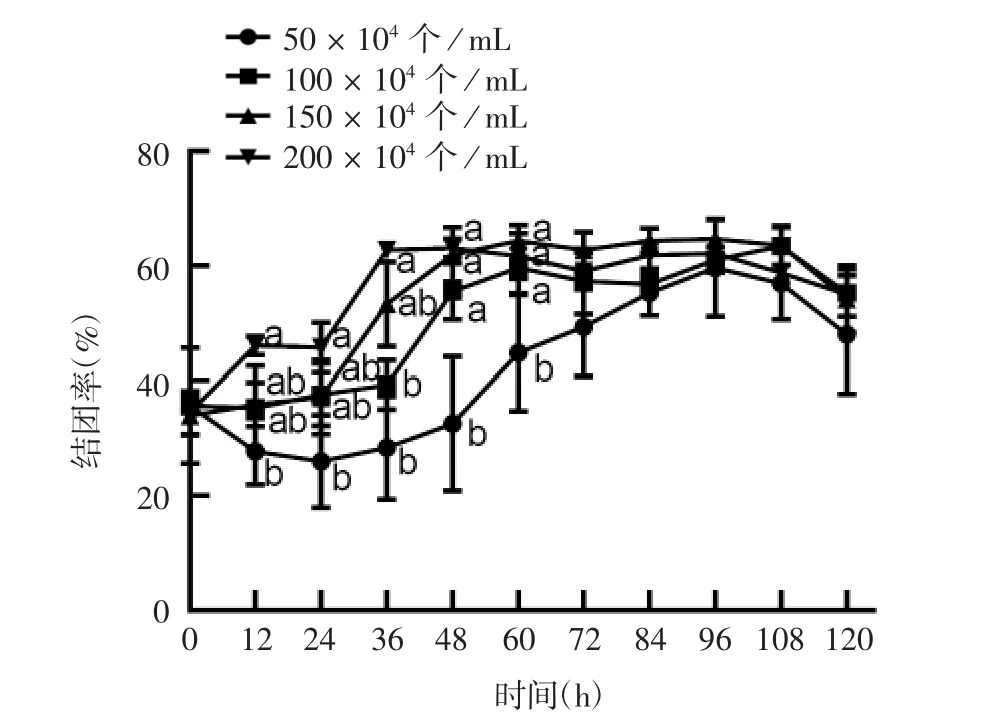
图8 不同初始接种密度MDCK-XF03 悬浮细胞的结团率变化Fig. 8 Block rates of MDCK-XF03 suspension cells at various initial inoculating densities
随着培养时间的延长,活细胞密度逐渐增加,而细胞直径呈逐渐降低,最后呈稳定趋势,在整个过程中,除初始接种密度50 × 104个/ mL 组外,其他3 组的细胞直径差异均无统计学意义(t = 0. 561 ~4. 486,P = 0. 07 ~0. 370)。见图9。

图9 不同初始接种密度MDCK-XF03 悬浮细胞的直径变化Fig. 9 Diameters of MDCK-XF03 suspension cells at various initial inoculating densities
初始接种密度200 × 104个/ mL 组在培养初期较其他3 组消耗葡萄糖速率快,72 h 时已消耗完葡萄糖,其他3 组也均在84 h 消耗完葡萄糖,见图10。考虑成本及培养周期等问题,以100 × 104个/ mL 的初始接种密度培养MDCK-XF03 悬浮细胞最合适。
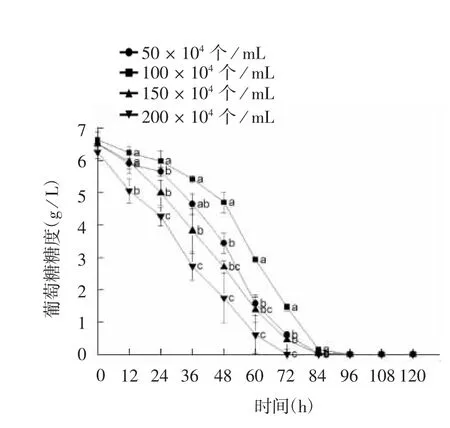
图10 不同初始接种密度MDCK-XF03 悬浮细胞的葡萄糖消耗Fig. 10 Glucose consumption of MDCK-XF03 cells at various initial inoculating densities
2. 4 MDCK-XF03 细胞在生物反应器中的线性放大培养 将MDCK-XF03 细胞以200 × 104个/ mL 的初始密度接种至生物反应器中培养,在培养过程中细胞状态良好,生长曲线呈近“S”形。在5 L 生物反应器中,MDCK-XF03 细胞培养至48 h 时,活细胞密度达882. 667 × 104个/ mL,细胞活率均维持在96%以上。将5 L 生物反应器培养至48 h 的MDCKXF03 细胞线性放大至75 L 生物反应器中,细胞在48 h 时活细胞密度达922. 667 × 104个/ mL,较5 L生物反应器高,但差异无统计学意义(t = 3. 060,P = 0. 230),细胞活率均维持在97%以上。见图11。将3 种容器培养48 h 的MDCK-XF03 悬浮细胞的比生长速率和倍增时间进行比较,差异均无统计学意义(t = 0. 180 ~1. 50,P = 0. 09 ~0. 617),见表2。将培养至48 h 的MDCK-XF03 细胞按(300 ~400)×104个/ mL 的密度进行稀释接毒,48 h HA 效价达10 Log2。

图11 5 L 及75 L 生物反应器的放大培养Fig. 11 Scale-up culture in 5 L and 75 L bioreactors
表2 不同容器培养的MDCK-XF03 悬浮细胞的比生长速率和倍增时间(±SD,n = 3)Tab. 2 Specific growth rates and doubling times of MDCK-XF03 suspension cells cultured in different containers(±SD,n=3)

表2 不同容器培养的MDCK-XF03 悬浮细胞的比生长速率和倍增时间(±SD,n = 3)Tab. 2 Specific growth rates and doubling times of MDCK-XF03 suspension cells cultured in different containers(±SD,n=3)
培养容器体积(L)比生长速率(μ / h)倍增时间(h)1. 20. 028 ± 0. 04020. 83 ± 1. 438 5 0. 030 ± 0. 00122. 35 ± 0. 061 750. 030 ± 0. 00121. 88 ± 0. 544
3 讨 论
MDCK 细胞作为生产流感疫苗的细胞基质已被广泛研究[3-4]。贴壁培养型MDCK 细胞受生产成本以及贴附面积等因素的限制[16],使得研究者们对该细胞的悬浮驯化做了大量工作。近年来,无血清悬浮培养基得到了很好的开发,MDCK 悬浮细胞也日渐增多。目前,已有采用MDCK 贴壁细胞生产流感疫苗的产品上市[17],而采用MDCK 悬浮细胞生产的人用疫苗在国内尚少见。
细胞的接种密度和传代时间会直接影响细胞的状态及其达到平台期的时间。WANG 等[15]认为,细胞状态是影响工业生产中病毒滴度的重要因素。因此,探讨该株驯化得到的MDCK 悬浮细胞的不同初始接种密度以及工业上的线性放大十分必要。本研究采用直接适应的方式驯化了1 株MDCK 悬浮细胞,较BISSINGER 等[18]的逐步适应无血清悬浮培养基的方式更为简便。将驯化后的MDCK-XF03 细胞接种不同型别的流感病毒,结果表明该细胞对流感病毒敏感,可进行进一步研究。再设置细胞不同初始接种密度组,接种至1. 2 L 四联平行生物反应器中,结合实验室工艺路线以及分析细胞的生长状态、生长特性、结团率、直径和葡萄糖消耗速率,选择合适的初始接种密度及传代时间。用于生产疫苗等生物制品的理想宿主细胞应具有高比生长速率、高活率、易扩大培养等特点,而本研究驯化的MDCK细胞在以不同初始接种密度培养时,低密度培养细胞更能充分利用培养基中的营养成分,实现快速增殖。以50 × 104个/ mL 的初始密度培养时,细胞具有最大的比生长速率以及最短的倍增时间;当以100 × 104个/ mL 的初始密度接种时,细胞在48 h具有最大比生长速率,略低于以50 × 104个/ mL 的密度接种组,但差异无统计学意义(P >0. 05),倍增时间差异也无统计学意义(P >0. 05);以200 ×104个/ mL 的密度接种,细胞基数更高,能快速进入对数生长期,但由于添加的新鲜培养基更少,虽然细胞在短时间内能达到较高密度,但倍增时间长,平均比生长速率低,在培养至48 h 时,培养基内还有较高的葡萄糖浓度,有利于细胞维持较高的比生长速率,倍增时间也在理想宿主细胞的选择范围内[19]。同时,随着培养时间的延长,MDCK 悬浮细胞的结团率逐渐增加,而细胞聚集体中间的细胞也逐渐汲取不到营养成分,这种聚集体还会增加剪切应力,从而影响细胞最大增殖浓度和倍增时间[20]。稳定的细胞大小表明细胞具有良好的状态。综合考虑以上因素,选择200×104个/mL 的初始接种密度对MDCKXF03 细胞进行培养研究。
在工业放大培养过程中,混合和传质是培养细胞的重要因素[14],同时,罐体越大造成的流体剪切力也会越大,影响细胞状态,尤其是悬浮细胞[21]。本研究驯化的MDCK 细胞从小试到放大至75 L 生物反应器,细胞不仅能实现高密度培养,在对数生长期也有较高的细胞活率,能实现高密度增殖。较陈军等[22]驯化的MDCK 细胞具有更高的比生长速率和生长密度。
综上所述,本研究通过逐步降血清和无血清悬浮驯化的方式获得1 株MDCK-XF03 悬浮细胞系,在1. 2 L 四联平行生物反应器中摸索出不同初始密度接种时细胞在不同阶段的密度及状态,并实现了5 L 到75 L 生物反应器的扩大培养,为生产流感疫苗的细胞基质的培养提供了参考,并为该细胞的工业化生产奠定了基础。

