超活化血小板裂解液对成骨细胞增殖的影响及凋亡修复作用
崔同,吴奇剑,刘春香,廉洪宇,赵雪,李子涛,张怡
1. 牡丹江医学院附属红旗医院,黑龙江牡丹江 157000;2. 杭州萧山傅氏骨伤科医院,浙江杭州 311254;3. 天晴干细胞股份有限公司,黑龙江哈尔滨 150028
血小板裂解液(platelet lysate,PL)是先通过超滤离心从全血中分离富血小板血浆(platelet-rich plasma,PRP),再用冻融的方式将血小板裂解而制备的液态衍生物[1],其去除了残余固态细胞成分,同时降低了免疫原性,保留了其中多种生长因子,如胰岛素样生长因子(insulin-like growth factor,IGF)、转化生长因子-β(transforming growth factor-β,TGF-β)、血管内皮生长因子(vascular endothelial growth factor,VEGF)、血小板衍生生长因子(platelet derived growth factor,PDGF)、表皮生长因子(epidermal growth factor,EGF)、骨形成蛋白2,4,6 及白细胞介素-1 等[2-3]。有研究显示,PL 能有效替代胎牛血清(fetal bovine serum,FBS),在体外扩增培养成纤维细胞、内皮细胞及间充质干细胞(mesenchymal stem cells,MSCs)[4-6]。
WILTFANG 等[7]在对严重骨缺损的愈合影响研究中发现,PRP 对于骨再生有显著影响。PL 作为PRP 的进一步裂解产物,也具有促进骨再生和修复的作用[8],除了用于MSCs 扩增培养之外,还具有促进组织修复、免疫调节等作用[9-10]。
超活化血小板裂解液(super-activated platelet lysate,sPL)是通过用CaCl2结合肝素激活PRP 中的血小板,冻融裂解血小板的同时用温度浮动控制方法去除纤维蛋白原获得的[11],制备过程中彻底去除了血小板膜、细胞碎片等溶液中的微小产物,比既往的PRP 及PL 中的血小板激活更彻底,保留了更高纯度生物活性因子,使其不仅富含营养因子和生长因子,能够改善局部微环境,刺激病灶区域功能性细胞的增殖潜能,还能激活损伤部位的干细胞,使其分化成损伤部位的成体细胞,促进骨骼及软骨再生与修复。
本实验旨在探讨不同浓度sPL 对成骨细胞增殖的影响及凋亡修复作用,以明确其能否有效应用于骨组织愈合。
1 材料与方法
1. 1 sPL 由天晴干细胞股份有限公司提供。
1. 2 细胞 SV40 转染人成骨细胞(hFOB. 1. 19)购自北京百欧博伟生物技术有限公司。
1. 3 主要试剂及仪器 Annexin V-PE / 7-AAD 凋亡检测试剂盒为美国Southern biotech 公司产品;人TNF-α 因子为德国miltenyi 公司产品;G418 购自北京索莱宝科技有限公司;FBS 为美国Gibco 公司产品;DMEM / F12 为美国Hyclone 公司产品;流式细胞仪(Epics XL)为美国Beckman Coulter 公司产品;倒置相差显微镜(Olympus IX53)和正置显微镜(Olympus CKX31)均为日本Olympus 公司产品;血细胞分析仪(KX-21)为日本SYSMEX 公司产品。
1. 4 不同浓度sPL 对hFOB. 1. 19 细胞增殖影响的检测 37 ℃复苏hFOB1. 19 细胞于含10% FBS 及0. 3 mg / mL G418 的DMEM / F12 培养基中,34 ℃,5% CO2及饱和湿度条件下培养,待细胞长至80% ~90%后,用含不同浓度sPL(0%、5%、10%、20%)的培养基将细胞接种至24 孔板培养,5 000 个/ 孔,每个浓度3 孔,连续7 d 计数,并绘制生长曲线,比较不同组别的细胞生长速度。
1. 5 不同浓度sPL 对hFOB.1.19 细胞凋亡影响的检测 用10% FBS + 90% DMEM / F12 + 0. 3 mg / mL G418 的培养基传代hFOB1. 19 细胞,待细胞长至80% ~90%后,接种6 孔板,1 × 105个/ 孔,用含30 μg / L TNF-α 的2. 5% FBS + 97. 5% DMEM / F12培养基进行凋亡建模,对照组加含2.5%FBS+97.5%DMEM/F12 的培养基培养,维持细胞基础代谢。12 h后,将对照组和造模组细胞分别使用7AAD 和Annexin V-PE 染色,流式细胞仪检测,确定建模是否成功。将建模成功的软骨细胞分成4 组,分别给予含0%、5%、10%、20% sPL 的培养基进行凋亡修复,每组设3个平行孔,36 h 后经流式细胞仪检测,分析不同浓度sPL 对hFOB. 1. 19 细胞凋亡的影响。
1. 6 统计学分析 应用SPSS 22. 0 软件进行统计学分析,应用GraphPad 绘图,组间比较采用t 检验,以P <0. 05 为差异有统计学意义。
2 结 果
2. 1 不同浓度sPL 对hFOB.1.19 细胞增殖的影响 5%和10% sPL 对hFOB. 1. 19 细胞具有较高的促增殖作用,5% sPL 的促细胞增殖效果高于10%;20% sPL未见显著促细胞增殖作用。见图1。0%、5%、10%、20% sPL 组细胞的倍增时间分别为(44. 7 ± 9. 1)、(24. 2 ± 3. 5)、(29. 7 ± 3. 2)和(39. 7 ± 7. 8)h,5%和10% sPL 组细胞倍增时间明显短于0%和20% sPL组(t0%vs5%= 3. 665,P0%vs5%= 0. 021;t0%vs10%= 2. 696,P0%vs10%= 0. 045;t5%vs20%=-3. 161,P5%vs20%= 0. 034;t10%vs20%= -2. 051,P10%vs20%= 0. 030),5%与10%组比较,差异无统计学意义(t = -0. 241,P = 0. 111)。
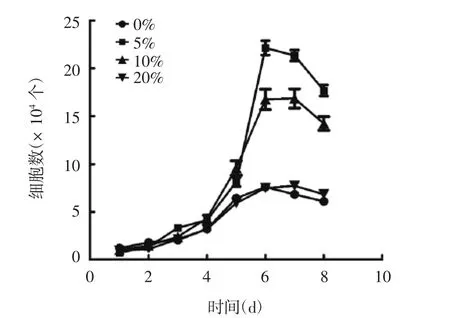
图1 不同浓度sPL 对hFOB. 1. 19 细胞增殖的影响Fig. 1 Effect of sPL at various concentrations on proliferation of hFOB. 1. 19 cells
2. 2 不同浓度sPL 对hFOB. 1. 19 细胞凋亡的影响流式细胞术分析显示,模型组细胞凋亡率(18. 0%)显著高于对照组(7. 1%),且差异有统计学意义(t =-11. 406,P = 0. 000 337),见图2。表明凋亡建模成功。成模细胞分别经0%、5%、10%、20%的sPL 修复后,细胞凋亡率分别为(19. 0 ± 2. 8)%、(10. 4 ±0. 7)%、(12. 6 ± 1. 3)%和(19. 5 ± 0. 7)%,与0% sPL组比较,5%和10% sPL 对凋亡细胞具有显著修复作用(t 分别为7. 552 和4. 671,P 分别为0. 001 647和0. 009 514);而20% sPL 未见显著凋亡修复作用(t = -1. 078,P = 0. 341 541)。见图3。
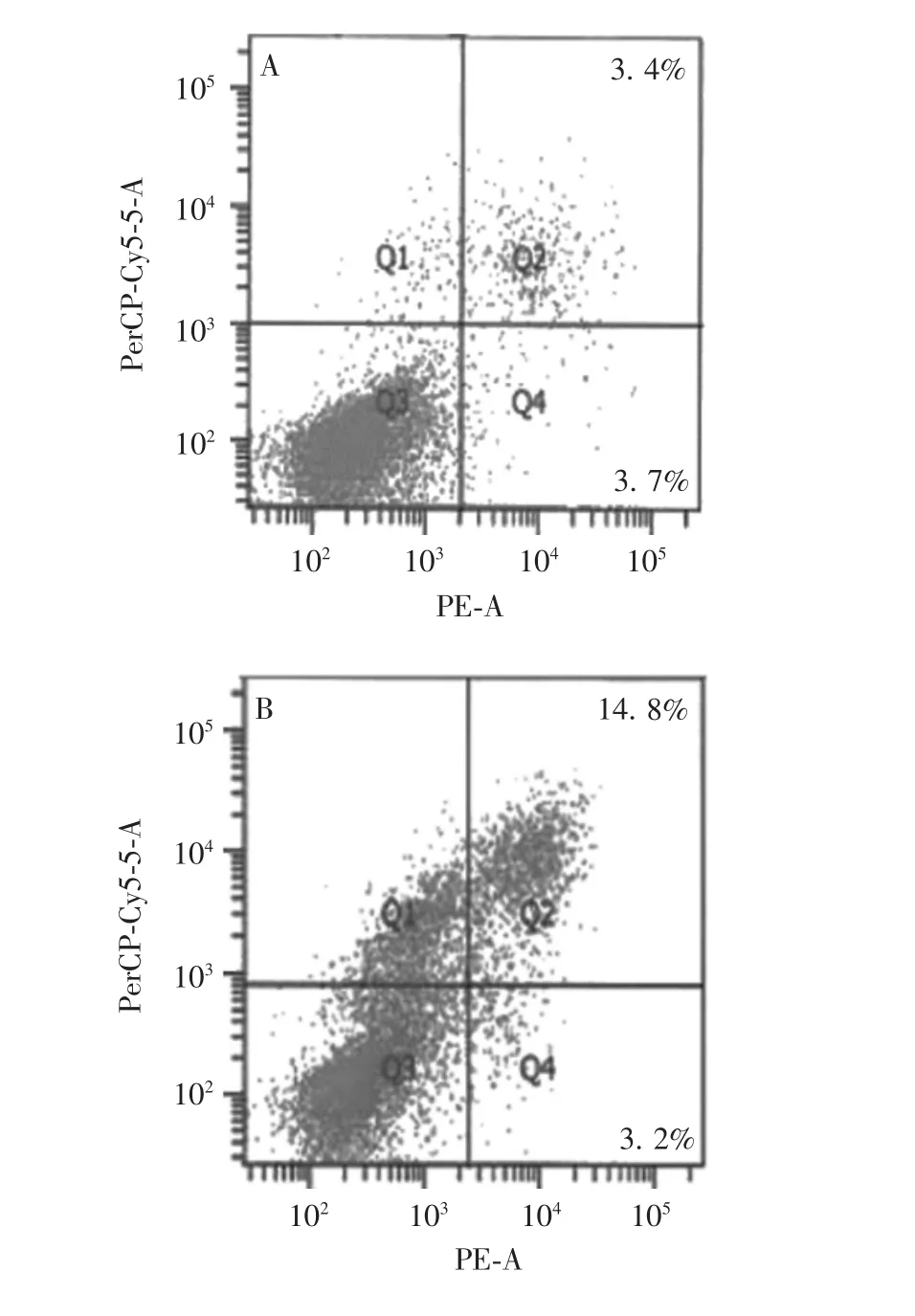
图2 流式细胞术分析对照组(A)和模型组(B)细胞的凋亡率Fig. 2 Flow cytometry of apoptosis rates of cells in control(A)and model(B)groups

图3 流式细胞术分析不同浓度sPL 组细胞的凋亡率Fig. 3 Flow cytometry of apoptosis rates of cells treated with sPL at varous concentrations
3 讨 论
以往的研究发现,血小板内含多种生物活性因子[12-13],可通过冻融方法使血小板裂解,以制备PL[1,14]。但刘春香等[11]研究发现,冻融方法制备的PL并未能使血小板充分裂解以将因子有效释放,因此,其通过物理化学结合方式制备出可高效释放因子的sPL,经对比发现,sPL 技术激活和诱导血小板释放后的TGF-β、PDGF、EGF、VEGF 等活性因子均高于传统PL 方法。同时,sPL 可置于-80 ℃冷冻保存,随时可取出融化过滤处理,解决了PRP 制备后需立即使用的时间限制问题,使采血、分离、制备及应用时间更灵活。
目前国内外研究主要是将PL 用于体外培养各种来源的MSCs[15-18]。此前在PL 对内皮细胞、单核细胞及成纤维细胞影响的研究中,BARSOTTI 等[19]发现,PL 可促进细胞活性,加速各种细胞类型的体外伤口愈合,其中5% PL 对伤口闭合的影响最大,而1%和20%浓度均导致延迟效应,说明其具有浓度依赖相关性。在骨组织工程中的大量实验数据显示,PL 在保持了骨髓基质干细胞生长能力和表型的同时,还能促进人骨髓基质干细胞增殖[20]。本实验结果显示,5% sPL 促成骨细胞增殖效应最明显;5%及10% sPL 对凋亡细胞具有显著修复作用,20% sPL未见显著的凋亡修复作用,说明在一定浓度下,sPL对成骨细胞凋亡具有修复作用,而高浓度的sPL 对成骨细胞无凋亡修复作用,该结果与BARSOTTI 等[19]的研究结果相对一致,5%的PL 及sPL 促细胞增殖及组织修复效果最佳,这可能与5%浓度大约对应于裂解前血小板悬浮液中的生理血小板浓度有一定的关系,该浓度下所含因子量可有效刺激细胞增殖及损伤修复,而低浓度下(1%以下)因子含量不足以实现修复作用,高浓度(20%以上)时,因子含量过饱,使其并未能达到理想效果,甚至抑制受体的激活作用,但具体机制仍需进一步研究。
本研究结果显示,sPL 具有促进成骨细胞增殖以及凋亡修复的效果,且浓度为5%时,效果更明显,表明sPL 有望成为机体损伤修复的有效手段。其通过释放高生物活性因子,刺激创面处内源性干细胞分化,并对受损组织细胞进行修复,使其能够高效增殖、抑制凋亡、增加胶原合成、激发血管再生,进而达到促进骨组织修复和再生的效果。本研究为动物体内研究及临床研究与应用奠定了基础,sPL修复的具体机制及体内应用的最佳浓度仍需进一步研究。

