黄柏碱对LPS诱导小胶质细胞活化的抑制作用及其机制研究*
许孟秋,陆韵薇,易慧敏,于顾然
(南京中医药大学附属医院,江苏 南京 210029)
神经退行性疾病(neurodegenerative disease,ND)[1]是由于老年后中枢神经慢性进行性变性而产生的疾病,包括多发性硬化、阿尔茨海默病、帕金森病、肌萎缩侧索硬化等。目前ND已成为威胁人类健康的第三位疾病,仅次于心血管疾病、癌症。研究[2-5]表明小胶质细胞的活化在上述疾病的发生、发展过程中扮演重要角色。
黄柏味苦性寒,能清热燥湿,泻火解毒,临床上用于治疗泻痢、黄疸、带下、淋证、骨蒸劳热等。现代研究[6-8]显示,黄柏有多途径抗炎作用。黄柏碱是《中华人民共和国药典》中规定的黄柏的活性成分、质检成分之一[9]。药物代谢动力学表明大鼠注射黄柏碱(2 mg/kg)后,在肾脏中浓度最高,并可穿过血脑屏障[10]。研究表明,黄柏碱能通过抑制肾小球中巨噬细胞和细胞毒性T淋巴细胞的增殖或迁移的能力来发挥抗肾炎的作用[8],还能通过阻滞自主神经节发挥降压作用[11]。黄柏碱具有抑制细胞免疫[12-13]、抗氧化[14-15]、神经保护等作用[14]。黄柏有效成分之一小檗碱已被证明能抑制TLR-4表达,从而抑制小胶质细胞活化发挥神经保护作用[16],并有研究显示黄柏碱的免疫抑制[13]、抗氧化、神经保护作用[14]强于小檗碱,但黄柏碱对小胶质细胞活化的影响及其机制还未有研究涉及。本实验通过LPS诱导小胶质细胞活化,建立神经炎症模型,采用黄柏碱进行干预观察其对小胶质细胞的作用并探讨其机制。
1 材料与方法
1.1 细胞 小胶质细胞BV2细胞株购自上海中乔新舟生物科技有限公司。
1.2 药物与试剂DMEM/F-12高糖培养液(美国Gibco公司,批号:8119395);胎牛血清(美国Gibco公司,批号:42A0378K);磷酸盐缓冲液(PBS)(美国Gibco公司,批号:8117157);四甲基偶氮唑蓝(MTT)(美国Sigma公司,批号:M2128);SDS-PAGE凝胶制备试剂盒(上海碧云天生物科技有限公司,批号:P0015L);NO试剂盒(上海碧云天生物科技有限公司,批号:011020200601);脂多糖(lipopolysaccharides,LPS)(Sigma公司,批号:L2880);诱导型一氧化氮合酶(iNOS)(美国Proteintech公司,批号:00080373);环氧化酶-2(COX-2)(美国Proteintech公司,批号:10003388);肿瘤坏死因子-α(TNF-α)(美国Proteintech公司,批号:00077108);Toll样受体-4(TLR-4)(美国Proteintech公司,批号:10003388);髓样分化因子(MYD-88)(美国Proteintech公司,批号:10006278);NF-κB p65抗体(美国Proteintech公司,批号:00084200);二抗兔(福麦斯生物技术有限公司,批号:2635054);二抗鼠(博士德公司,批号:BA1050);ECL化学发光剂(Biosharp公司,批号:DCM70080100);Resatorvid(美国MCE公司,货号:HY-11109);黄柏碱(成都曼思特生物科技有限公司,批号:MUST-20052104)。
1.3 主要仪器AC2-4S1型生物安全柜(新加坡ESCO公司);C150型CO2培养箱(德国BINDER公司);CKX4I型三目倒置显微镜(美国Bio-rad公司);ELX800型酶标仪(美国Bio-Tek公司);DW FL450型低温生物冰箱(中科美菱公司);04313849512免疫印迹电泳及转膜仪(美国Bio-rad公司);CHEMZDOCX RS+型IMage Lab凝胶成像系统(美国Bio-Tek公司);UCX-130型超声波细胞破碎仪(美国SONICS公司);MK10E型干式加热型恒温器(上海沪奥明公司);BX43型正置荧光显微镜(日本OLMPUS公司);Vortex-Genie 2型涡旋振荡器(北京Vortex-Genie公司);CFL-10002型恒温水浴锅(常州蒙特仪器公司);Gen Pure Pro型超净纯水仪(美国Thermo公司)。
1.4 实验方法
1.4.1 细胞培养BV2细胞用内含10%胎牛血清、1%链霉素、两性霉素及青霉素、90%DMEM/F-12高糖培养液置于37℃5%CO2培养箱中培养,待细胞长至铺满皿底90%时,用0.25%胰蛋白酶消化进行传代,并选取对数生长期细胞进行实验。
1.4.2 药品配制 在无菌生物安全箱中操作,粉末状20 mg的黄柏碱单体先用少量DMSO(保证使用浓度内96孔板中每孔DMSO质量分数<1‰)溶解,再加入含血清的DMEM/F-12溶液稀释成浓度为300 mmol/L黄柏碱单体溶液在-20℃冰柜中存储备用。
1.4.3 造模浓度选择及细胞分组 根据不同浓度脂多糖(LPS)在倒置相差显微镜下细胞形态变化及NO水平结果,以及查阅文献[17-18]选取1 μg/mL脂多糖(LPS)作为造模浓度。
实验分组:对照组、模型组(LPS 1 μg/mL)、抑制剂组(Resatorvid,TLR-4抑制剂终浓度为100 μmol/L+LPS 1 μg/mL)、黄柏碱低剂量组(黄柏碱终浓度100 μmol/L+LPS 1 μg/mL)、黄柏碱中剂量组(黄柏碱终浓度200 μmol/L+LPS 1 μg/mL)、黄柏碱高剂量组(黄柏碱终浓度300 μmol/L+LPS 1 μg/mL)。细胞按预设组铺板孵育细胞长至铺满皿底80%时,弃去各组原培养液,更换新鲜培养基,在黄柏碱低、中、高剂量组内加入不同剂量黄柏碱、抑制剂(Resatorvid)预保护细胞2 h,后于模型组,抑制剂组及黄柏碱低、中、高剂量组内分别加入1 μg/mL LPS损伤24 h,最后进行各项指标检测。
1.4.4 MTT法检测黄柏碱、LPS、黄柏碱+LPS、抑制剂+LPS对BV2细胞活性的影响 选取培养至对数生长期的BV2细胞,用胰酶消化,离心重悬计数,混匀后铺于96孔板中,每孔目标数取8×103个,每孔加入100 μL细胞混悬液,待细胞长至铺满皿底80%时进行实验,吸出原培养液,加入不同浓度黄柏碱(10、50、100、200、300、500 μmol/L)或LPS(0.05、0.10、0.20、0.50、1.00、2.00 μg/mL)或“1.4.3”各组别,在LPS损伤24 h后,每孔加入20 μL MTT(5 mg/mL)继续培养4 h,弃原培养液,加入150 μL DMSO,置振荡仪上避光震荡10 min,使用酶标仪测定OD490值,计算各组细胞存活率。细胞存活率(%)=处理组OD值/空白组OD值×100%。
1.4.5 倒置相差显微镜下观察各组BV2的形态变化 选取培养至对数生长期的BV2细胞,用胰酶消化,离心重悬计数,混匀后铺于96或12孔板后,按照不同分组加入不同质量浓度LPS(0.1、0.2、0.5、1.5 μg/mL)或“1.4.3”各组别,实验前后用倒置相差显微镜(×400)下观察各组小胶质细胞形态变化。
1.4.6 Griess法测定NO水平BV2细胞以1×105个/mL的密度接种于12孔板,1 mL/孔。待细胞贴壁后,设立对照组、不同质量浓度LPS(0.05、0.1、0.2、0.5、1.0、2.0 μg/mL)组或“1.4.3”各组别。LPS刺激BV2细胞24 h后收集细胞上清。按50 μL/孔的标准,在酶标板中加入各组细胞上清及标准品,再向各孔加入已静置到室温的50μL Griess ReagentⅠ和50μL Griess ReagentⅡ。振荡混匀后避光反应10 min,酶标仪测定吸光度OD540值。样品中NO含量根据测得的标准曲线确定。各组NO水平=处理组/空白组。
1.4.7 Western blotting法检测炎症及通路相关蛋白表达 将细胞接种于培养皿中,分组及药物处理同“1.4.3”,待LPS损伤24 h后取出培养皿置冰上,用4℃的PBS洗3次,每次均吸尽清洗液,后加入100 μL蛋白裂解液(蛋白酶抑制剂∶RIPA原液∶磷酸酶抑制剂∶PMSF=1∶1 000∶10∶10)充分裂解15 min,将裂解后的混悬液移至1.5 mL EP管内行超声裂解3次,15 s/次,将EP管置于预冷4℃的离心机12 000 r/min离心15 min,取上清液并加入5×SDS上样缓冲液,高温蛋白变性10 min,以BCA蛋白浓度测定法测蛋白浓度,进行蛋白电泳并转膜,将PDVF膜在室温下置于5%的脱脂奶粉中摇床封闭1 h,剪膜后将各条带置于一抗中4℃孵育过夜,TBST洗膜10 min×3次,室温下摇床孵育二抗1 h,TBST洗膜10 min×3次,采用ECL化学发光法曝光显影,使用Image Lab软件进行图像分析。
1.4.8 免疫荧光法检测黄柏碱对LPS诱导BV2细胞iNOS、NF-κB(p65)的表达及核定位情况 将圆形盖玻片用75%酒精浸泡过夜,紫外线消毒30 min,放入12孔板内。把BV2细胞悬浮液按10×104个/孔接种于12孔板内的盖玻片上,2 mL/孔,设置对照组,模型组,抑制剂组和黄柏碱低、中、高剂量组。细胞贴壁后弃上清,按照分组加入黄柏碱或抑制剂6 h,再加1 μg/mL LPS刺激12 h,用4%多聚甲醛固定30 min,加入1%Triton破膜30 min,每孔加入免疫荧光封闭液封闭1 h,一抗4℃过夜,室温复温1 h,二抗常温避光1 h,DAPI染色5 min,抗荧光猝灭剂封片,荧光显微镜下采集图片。使用Image J软件进行图像分析。
1.5 统计学方法 运用SPSS 26.0和GraphPad Prim软件对数据进行分析和作图,计量资料以“均数±标准差”(±s)表示,数据经检验均服从正态分布,方差齐,多组间比较采用单因素方差分析(One-Way ANOVA),以P<0.05为差异有统计学意义。上述实验均重复3遍以上。
2 结 果
2.1 MTT法检测黄柏碱、LPS、黄柏碱/抑制剂+LPS对BV2细胞活性的影响 各浓度黄柏碱组BV2细胞活性与对照组比较,差异均无统计学意义(P>0.05)。(见图1)各浓度LPS组BV2细胞活性与对照组比较,差异均无统计学意义(P>0.05)。(见图2)各浓度黄柏碱+LPS组BV2细胞活性与对照组比较,差异无统计学意义(P>0.05)。(见图3)表明选取的不同浓度黄柏碱、LPS对细胞活性均无损伤作用。
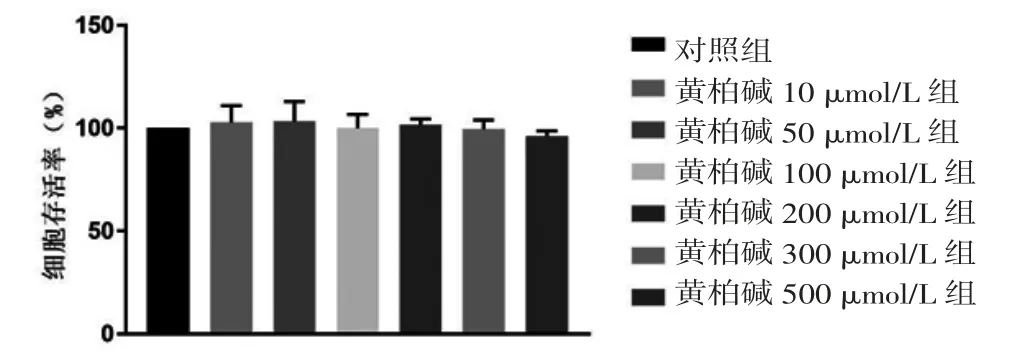
图1 不同浓度黄柏碱对BV2细胞活性的影响(±s,n=3)
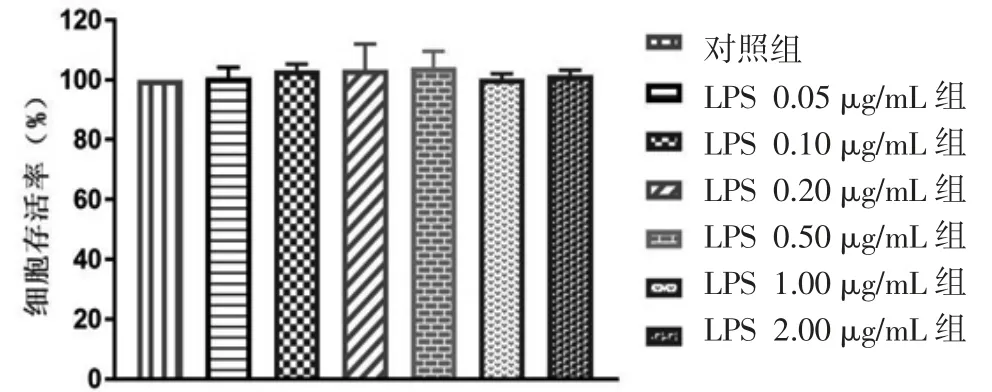
图2 不同浓度LPS对BV2细胞活性的影响(±s,n=3)
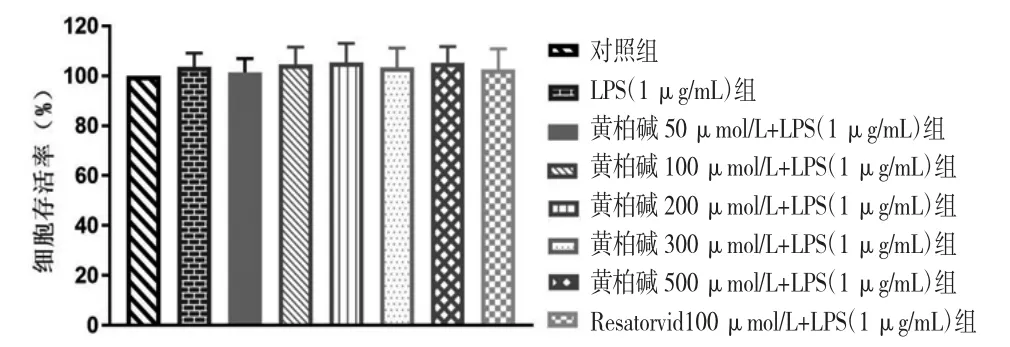
图3 不同浓度黄柏碱/抑制剂+LPS对BV2细胞活性的影响(s,n=3)
2.2 不同浓度LPS、黄柏碱/抑制剂+LPS对BV2细胞形态的影响
2.2.1 不同浓度LPS对BV2细胞形态的影响 对照组小胶质细胞呈静息状态,胞体细长,胞体两侧伸出细长突起的分支,呈“分枝状”;加入LPS刺激后,细胞大多数胞体变大、变圆,部分细胞表面突起变粗短,呈典型的“阿米巴状”,尤其以LPS 1 μg/mL组、LPS 2 μg/mL组激活最充分。

图4 不同浓度LPS对BV2细胞形态的影响(×400)
2.2.2 黄柏碱/抑制剂+LPS对BV2细胞形态的影响 对照组小胶质细胞呈未激活的“分枝状”;经LPS 1 μg/mL刺激后,模型组细胞呈“阿米巴状”;黄柏碱、抑制剂(resatorvid)预处理后细胞形态有改善,黄柏碱高剂量组、抑制剂组效果最好。(见图5)
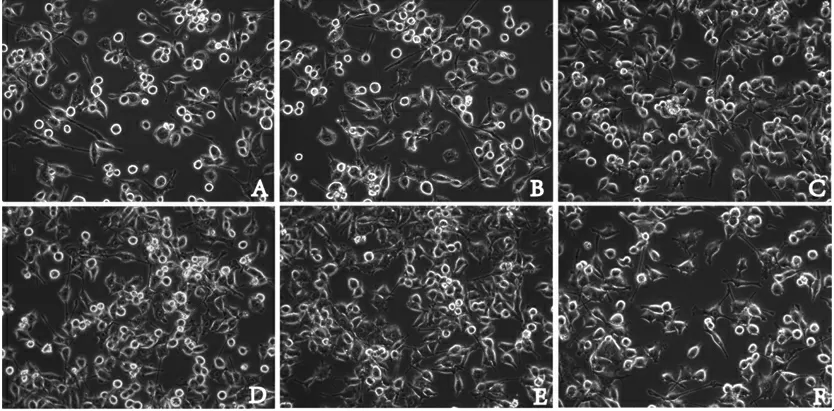
图5 黄柏碱/抑制剂+LPS对BV2细胞形态的影响(×400)
2.3 不同浓度LPS、黄柏碱/抑制剂+LPS对BV2细胞NO水平的影响
2.3.1 不同浓度LPS对BV2细胞NO水平的影响 不同浓度LPS干预后,除LPS 0.1 μg/mL组外,其余各组BV2细胞的NO表达量均明显高于对照组(P<0.01),LPS 1 μg/mL组BV2细胞的NO表达量与LPS 2 μg/mL组比较,差异无统计学意义(P>0.05)。(见图6)
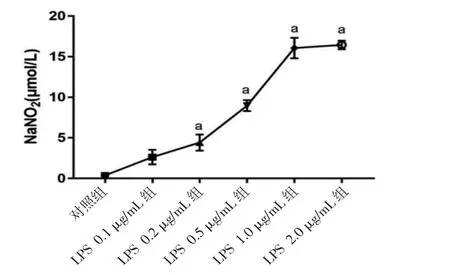
图6 不同浓度LPS对BV2细胞NO水平的影响s,n=3)
2.3.2 黄柏碱/抑制剂+LPS对BV2细胞NO水平的影响LPS干预后,模型组BV2细胞NO表达量明显高于对照组(P<0.01);黄柏碱预处理2 h后,各组BV2细胞NO表达量呈剂量依赖性降低,与模型组比较,差异有统计学意义(P<0.01),表明黄柏碱可抑制LPS诱导的BV2小胶质细胞NO的释放;黄柏碱低剂量组BV2表达量高于抑制剂组(P<0.01);黄柏碱中、高剂量组BV2细胞NO表达量与抑制剂组比较,差异无统计学意义(P>0.05)。(见图7)
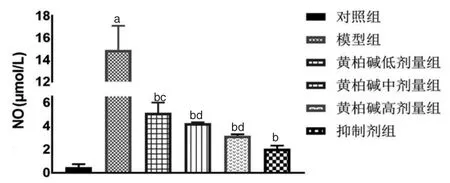
图7 黄柏碱/抑制剂对BV2细胞NO水平的影响(=3)
2.4 Western blotting法检测炎症及通路相关蛋白表达结果
2.4.1 Western blotting法检测各组BV2细胞炎症蛋白表达情况 模型组BV2细胞iNOS、COX-2、TNF-α表达明显高于对照组(P<0.01);黄柏碱干预后,表达量呈剂量依赖性降低,黄柏碱高剂量组BV2细胞iNOS、TNF-α,以及黄柏碱低、中、高剂量组BV2细胞COX-2明显均低于模型组(P<0.01);黄柏碱低、中、高剂量组BV2细胞iNOS、COX-2,以及黄柏碱高剂量组TNF-α与抑制剂组比较,差异均无统计学意义(P>0.05)。(见图8)
2.4.2 Western blotting法检测各组BV2细胞通路蛋白表达情况 模型组BV2细胞TLR-4、MYD-88、p65表达均明显高于对照组(P<0.01);黄柏碱干预后表达量呈剂量依赖性降低,黄柏碱中、高剂量组BV2细胞TLR-4、MYD-88、p65表达均明显低于模型组(P<0.01);黄柏碱中、高剂量组BV2细胞TLR-4、p65,以及黄柏碱高剂量组BV2细胞MYD-88表达与抑制剂组比较,差异均无统计学意义(P>0.05)。(见图8)
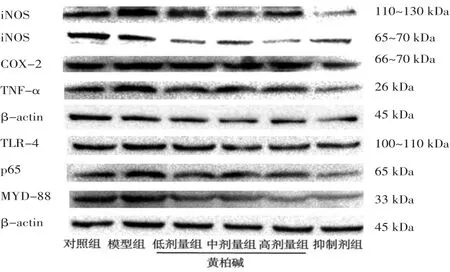
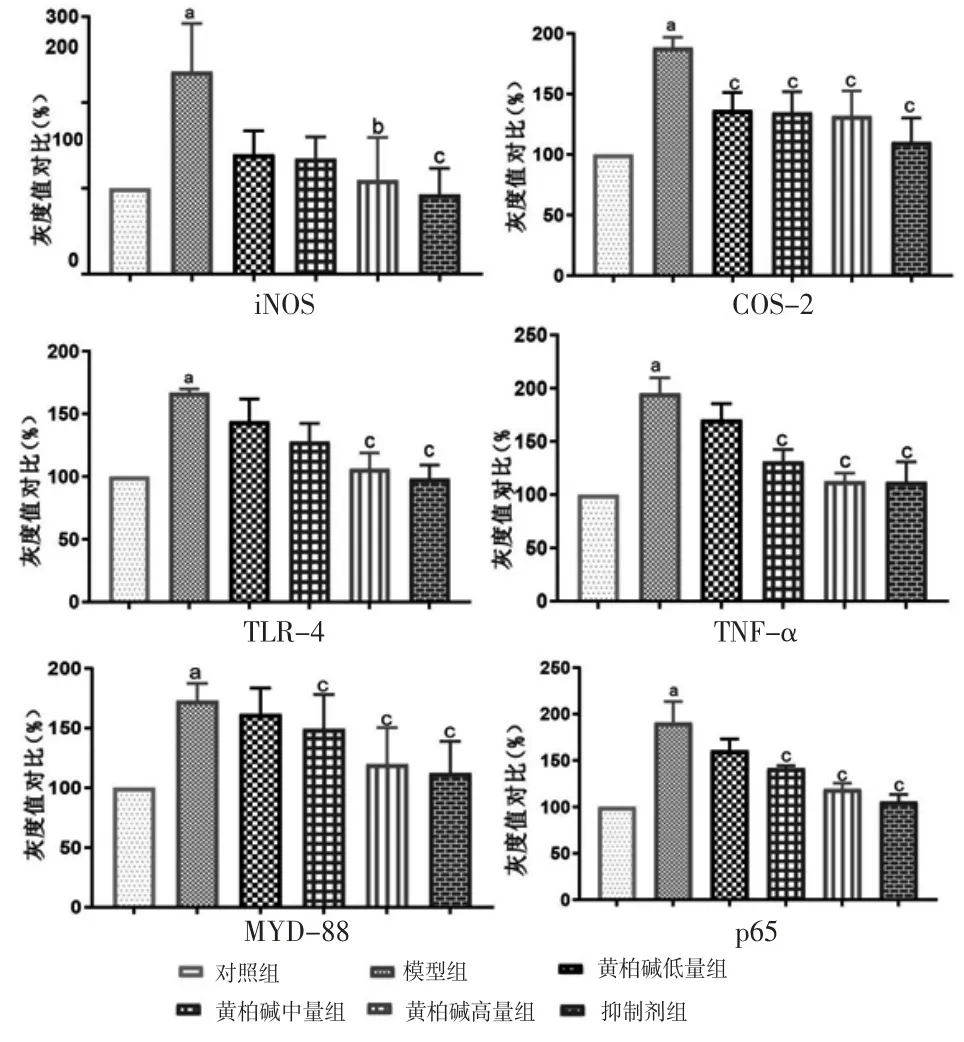
图8 Western blotting法检测各组BV2细胞炎症及通路相关蛋白表达情况s,n=3)
2.5 黄柏碱对LPS诱导BV2细胞iNOS、NF-κB(p65)的表达及核定位的影响
2.5.1 黄柏碱对LPS诱导BV2细胞iNOS表达的影响 对照组BV2细胞的iNOS为淡绿色,细胞核呈蓝色。LPS刺激后,模型组BV2细胞的颜色加深;黄柏碱、抑制剂(resatorvid)预处理后,颜色变浅。荧光定量结果表明,LPS处理后,模型组BV2细胞iNOS荧光表达明显高于对照组(P<0.01);黄柏碱干预后,BV2细胞iNOS荧光表达呈剂量依赖性降低,黄柏碱中、高剂量组BV2细胞iNOS荧光表达与模型组比较,差异有统计学意义(P<0.05);黄柏碱高剂量组BV2细胞iNOS荧光表达与抑制剂组比较,差异无统计学意义(P>0.05)。(见图9~10)

图9 各组iNOS荧光值比较s,n=3)
2.5.2 黄柏碱对LPS诱导BV2细胞活化NF-κB(p65)表达及核定位的影响 对照组BV2细胞的NF-κB(p65)聚集在胞浆中,淡红色,细胞核蓝色;LPS刺激后,模型组BV2细胞的NF-κB(p65)呈深红色,荧光定量明显高于对照组(P<0.01),且大量进入细胞核(P<0.01);黄柏碱干预后,BV2细胞NF-κB(p65)荧光表达、核浆比呈剂量依赖性降低,黄柏碱中、高剂量组NF-κB(p65)荧光表达、核浆比明显低于模型组(P<0.05);黄柏碱高剂量组BV2细胞NF-κB(p65)荧光表达、核浆比与抑制剂组比较,差异无统计学意义(P>0.05)。(见图11~12)
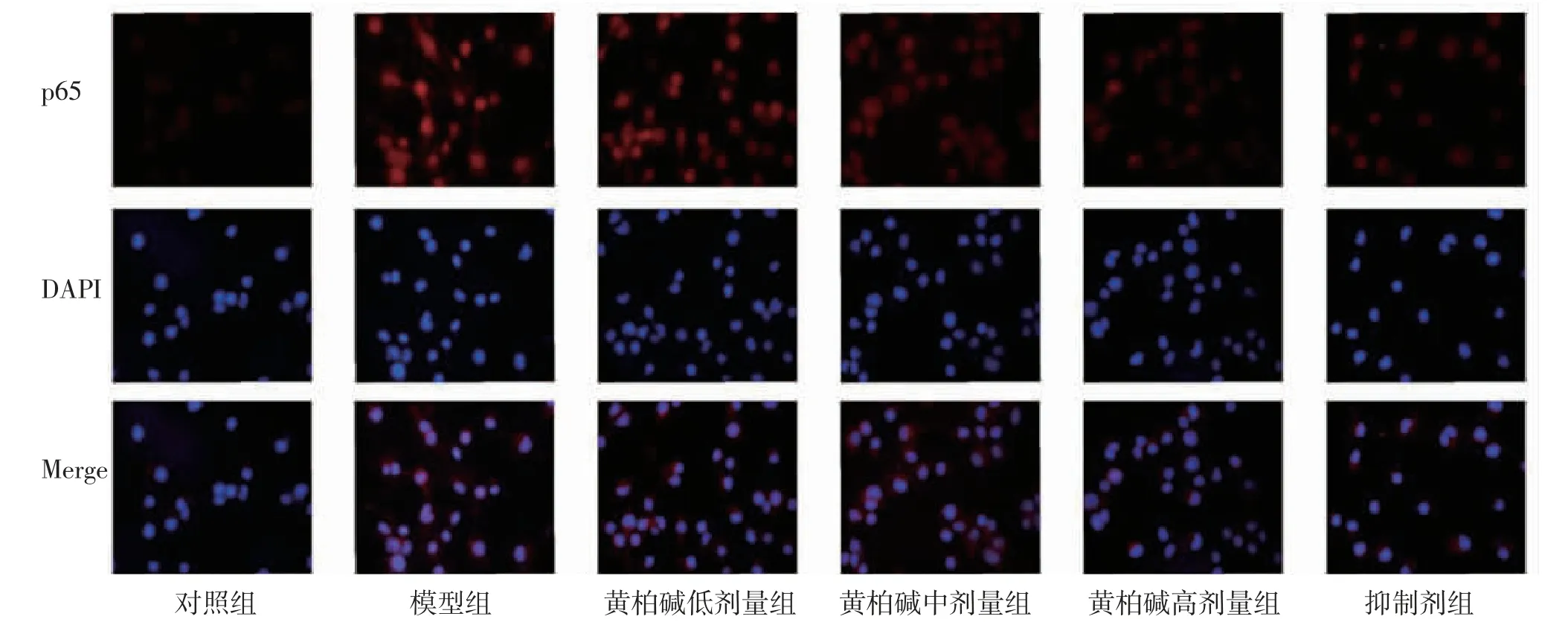
图11 免疫荧光法检测各组小胶质细胞NF-κB(p65)表达及核定位情况(×400)
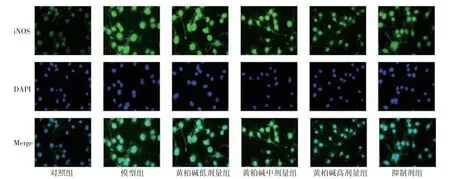
图10 免疫荧光法检测各组小胶质细胞iNOS表达(×400)
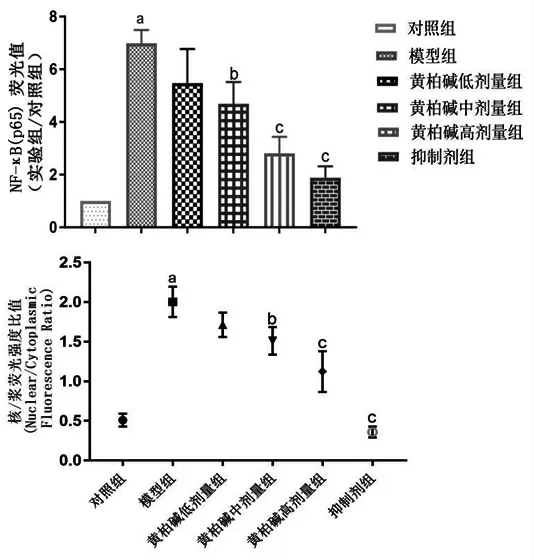
图12 各组小胶质细胞NF-κB(p65)表达及核浆比较s,n=3)
3 讨 论
小胶质细胞是一种中枢神经系统内的单核巨噬细胞,占脑细胞总数的10%~15%。其功能主要有免疫监视、吞噬病原体、分泌细胞因子、抗原提呈及修复组织等。静息时,胞体小,有伸向各个方向的突起,为“分枝状”的小胶质细胞;在受到脑内不同信号刺激后,其转变为激活型的小胶质细胞,胞体增大,突起变短、类似于“圆形”,此时的小胶质细胞不具有吞噬功能,其在一定条件下转化后,呈“阿米巴状”,拥有细胞吞噬功能,称之为活化型小胶质细胞。活化的小胶质细胞形态不同,作用不同,通过向不同的方向极化来完成生物学功能,主要极化为两种类型,即“经典活化”M1型和“替代活化”M2型。M1极化后介导的免疫炎症反应在多种神经系统疾病的病理过程中扮演重要角色。LPS或者IFN-γ,使小胶质细胞向M1型极化,表达促炎性细胞因子;IL-4/IL-13使小胶质细胞向M2型极化,抑制炎症和恢复体内平衡状态。有研究表明,中药可以通过多条通路来诱导向M2型极化[19]。
小胶质细胞与神经元之间关系微妙,可以保护神经元,亦能损伤神经元。在静息状态下,小胶质细胞可通过释放神经生长因子营养神经元和胶质细胞,通过吞饮来清除中枢神经发育过程中的凋亡细胞和代谢产物以维持组织稳定;同时作为免疫细胞,小胶质细胞是中枢神经系统宿主抵御病原体的第一道防线,将健康组织与受损区域隔开。但是小胶质细胞的慢性激活、过度激活会通过释放大量氧自由基及神经毒性因子,如一氧化氮(NO)、促炎细胞因子、活性氧中间体、趋化细胞因子等导致神经损伤[20]。其中,TNF-α能够与神经元上的TNF受体结合,激活半胱氨酸天冬氨酸蛋白酶(Caspase)依赖的级联反应,导致神经元凋亡,或促进谷氨酸释放,增加兴奋性毒性,此过程伴随Toll样受体(Toll-like receptor,TLR)、核苷酸结合寡聚化样受体(NLR)的激活,引起炎症信号级联反应,使诱导型一氧化氮合酶(iNOS)、环氧合酶-2(COX-2)等的表达增加,加重神经炎症。故小胶质细胞与神经元之间联系可能是通过TLR4/NF-κB通路实现的[21]。
体外实验中,不同状态的小胶质细胞由不同的潜在配体刺激得到。其中TLR激动剂,诸如LPS、IFN-γ可将小胶质细胞诱导活化,作为神经炎症反应模型,也称M1型。LPS为革兰阴性菌外壁的组成部分,通过TLR4将信号转导至细胞内,并通过两种途径,髓样分化初级应答(myeloid differentiation primary response gene 88,MyD88)依赖性和MyD88非依赖性,激活NF-κB。TLR4是Toll样受体家族(toll-like receptors,TLRs)的一员,Toll受体是Ⅰ型跨膜蛋白,它们可活化胞内信号分子,进而活化NF-κB,导致细胞黏附分子、IL-1、IL-6、IL-8、TNF-α和NO合成酶等基因的表达。
本研究中NO测定、Western blotting、免疫荧光实验结果表明,黄柏碱可抑制由LPS诱导的BV2细胞活化,抑制NO的释放,抑制iNOS、COX-2、TNF-α的表达,其作用可能是通过抑制TLR-4/MYD-88/NF-κB(p65)通路实现的,进而抑制炎症因子分泌。这为临床上应用黄柏治疗中枢神经系统退行性疾病提供了实验依据。

