温郁金法呢基焦磷酸合酶(CwFPPS)基因的克隆、亚细胞定位及表达分析
丁贤华,张丽萍,费 璇,朱 强,张金华,任仙樱,吴志刚*,姜程曦*
• 药材与资源•
温郁金法呢基焦磷酸合酶(CwFPPS)基因的克隆、亚细胞定位及表达分析
丁贤华1, 2,张丽萍1#,费 璇1,朱 强3,张金华4,任仙樱5,吴志刚1*,姜程曦1*
1.温州医科大学药学院,浙江 温州 325035 2.安徽江南生物技术研究中心,安徽 池州 247100 3.安徽济人药业有限公司,安徽 亳州 236800 4.大理药业股份有限公司,云南 大理 671000 5.温州莪金医药有限公司,浙江 乐清 325600
克隆温郁金萜类生物合成中的限速酶法呢基焦磷酸合酶(farnesyl pyrophosphate synthase,FPPS)的全长cDNA序列。根据温郁金转录组数据设计特异引物,PCR扩增FPPS全长cDNA序列并对其进行生物信息分析;构建“基因-GFP”融合表达载体,利用农杆菌介导烟草叶片进行亚细胞定位分析;实时荧光定量PCR(qRT-PCR)检测基因在植物组织中的特异性表达。温郁金基因全长1196 bp,包含1个长为1071 bp的开放阅读框,编码356个氨基酸,GenBank登入号为MT489462;编码蛋白属于类异戊二烯生物合成酶超级家族(C1)成员,包含5个保守的功能域,其中2个是富含天冬氨酸(DDXXD)的活性中心;亚细胞定位显示该蛋白位于泡质、细胞膜或细胞核上。qRT-PCR分析表明,基因在根茎中特异表达,相对表达水平是叶片中的13.7倍。克隆获得的温郁金基因全长及其特异表达信息,可为后续进行基因功能鉴定及倍半萜成分的代谢工程研究提供依据。
温郁金;法呢基焦磷酸合酶;克隆;亚细胞定位;表达分析
温郁金Y.H.Chen et C.Ling 为姜科姜黄属多年生草本植物,是我国传统道地药材,其根茎、块根采用不同炮制方法可制成临床上常用的“温莪术”“片姜黄”和“温郁金”3味中药,具行气化瘀、清心解郁、利胆退黄等功效[1]。研究表明,温郁金主要成分为倍半萜,其中蓬莪术二烯、莪术醇、郁金二醇、莪术烯、δ-榄香烯、β-榄香烯等活性成分具有抗肿瘤、抗病毒、抗炎、镇痛等药理作用,开发应用前景广阔,如β-榄香烯已被开发成年产值达40亿元的抗肿瘤产品[2-3]。然而,植物体内重要活性成分含量十分有限,且温郁金受连作障碍、种质退化、成分稳定性低、生产成本高等因素限制,依靠传统“种植-提取”药源的方法面临挑战,愈发难以满足生产需求。
随着合成生物学的发展,以大肠杆菌、酵母工程菌或模式植物为底盘的代谢工程技术已成为近年来发掘开发新药源的热点领域。此过程中,克隆及表达合成途径的限速酶是最为关键的。C15型的法呢基二磷酸(farnesyl diphosphate,FPP)是合成倍半萜的前体物质,是由2分子异戊烯基焦磷酸(isopentenyl pyrophosphate,IPP)和1分子二甲基烯丙基焦磷酸(dimethylallyl pyrophosphate,DMAPP)在法呢基二磷酸合成酶(farnesyl pyrophosphate synthase,FPPS)催化下缩合而成[4]。当前,小麦、白木香、黄花蒿等多个植物基因被克隆[5-8],甚至被应用代谢产物调控工程设计中,而温郁金基因尚未见相关报道。
项目组前期在构建温郁金花、叶、根茎及块根全长转录组中发现,1条长为1343 bp的转录本(i1_HQ_W_c88364/f29p10/1344)在温郁金根茎中特异表达。鉴于此,本研究依据此转录本序列设计特异引物,实时荧光定量PCR(qRT-PCR)从温郁金根茎中克隆基因cDNA全长序列并进行生物信息学分析,利用烟草叶片瞬时转化体系验证亚细胞定位,qRT-PCR检测基因各组织表达模式,为今后温郁金重要活性成分的生物合成调控途径及代谢工程研究提供依据。
1 材料与试剂
1.1 药材样品
样品采自温州瑞安陶山镇种植基地(E120°51′,N27°83′),由温州医科大学吴志刚副研究员鉴定为温郁金Y.H.Chen & C.Ling。根据温郁金发育规律[9],花、叶、根茎等组织分别于花期、叶丛期、根茎始发期和块根形成期进行收集,每个部位收集3份。材料经洗净、切碎,液氮下研成粉末并于−80 ℃保存备用。本氏烟草Domin种子(本实验室保存)播种于直径7 cm的营养钵中(腐殖质∶蛭石1∶1),25 ℃下每日12 h的光照培养30 d,用于亚细胞定位分析。
1.2 菌株与载体
TOP10菌株为本实验室保存,根癌农杆菌GV3101购自上海唯地生物技术有限公司,pCAMBIA 1302表达载体购自南京钟鼎生物技术有限公司。
1.3 工具酶与主要试剂
pfu DNA聚合酶、Taq酶,T4 DNA连接酶及限制性内切酶、SYBRR Premix Ex TaqTM荧光定量PCR试剂盒及RNA纯化试剂盒均购自TaKaRa Bio公司(大连),CV1401-Zero Background pTOPO-TA cloning kit购自北京艾德莱生物有限公司,cDNA反转录试剂盒购自美国Applied Biosystems™公司,DNA回收纯化试剂盒、质粒小提试剂盒购自美国AXYGEN公司。PCR Buffer缓冲液、ddH2O、琼脂糖等均购自生工生物工程(上海)股份有限公司。引物合成及测序由南京钟鼎生物技术有限公司完成。
2 方法
2.1 RNA提取与纯化
参照CTAB法[10]提取样品总RNA并按RNA纯化试剂盒说明纯化,1%的琼脂糖电泳检测RNA完整性、浓度和纯度。依据反转录试剂盒的说明反转录成cDNA。
2.2 CwFPPS基因克隆与测序
利用Primer Premier 5.0软件设计基因全长扩增引物(FPPS-F: 5’-GTGCCATTCTTCGAGTGT-3’,FPPS-R: 5’-TATTAGAAAATTGATCGTAAG-3’)。以温郁金根茎cDNA为模板,配制反应体系:5 μL 10×PCR Buffer(含Mg2+),5 μL dNTP,1 μL酶,1 μL模板,各1 μL的上下游引物(10 μmol/L),36 μL ddH2O。于96孔梯度PCR仪上进行扩增,反应程序:94 ℃预变性5 min,1个循环;然后94 ℃、30 s,56 ℃、30 s,72 ℃、1.5 min,进行35个循环;循环结束后72 ℃延伸反应7 min。1%的琼脂糖凝胶电泳检测PCR产物,PCR产物切胶纯化回收,连接TOPO-TA克隆载体,转化大肠杆菌TOP10菌株,挑取阳性菌株提取质粒并进行测序。
2.3 CwFPPS基因的生物信息分析
ORF finder在线软件编译基因开放阅读框(open reading frame,ORF)及翻译蛋白,NCBI在线CDD Tools(https://www.ncbi.nlm.nih.gov/ Structure/cdd/wrpsb.cgi)搜索蛋白保守结构域,在线BlastP程序(https://blast.ncbi.nlm.nih.gov/ Blast.cgi)搜索并下载相似性氨基酸序列(identity>75%)ClustalX2.0进行氨基酸多序列比对,并利用MEGA7.0软件中的极大似然法进行系统进化树分析,Bootstrap值设为1000。ExPASy在线服务器ProtParam工具分析蛋白等电点、氨基酸分布、亲水性等情况;SignalP-5.0 Server和TMHMM Server v.2.0在线预测蛋白信号肽及跨膜结构;WoLF PSORT(https://wolfpsort.hgc.jp/)预测亚细胞定位情况。SOPMA分析蛋白二级结构,采用SWISS-MODEL在线工具进行三维同源建模。
2.4 CwFPPS蛋白亚细胞定位
根据基因开放阅读框(ORF)序列,在Ⅰ和Ⅰ酶切位点间设计全长拼接引物(F:5’- AGAACACGGGGGACTCTTGACATG-GCGGAGGCGACGGCGAACG-3’;R:5’-GTGAA- AAGTTCTTCTCCTTTCTTCTGCCTTTT-GTAGATCTT-3’;划线部分为酶切位点),通过同源重组方法连接至pCAMBIA 1302载体的I和I位点间,获得pCAMBIA 1302-CwFPPS重组质粒并转至TOP10克隆菌株,阳性克隆子测序验证。连接反应体系:引物各0.5 μL,模板0.3 μL,5×Buffer溶液10 μL,pfu DNA聚合酶0.5 μL,dNTP(10 μmol/L)1 μL,ddH2O加至50 μL。上述测序正确的质粒进行酶切鉴定,反应体系为:质粒3 μL,内切酶Ⅰ、Ⅰ各0.25 μL,10×Buffer 1.0 μL,ddH2O 5.5 μL。
将上述鉴定正确的重组质粒电转化法转入根癌农杆菌GV3101中,固体培养2 d后,YEB液体扩大培养1 h,离心弃清液;沉淀菌体用10 μmol/L MgCl2(含120 μmol/L乙酰丁香酮)进行悬浮重悬,稀释液600 nm吸光度()为0.6左右。以空载为对照,取生长良好的烟草植株,从叶片下表皮进行注射,弱光培养2 d,激光共聚焦显微镜(Nikon C2-ER)下观察绿色荧光蛋白和融合蛋白表达情况。
2.5 qRT-PCR分析
使用荧光定量PCR仪(ABI7500,USA)分析CwFPPS基因在温郁金不同组织中的表达模式。依据序列设计qRT-PCR特异引物(F:5’-TGGA- TTGCTTCGGTCATC-3’;R:5’-ATCTTCAGTTGG- CTCTCATT-3’),产物200 bp,以18 S为内参基因(F:5’-GTAGTTGGGCTTTGGGTTG-3’;R:5’-AG- GTAGGCTTGCTTTGAG-3’)为内参基因。配制反应体系如下:SYBR Green Master Mix(Applied Biosystems,美国)10 μL,正反引物各0.5 μL(10 μmol/L),cDNA模板2 μL,ddH2O 8 μL,并以2 μL的ddH2O代替模板作为阴性对照。反应程序:95 ℃、30 s,1个循环;95 ℃、10 s,60 ℃、15 s,72 ℃、30 s,进行40个循环。每样品3次技术性和生物学重复,采用2−ΔΔCt法[11]统计基因相对表达水平。
3 结果与分析
3.1 CwFPPS基因克隆与序列全长
根据温郁金转录组中1条在根茎中特异表达的FPPS转录本设计特异引物,以根茎cDNA为模板,RT-PCR扩增并经琼脂糖凝胶电泳检测,发现在1200 bp处出现的特异条带(图1),与预期的片段大小基本一致。PCR产物连接T载体,克隆测序发现温郁金FPPS基因全长为1196 bp。ORF Finder预测该基因序列含有1个完整的ORF,长为1071 bp,编码356个氨基酸残基,ORF与原转录本一致。BlastP比对显示该基因序列与其它物种的法呢基焦磷酸合酶高度相似,命名为,序列提交至GeneBank(登入号MT489462)。
3.2 CwFPPS序列生物信息分析
3.2.1 序列分析 Conserved domain预测发现,基因编码蛋白属于类异戊二烯生物合成酶超级家族(C1)成员,是植物催化形成FPP的关键酶。结构域分析表明,编码氨基酸序列具有2个天冬氨酸富集的保守结构域Motitf2和Motif5,富含DDXXD(图2),是结合Mg2+、保证酶活性的重要功能域[11]。除Motif2、Motif5以外,CwFPPS蛋白还含有与底物结合的G60K61L62N63R64(Motfi1)、G174Q175X176X177D178(Motif3)保守区,以及促进酶活性K204T205(Motfi4)位点(图2)。此外,ProParam Tool在线分析显示,CwFPPS蛋白相对分子质量为40 630,推测分子式为C1850H2876N472O532S12,理论等电点(pI)5.93;氨基酸组成以亮氨酸比例最高,达到12.4%;不稳定系数为28.14,脂肪系数为96.69,亲水性系数为−0.205,暗示该蛋白为稳定的亲水性蛋白。TMHMM预测CwFPPS蛋白不含跨膜区,SignalP 5.0进一步预测表明此蛋白不具备信号肽位点。
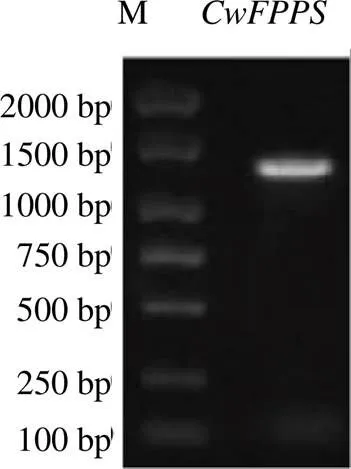
图1 CwFPPS基因的PCR产物凝胶电泳
3.2.2 序列相似性比对和进化分析 BlastP显示CwFPPS蛋白与多个单子叶植物FPPS序列具有高度的相似性,其中与同科植物红姜花Buch.-Ham.的FPPS氨基酸序列(AER12202.1)一致性(identity)达93.5%。选取19条一致性较高(>75%)的氨基酸序列进行多重比对发现,这些序列均存在上述5个保守结构功能域,暗示该基因功能性的保守。利用MEGA7.0软件中的最大似然方法构建系统进化树,见图3。结果表明,温郁金与姜科的红姜花、芭蕉科的小果野蕉Colla植物亲缘关系最近,聚为一类,而与铁皮石斛Kimura & Migo、霍山石斛C.Z.Tang & S.J.Cheng、春兰(Rchb.f.) Rchb.F.、蝴蝶兰(Rchb.f.) Kocyan & Schuit等兰科植物距离较远。
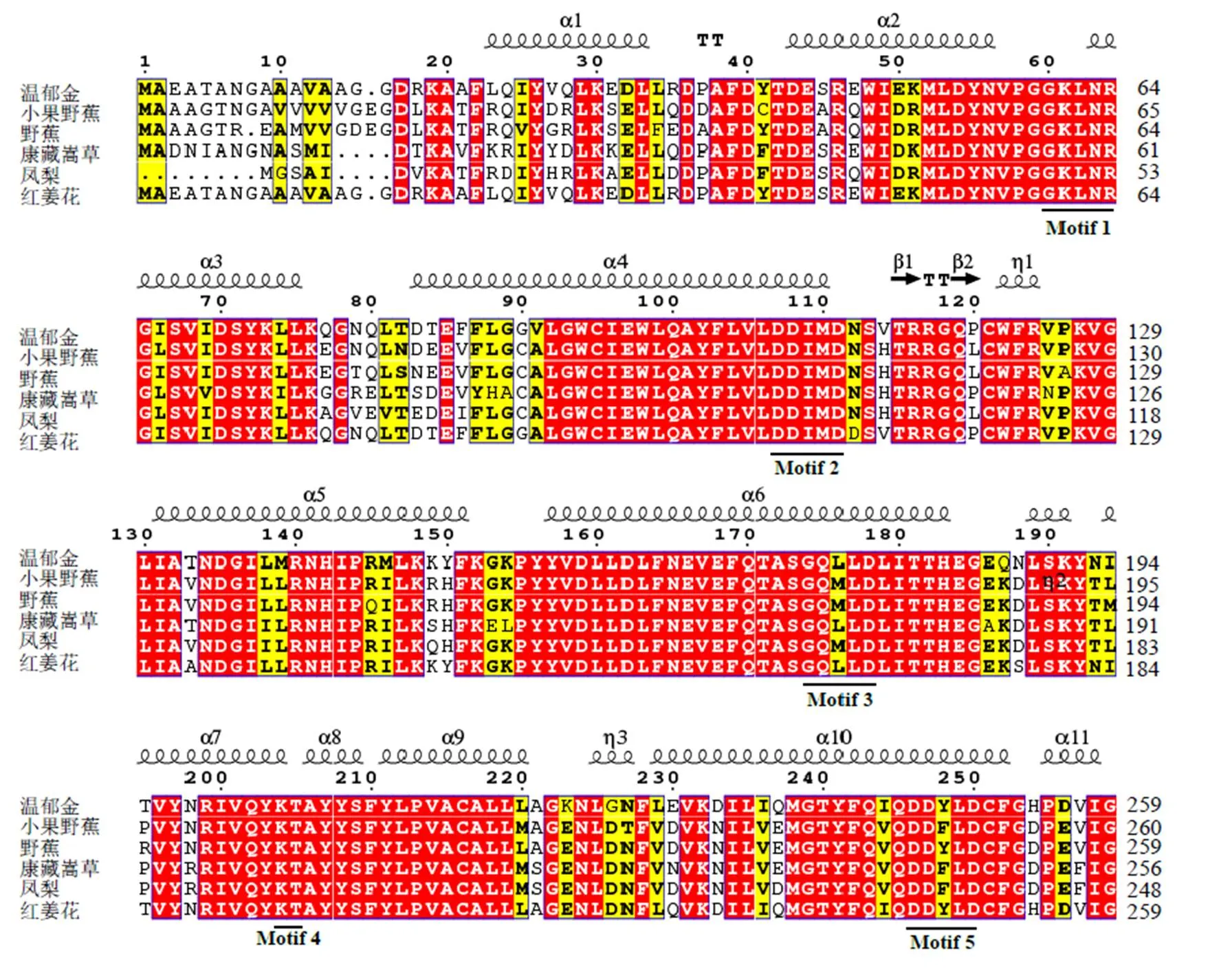
图2 CwFPPS蛋白与其他植物FPPS保守区序列的多重比对
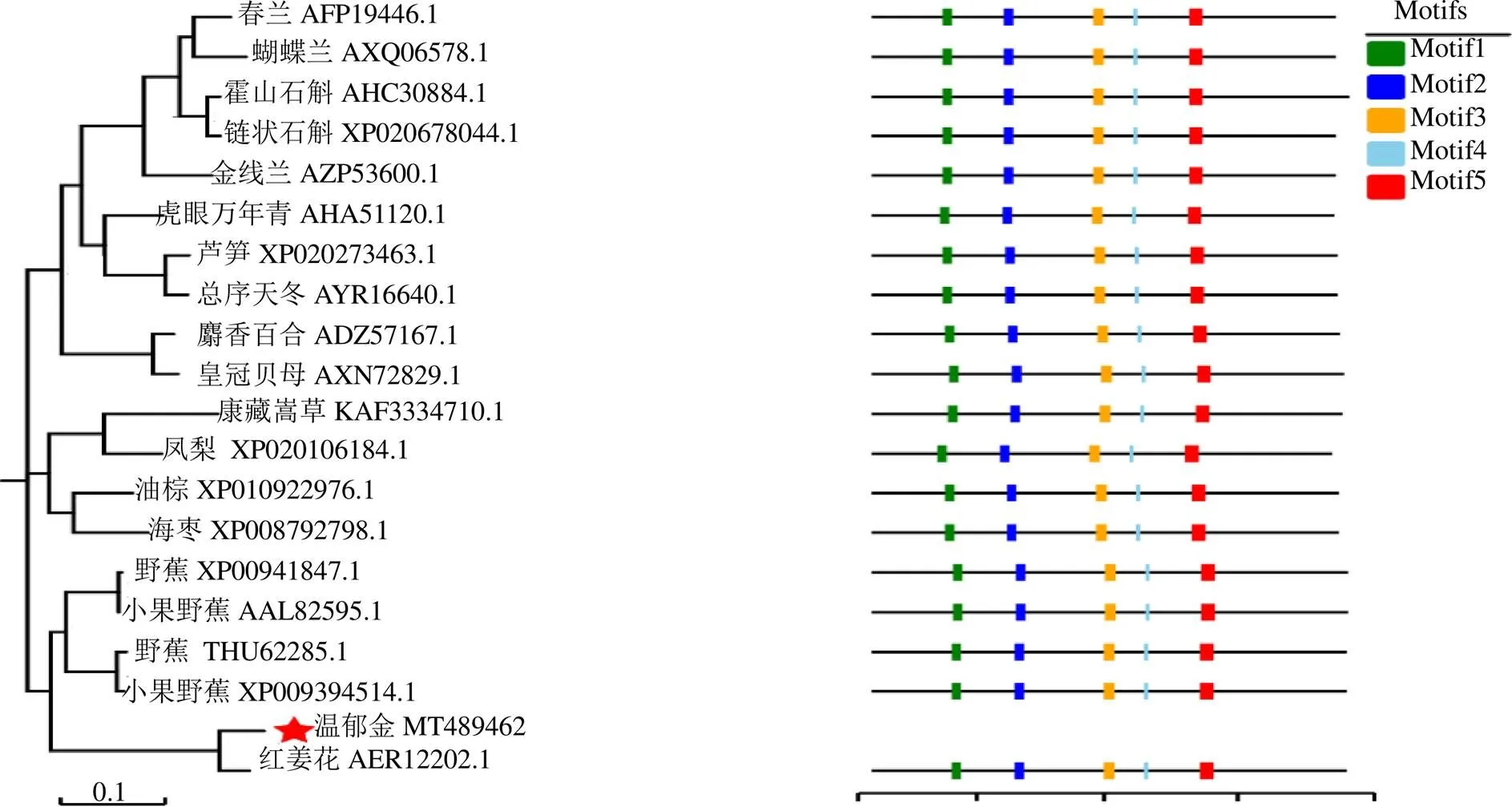
图3 CwFPPS蛋白与同源氨基酸序列的进化树分析及保守结构域
3.2.3 蛋白二级结构及同源建模 二级结构预测显示CwFPPS蛋白是由62.9%的α螺旋(整条序列含有16个α螺旋区),7.3%的延伸链,4.5%的β折叠和25.3%的无规则卷曲构成。SWISS-MODEL建模显示,CwFPPS蛋白与PDB数据库中的法尼基二磷酸合成酶1嵌合体(模板号:4kk2.1.A)序列一致性达到70.96%,序列的相似度为0.52,覆盖度为0.94;依据该模板建模显示CwFPPS蛋白是由α螺旋形成的同源双聚体寡核苷酸构成,空间结构含有与底物结合的“口袋”(图4)。
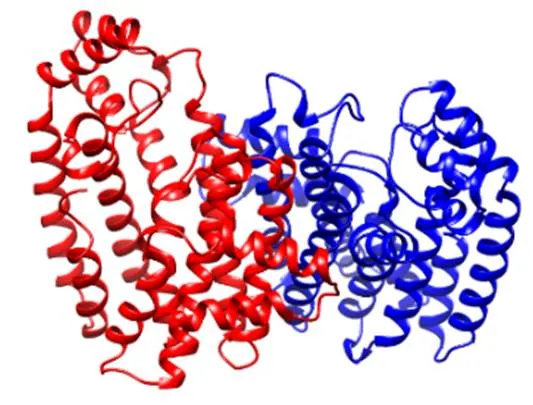
图4 CwFPPS蛋白三级结构预测
3.3 CwFPPS亚细胞定位
利用WoLFPSORT工具预测CwFPPS亚细胞定位,此蛋白最大可能是定位于细胞质中。为验证该蛋白亚细胞定位,构建pCambia 1302-CwFPPS载体,并通过根癌农杆菌介导的烟草叶片的瞬时转化体系,激光共聚焦显微镜下观察发现CwFPPS::GFP融合蛋白在细胞质与细胞膜上具有明显信号(图5)。
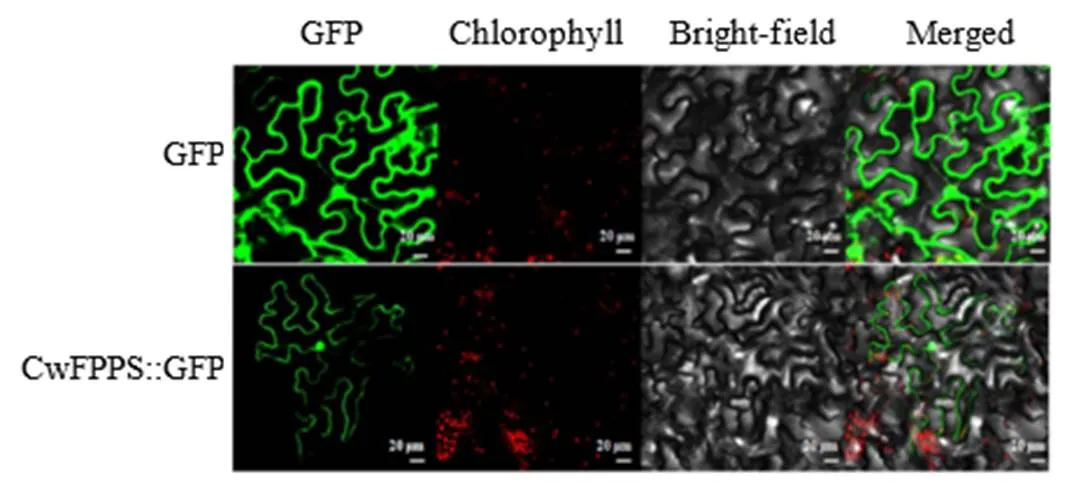
GFP-绿色荧光信号 Chlorophyll-叶绿素荧光 Bright-field-明场 Merged-绿色和红色荧光信号叠加
3.4 CwFPPS组织特异表达分析
为明确基因在温郁金不同组织表达情况,qRT-PCR检测显示该基因在温郁金药用部位根茎、块根中具有较高表达,反之在花、叶中表达较低(图6),这可能与药用部位积累更高的萜类成分有关。其中,根茎相对表达量是叶中的13.7倍。
4 讨论
本研究从温郁金根茎中成功克隆获得类异戊二烯生物合成酶超级家族(C1)成员之一的基因,该基因编码356个氨基酸,含有2个聚戊烯基合酶家族特有并高度保守的DDXXD的结构域(Motif2、Motif5)。此2个功能区被认为是FPPS酶与底物结合的重要位点,其富含天冬氨酸的残基决定产物链长度和FPPS酶的活性,天冬氨酸突变或替代物能著降低FPPS酶活性[12-13]。多序列比对发现(图2),CwFPPS蛋白与其他植物FPPS氨基酸序列一样均具有上述2个功能域,暗示这些氨基酸残基在发挥酶与底物结合、催化中功能性保守。类似其它植物,CwFPPS蛋白也包含Motif1(GKXXR)、Motif3(GQXXD)、Motif4(KT)等保守区,这种序列保守性也可用来研究植物间的进化关系[14]。CwFPPS氨基酸序列与兰科、百合科、凤梨科、姜科、芭蕉科等单子叶植物的FPPS序列具有70%以上的一致性,系统进化进一步表明温郁金与同科植物红姜花、芭蕉科的小果野蕉聚为一类(图3),说明它们间亲缘关系较近,预示CwFPPS对于研究温郁金系统进化地位具有一定应用价值。
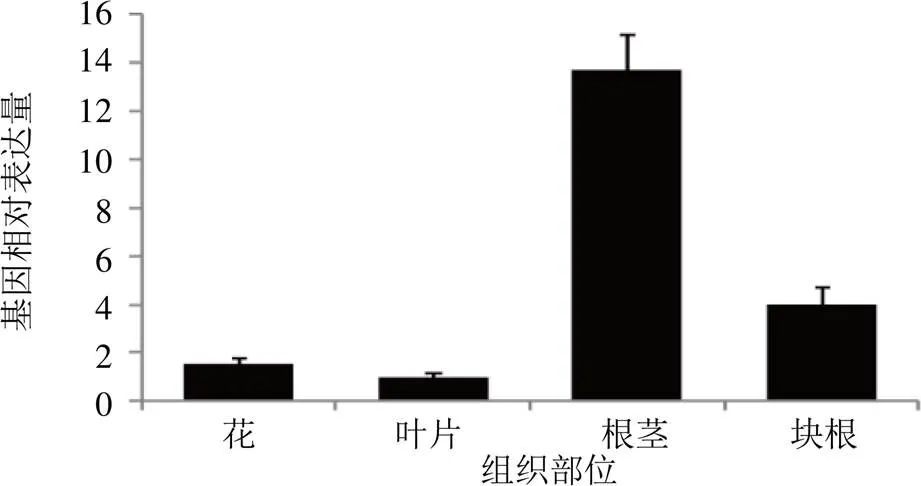
图6 CwFPPS基因组织特异性表达
由于亚细胞区室化作用,植物体内倍半萜一般是在细胞质中通过甲羟戊酸(mevalonate pathway,MVA)途径合成[15]。CwFPPS蛋白没有跨膜螺旋区且不存在信号肽,推测此蛋白在细胞质起始合成并直接在细胞质中酶促反应。通过在CwFPPS蛋白C端融合GFP,融合蛋白在烟草表皮细胞的细胞质和细胞核上具有明显GFP信号,与预测和其它植物FPPS亚细胞定位研究结果基本一致[16-17]。因而,初步认定CwFPPS定位于细胞质和细胞核上。
植物萜类合成常发生于特殊的组织或特殊发育阶段,合成途径中关键基因的表达具有组织特异性或显示时空特异性[18]。研究发现,参与建泽泻23-乙酰泽泻醇B合成的基因在叶片中表达最高,且与成分变化成正相关,白木香在根中表达量最高,广藿香基因成熟期叶片中表达最高[5, 19-20]。qRT-PCR检测发现,基因在根茎中具有特异表达,其相对表达水平是叶片中的13.7倍,暗示其在根茎中发挥重要的生物学功能。而根茎是温郁金最重要的药用部位,是提取莪术油的唯一原料,相比其它组织部位倍半萜成分在该部位是最高的[21]。这种潜在正关联性,暗示CwFPPS对促进温郁金倍半萜合成可能起着关键作用,但“基因-成分”关联性需要下一步进行基因功能学的验证。
FPPS作为植物萜类合成途径的关键酶之一,利用“基因-代谢”工程手段获得萜类成分高产株系是近年来研究的重要手段。青蒿超表达的株系相比野生型植株倍半萜青蒿素增加了高2~3倍[20]。在烟草叶片腺毛上异源表达西红柿和萜类合成酶,产生了多种倍半萜化合物[23]。研究也报道,人参基因过表达的毛状根株系(F17)中人参皂苷含量是野生型的2.4倍[24]。本研究成功克隆获得了温郁金基因,该基因具有异戊二烯生物合成酶家族保守的活性功能域,并在根茎中具有特异表达。研究结果为后续利用代谢工程手段调控温郁金萜类成分提供了重要靶标基因,有益于温郁金重要价值萜类成分的开发利用。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S].一部.2020: 217.
[2] 尹国平, 张清哲, 安月伟, 等.温郁金化学成分及药理活性研究进展 [J].中国中药杂志, 2012, 37(22): 3354-3360.
[3] 麻杰, 陈娟, 赵冰洁, 等.抗癌药物β-榄香烯及其衍生物的研究进展 [J].中草药, 2018, 49(5): 1184-1191.
[4] Dhar M K, Koul A, Kaul S.Farnesyl pyrophosphate synthase: A key enzyme in isoprenoid biosynthetic pathway and potential molecular target for drug development [J]., 2013, 30(2): 114-123.
[5] 杨欣, 魏建和, 刘娟, 等.白木香法呢基焦磷合酶基因AsFPS1的克隆及表达分析 [J].中国中药杂志, 2013, 38(19): 3251-3255.
[6] Banyai W, Kirdmanee C, Mii M,.Overexpression of farnesyl pyrophosphate synthase (FPS) gene affected artemisinin content and growth ofL [J]., 2010, 103(2): 255-265.
[7] Zhang Y, Li Z X, Yu X D,.Molecular characterization of two isoforms of a farnesyl pyrophosphate synthase gene in wheat and their roles in sesquiterpene synthesis and inducible defence against aphid infestation [J]., 2015, 206(3): 1101-1115.
[8] Peng B, Nielsen L K, Kampranis S C,.Engineered protein degradation of farnesyl pyrophosphate synthase is an effective regulatory mechanism to increase monoterpene production in Saccharomyces cerevisiae [J]., 2018, 47: 83-93.
[9] 陶正明, 吴志刚, 黄品湖, 等.温郁金生长规律研究 [J].中国中药杂志, 2007, 32(20): 2110-2113.
[10] Doyle J J, Doyle J L.A rapid DNA isolation procedure for small quantities of fresh leaf tissue [J]., 1987, 19: 11 -15.
[11] Livak K J, Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2−ΔΔCtmethod [J]., 2001, 25(4): 402-408.
[12] 李永波, 樊庆琦, 王宝莲, 等.植物法呢基焦磷酸合酶基因(FPPS) 研究进展 [J].农业生物技术学报, 2012, 20(3): 321-330.
[13] Szkopińska A, Płochocka D.Farnesyl diphosphate synthase; regulation of product specificity [J]., 2005, 52(1): 45-55.
[14] Qian J, Liu Y, Chao N,.Positive selection and functional divergence of farnesyl pyrophosphate synthase genes in plants [J]., 2017, 18(1): 3.
[15] Tholl D.Terpene synthases and the regulation, diversity and biological roles of terpene metabolism [J]., 2006, 9(3): 297-304.
[16] 蒋玲, 谷巍, 巢建国, 等.濒危药用植物茅苍术法呢基焦磷酸合酶基因克隆及其表达分析 [J].中草药, 2017, 48(4): 760-766.
[17] 张瑶瑶, 宋丽, 刘伟, 等.香樟基因的克隆及生物信息学分析 [J].分子植物育种, 2018, 16(19): 6276-6281.
[18] Nagegowda D A.Plant volatile terpenoid metabolism: Biosynthetic genes, transcriptional regulation and subcellular compartmentation [J]., 2010, 584(14): 2965-2973.
[19] 谷巍, 吴启南, 巢建国, 等.建泽泻法呢基焦磷酸合酶分子克隆、分布表达及生物信息学研究 [J].药学学报, 2011, 46(5): 605-612.
[20] 张贵翔, 吴友根, 陈赫, 等.广藿香法呢基焦磷酸合成酶基因(FPS)的克隆及生物信息学分析 [J].分子植物育种, 2019, 17(7): 2163-2170.
[21] 孙敬茹, 卜俊玲, 赵欢, 等.四种姜黄属药用植物根茎和块根挥发性代谢物的多元数据比较分析 [J].药学学报, 2018, 53(8): 1215-1224.
[22] Han J L, Liu B Y, Ye H C,.Effects of overexpression of the endogenous farnesyl diphosphate synthase on the artemisinin content inL [J]., 2006, 48(4): 482-487.
[23] Sallaud C, Rontein D, Onillon S,.A novel pathway for sesquiterpene biosynthesis from Z, Z-farnesyl pyrophosphate in the wild tomato[J]., 2009, 21(1): 301-317.
[24] Kim Y K, Kim Y B, Uddin M R,.Enhanced triterpene accumulation inhairy roots overexpressing mevalonate-5-pyrophosphate decarboxylase and farnesyl pyrophosphate synthase [J]., 2014, 3(10): 773-779.
Cloning, subcellular localization and expression analysis of farnesyl pyrophosphate synthase in(CwFPPS)
DING Xian-hua1, 2, ZHANG Li-ping1, FEI Xuan1, ZHU Qiang3, ZHAN Jin-hua4, REN Xian-ying5, WU Zhi-gang1, JIANG Cheng-xi1
1.School of Pharmacy, Wenzhou Medical University, Wenzhou 325035, China 2.Anhui Jiangnan Biotechnology Research Center, Chizhou 247100, China 3.Anhui Jiren Pharmaceutical Co., Ltd., Bozhou 236800, China 4.Dali Pharmaceutical Co.,Ltd., Dali 671000, China 5.Wenzhou Ejin Pharmaceutical Co., Ltd., Leqing 325600, China
To clone the full-length cDNA sequence encoding farnesyl pyrophosphate synthase (FPPS) that is one of the important rate-limiting enzymes involved in terpenoid biosynthesis.Based ontranscriptome database, specific primers were designed to amplify the full-length cDNA sequence of FPPS; the bioinformatics of the obtained sequence was further analyzed; GFP-fused constructs were prepared by cloning the full-length coding sequences ofand transformed intoGV3101 strain by electroporation systems; the subcellular localization ofprotein was observed by injecting the mixture of agrobacteria containing the::GFP fusion vector intoleaves.The real-time quantitative PCR (qRT-PCR) was used to detect the gene expression profiles in different tissues.Sanger sequencing showed that the full-lengthis 1196 bp (GenBank accession number: MT489462), which contains an open reading frame of 1071 bp, encoding 356 amino acids.Theencoding protein belongs to the member of the isoprenoid biosynthetic enzyme superfamily (C1) and contains 5 conserved functional domains, 2 of which are rich in aspartic acid (DDXXD) as active zones of FPPS enzyme.Subcellular localization indicated that the protein is located in the cytoplasm, as well as the cell membrane.Thewas specifically expressed in rhizome and its relative expression level was 13.7-fold compared to that in leaves.gene inwas successfully cloned and its expression pattern in tissues were obtained, which provides a basis for further gene functional identification and metabolic engineering of high-value sesquiterpenoids.
Y.H.Chen et C.Ling; FPPS; cloning; subcellular localization; expression analysis
R282.12
A
0253 - 2670(2021)22 - 6968 - 07
10.7501/j.issn.0253-2670.2021.22.023
2021-05-06
温州医科大学人才项目(89220027);浙江省重点实验室项目(2021E10013);大理药业股份有限公司横向课题(KJHX1603);合肥未来药物开发有限公司横向课题(KJHX2008);安徽济人药业横向课题(KJHX2009)
丁贤华(1983—),女,安徽石台人,硕士,研究实习员,研究方向为中药生物技术。Tel: (0577)86699891
通信作者:姜程曦(1971—),男,安徽青阳人,教授,研究方向为中药生物技术研究。Tel: 18969715696 E-mail: jiangchengxi@126.com
吴志刚(1979—),副研究员,主要从事药用植物次生代谢产物研究。E-mail: wuzhigang177@126.Com
#并列第一作者:张丽萍(1996—),女,河北唐山人,硕士研究生,研究方向为中药学。Tel: (0577)86591685
[责任编辑 时圣明]

