新疆胀果甘草遗传多样性的ISSR分析
王莉莉,阿力木江·排尔哈提,李莉伟,居来提·托合提,刘 忠
新疆胀果甘草遗传多样性的ISSR分析
王莉莉1,阿力木江·排尔哈提2#,李莉伟1,居来提·托合提2,刘 忠*
1.上海交通大学药学院,上海 200240 2.新疆维吾尔医学专科学校,新疆 和田 848000
揭示新疆塔里木盆地分布的野生胀果甘草的遗传多样性和种群遗传结构。利用ISSR分子标记方法,对来自新疆南疆不同地理方位的胀果甘草6个种群总计167个个体进行分析。对胀果甘草6个种群共筛选出46条引物,扩增获得193条多态条带,多态位点比率(PPL)为69.68%,Nei’s遗传多样性指数()为0.272 2,Shannon多样性指数()为0.401 0;Nei’s总种群遗传多样性指数(t)为0.513 0,种群间遗传分化系数(st)为0.530 7,基因流(m)为0.438 8,Mantel检验显示种群间的遗传分化与地理距离无相关性;种群间遗传变异丰度和遗传多样性水平呈现BC>KEL>PS>QM>AQS>KC的递减趋势,聚类分析将6个种群在遗传相似性系数为0.69处分为3类;6个种群内个体间PPL的变化范围为52.11%~81.87%,观测等位基因数(a)和有效等位基因数(e)的变化范围分别为1.521 1~1.818 7和1.307 9~1.498 9,平均为0.240 8,平均为0.357 1。胀果甘草有较高的遗传多样性水平,但种群间的分化程度较种群内大,遗传多样性更多的存在于种群水平。生境片段化可能是造成其遗传多样性空间分布现状的主要原因,土壤水分含量可能是影响其种群遗传多样性的制约因素。研究结果对全面了解和掌握胀果甘草自然资源现状、物种进化潜力等,制定资源利用与保护的正确策略提供了重要的研究基础。
胀果甘草;ISSR标记;遗传多样性;遗传结构;资源保护
甘草et是常用中药材,被誉为百药之首。甘草也是优良的甜味剂、乳化剂和矫味剂,广泛应用于食品、饮料、烟草、日化等工业,市场需求量巨大。正品甘草的基原植物有3种,即豆科甘草属L.植物乌拉尔甘草Fisch.、胀果甘草Bat.和光果甘草L.[1]。胀果甘草主要分布在新疆南疆,少部分经东疆扩展至甘肃疏勒河和额济纳河流域呈零星分布[2-3]。胀果甘草自然分布区域的生态环境均极为严酷,因而也极为脆弱,一旦遭到破坏,则难以恢复,野生资源总量十分有限,在商品甘草中的占比远小于乌拉尔甘草。但是,胀果甘草具有不同于乌拉尔甘草的品质和开发利用价值。胀果甘草不仅在总黄酮和多糖含量上均高于乌拉尔甘草,而且在黄酮化合物的组成上也不同于乌拉尔甘草,显示出与乌拉尔甘草有所不同的药理活性[4-5]。在生态适应能力上,胀果甘草也远胜乌拉尔甘草,具有极强的抗旱、耐盐碱、耐沙埋等抗极端不利环境的能力[6]。
遗传多样性是生物多样性的核心内容[7-8]。对物种遗传多样性的了解是揭示其资源水平、生境适应性、进化潜力的基础,也是合理开发利用与保护的依据[9]。药用植物遗传多样性分析可为新型、特异新成分的发掘提供有益的参考和指导,在天然药物的研发中具有积极意义。简单重复序列间片段多态性(inter-simple sequence repeat,ISSR)分子标记方法是在简单重复序列(simple sequence repeat,SSR)分子标记方法基础上发展起来的检测DNA片段多态性的技术。ISSR标记具有扩增稳定性好、检测能力强、分辨力高等优点,被广泛应用于遗传多样性评价、优良种质发掘、基因定位、遗传作图、辅助育种等方面的研究[10-12]。
胀果甘草的基础研究十分欠缺,对其资源蕴藏量、遗传多样性水平、品质变异格局等资源状况都所知甚少[13]。本研究采用ISSR分子标记技术,对新疆南疆不同地理来源的胀果甘草野生种群进行遗传多样性分析,评估胀果甘草遗传多样性水平,为胀果甘草生态适应机制、品质变异特征、优良种质筛选、资源保护的研究提供理论指导,同时也为胀果甘草规范化种植优良栽培品系的培育奠定基础,是胀果甘草开发利用中不可或缺的基础性研究工作。
1 材料和仪器
1.1 材料
材料来自于新疆南疆6个不同县市自然分布的胀果甘草野生种群(表1)。经上海交通大学药学院刘忠副教授鉴定为豆科甘草属植物胀果甘草Bat.,凭证标本保存于新疆维吾尔医学专科学校药用植物标本室(新疆和田市)。每个种群采集20个以上个体,6个种群共167个个体。采集时,选取新鲜、健康、幼嫩的叶片放入装有变色硅胶颗粒的自封袋中,标明采集信息。及时更换变色硅胶,使样品快速脱水,直至完全干燥。
1.2 仪器
JXFSPRP-24型组织研磨仪(净信实业有限公司,上海),Mastercycler nexus GX2 PCR仪(Eppendorf,德国),1600 凝胶成像分析系统(天能有限公司,上海),NanoDrop ONE(Thermo,美国),DYY-6C型电泳仪(六一仪器厂,北京)。
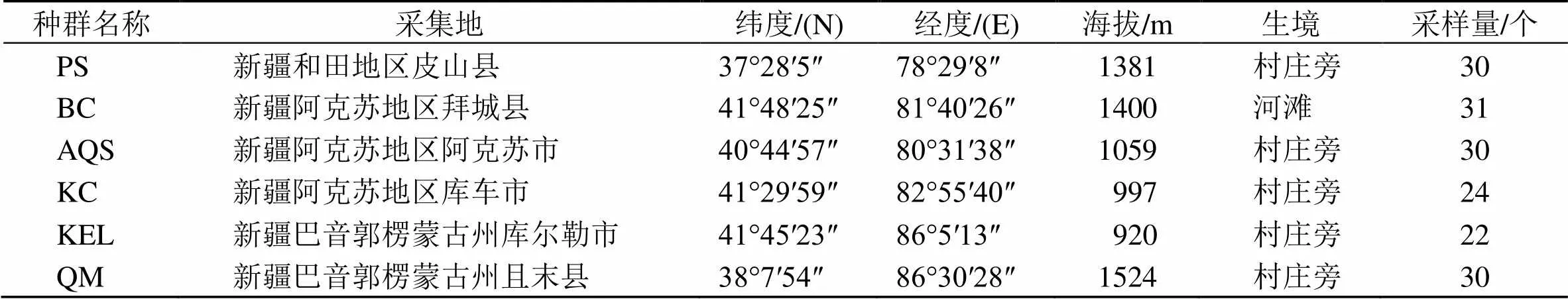
表1 胀果甘草的样品来源信息
2 方法
2.1 胀果甘草基因组DNA提取与质量检测
在进行种群遗传多样性分析时,采取混合取样法,即每个种群均称取其所有个体的等量叶片,充分混合后用于总DNA的提取,将种群整体上作为一个分析样品。在进行种群遗传结构检测时,采取个体取样法,即每一个种群均对其内每一个个体单独提取基因组DNA,用于ISSR-PCR扩增,每个个体均为一个样品。
利用CTAB法进行胀果甘草基因组DNA的提取。参照相关文献并加以适当改进[14]。主要步骤如下:称取0.1 g研磨成粉末状的植物材料,加入600 μL 3% CTAB提取液,65 ℃水浴中温育30 min;加入600 μL氯仿-异戊醇(24∶1,现配),静置,离心,取上清;加入预冷无水乙醇,静置,离心,弃上清;室温风干,除去残留乙醇,加入灭菌蒸馏水溶解。以1%琼脂糖凝胶电泳检测所提DNA质量。Nanodrop ONE(Thermo公司,美国)测定样品DNA的浓度。
2.2 引物的来源
基于哥伦比亚大学(UBC)公布的100条ISSR通用引物序列信息,以及豆科植物相关文献报道的引物序列信息[15-18],委托生工生物(上海)公司进行引物合成。
2.3 ISSR分析检测体系的优化
ISSR-PCR反应体系为:2×Taq PCR Master Mix(12.5 μL)、引物10 pmol/μL、DNA模板2 ng/μL,共25 μL。扩增程序:94 ℃预变性5 min;94 ℃变性45 s,53 ℃退火60 s,70 ℃延伸90 s,30个循环;72 ℃保持7 min。本实验对该扩增程序的引物退火温度和扩增循环次数进行了优化。
预实验提示,退火温度不仅影响ISSR-PCR扩增条带的清晰度,而且可造成条带数目的变化。实验中,以每条引物m值的±5 ℃为上下限设置温度梯度,进行梯度PCR扩增,筛选引物最适退火温度;设置30、32、35、38、40 5种不同扩增循环次数,考察扩增循环次数的优化设置。以巴音郭楞蒙古自治州且末县种群(QM)和库尔勒市种群(KEL)为样本,采用优化后的扩增程序进行扩增,验证上述优化的ISSR-PCR扩增程序的实效性,并进行有效引物筛选。
2.4 新疆胀果甘草遗传多样性ISSR检测
以筛选得到的条带明晰、多态性丰富,并且稳定性良好的引物,分别对6个种群进行种群间遗传多样性和种群遗传结构的ISSR分析。
2.5 数据统计与分析
对扩增产物进行人工判读,有条带记录为“1”,无条带则记录为“0”,形成0、1排列的原始数据矩阵。利用Popgene1.32软件计算胀果甘草遗传多样性参数。利用NTSYSpc 2.10e软件构建种群遗传关系聚类图。利用Mathematica软件计算6个种群间的地理距离,Mantel test分析6个种群遗传距离和地理距离的相关性。
3 结果与分析
3.1 ISSR反应条件的优化
3.1.1 引物退火温度的筛选 以引物UBC807、UBC808、UBC809、UBC810为例,对比不同退火温度对ISSR-PCR扩增结果的影响(图1)。结果显示,当引物UBC807、UBC808、UBC809、UBC810的退火温度分别为50.1、46.0、47.0、45.0 ℃时,扩增获得的条带不够清晰、多态性不丰富,但当每个引物对应的退火温度分别为46.1、52.0、51.0、49.0 ℃时,扩增产物不仅条带清晰,而且条带数目多、多态性丰富,扩增效果良好。其他引物的最佳退火温度见表2。
3.1.2 循环次数的优化 对胀果甘草的样品进行ISSR扩增时,当PCR反应的循环次数设置为30次时,电泳检测结果显示没有条带,进一步将循环次数设置为36次和38次,检测结果无明显差距,而循环次数为40次时,得到了条带清晰度高、多态性较丰富的扩增结果,因此,40次扩增循环次数是进行胀果甘草叶片基因组DNA ISSR-PCR反应的适宜条件。
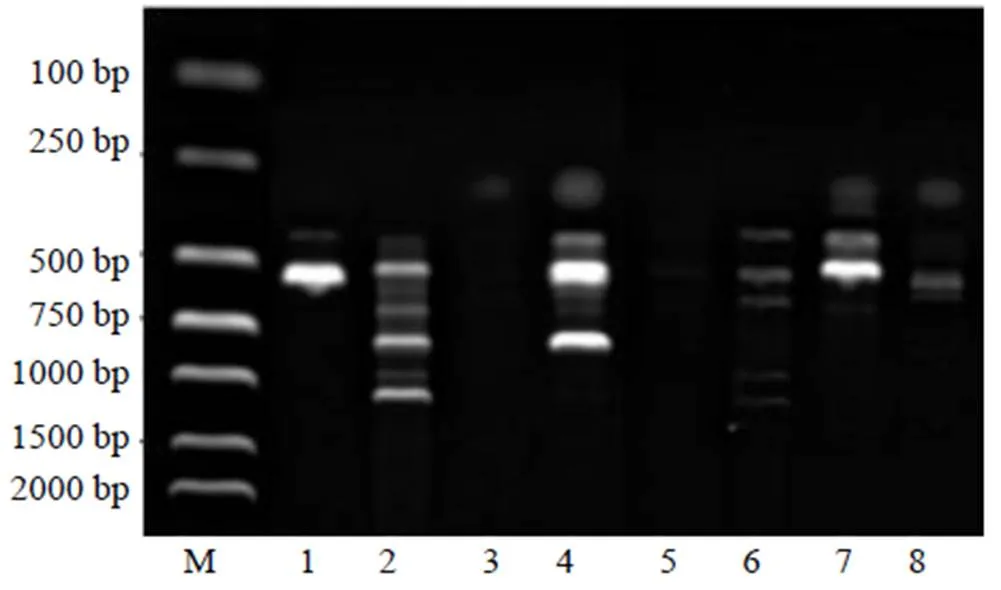
M-Marker 1~2-UBC807,50.1、46.1 ℃ 3~4-UBC808,46、52 ℃ 5~6-UBC809,47、51 ℃ 7~8-UBC810,49、45 ℃

表2 各引物的退火温度
3.2 胀果甘草的遗传多样性检测
3.2.1 种群间的遗传多样性 在对胀果甘草6个种群间的遗传多样性分析中(图2),筛选出46条引物,扩增获得的总条带数为277条,其中,有193条多态条带,多态条带比率(PPL)为69.68%,平均每个引物可扩增得到4.2个多态条带。Nei’s遗传多样性指数()为0.272 2,Shannon多样性指数()为0.401 0,显示胀果甘草在基因水平上具有较丰富的遗传多样性。
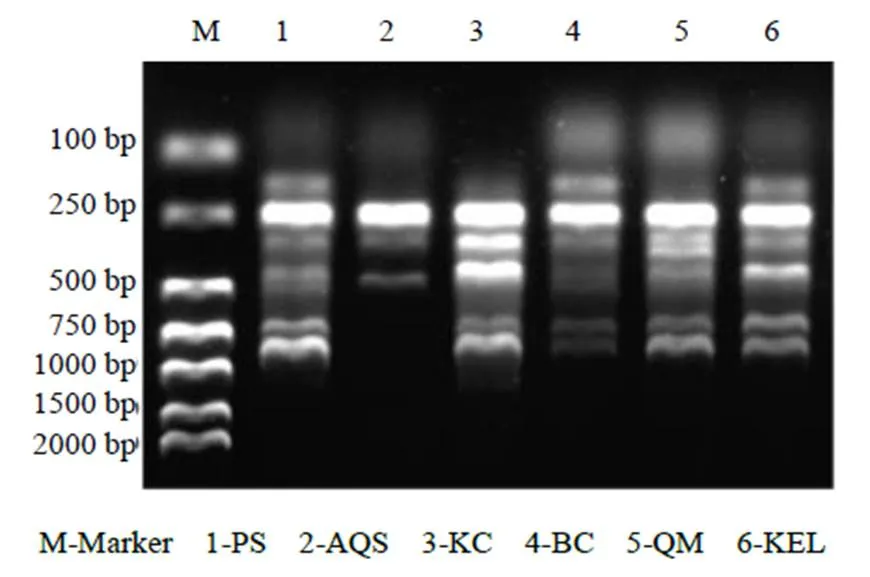
图2 引物UBC811的ISSR-PCR的结果分析
3.2.2 种群内个体间的遗传多样性 对胀果甘草6个种群进行遗传结构分析的结果显示(图3和表3),6个种群的PPL的变化范围在52.11%~81.87%,观测等位基因数(a)和有效等位基因数(e)的变化范围分别为1.521 1~1.818 7和1.307 9~1.498 9,变化范围为0.183 1~0.288 6(平均0.240 8),变化范围为0.274 1~0.429 1(平均0.357 1)。其中,阿克苏地区拜城县种群(BC)遗传变异丰富,遗传多样性水平高,而阿克苏地区库车市种群(KC)的变异相对贫乏,遗传多样性水平较低,群体间遗传变异丰度和遗传多样性水平呈现BC>KEL>PS>QM>AQS>KC的递减趋势。
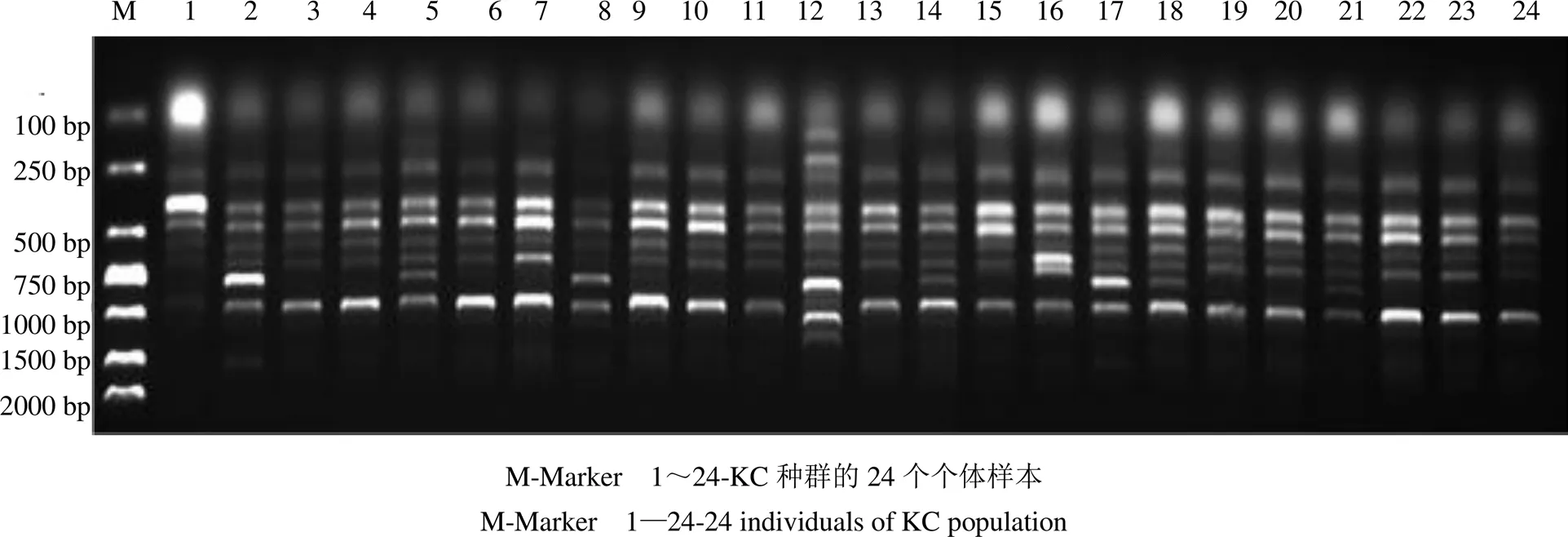
图3 引物UBC844对KC种群的ISSR扩增结果

表3 种群内个体间的遗传多样性分析
3.3 种群间遗传分化与聚类分析
Nei’s种群间遗传多样性指数(st)为0.272 2,Nei’s种群内遗传多样性指数(s)为0.240 8,计算可知Nei’s总遗传多样性指数(t)为0.513 0,种群间遗传分化系数(st)为0.530 7,即胀果甘草种群间的遗传变异水平占总遗传变异水平的53.07%,基因流(m)为0.438 8,小于1,显示胀果甘草种群间的分化程度大于种群内的分化程度。胀果甘草的遗传多样性更多的存在于种群水平。
根据6个胀果甘草种群间的Nei’s遗传距离和遗传一致度(表4)利用NTSYSpc 2.10e软件UPGMA方法对胀果甘草6个种群的聚类分析(图4)表明,6个种群在遗传相似性系数为0.69处分成3个大类。首先,阿克苏地区拜城县种群(BC)单独成为一类,表现出与来自其他5个地理分布区的胀果甘草种群之间较少的遗传相似性,说明该种群与其他种群之间的遗传分化程度较大;其次,阿克苏地区库车市种群(KC)与阿克苏市种群(AQS)聚为第2类;第3,巴音郭楞蒙古州的库尔勒市种群(KEL)与且末县种群(QM)的遗传距离最近,两者先聚在一起,然后再进一步与和田地区皮山县种群(PS)聚合为第3类。Mantel检验结果显示群体间的遗传距离与地理距离之间无相关性(=0.158 7,=0.254 7)。

表4 不同地理方位的胀果甘草的遗传距离和遗传一致度
左下角表示Nei’s遗传距离,右上角表示遗传一致度
Figures in the lower left half part of the table indicates Nei ’s genetic distance, whereas those in the upper right half part indicates genetic consistency

图4 胀果甘草种群间的聚类分析
4 讨论
4.1 伴随生境片段化的种群隔离分化可能是造成胀果甘草遗传多样性空间分布现状的主要原因
遗传多样性反映了物种在起源演化和环境适应上的特征[19-21]。遗传多样性丰富的物种具有更多的等位基因,对环境变化具有更好的适应性和更强大的抵御能力[22]。影响物种遗传多样性和种群遗传分化水平因素包括了地理隔离、生境片段化等外部因素,与繁育系统、遗传漂变、基因突变和基因流等内部因素[23-24]。
胀果甘草在生境适应性方面具有突出的特点,胀果甘草是一种生长在极端干旱区绿洲至沙漠过渡带的荒漠植被类群,塔里木盆地是其主要分布区域。根据古地磁学研究结果,新疆南疆地区经历了多次海浸海退过程,最终整体成陆于三叠纪至侏罗纪时期,因此,当被子植物在白垩纪开始繁盛和演化时,这里应该是气候温和湿润,条件适宜植被发育的[25-26]。至第四纪青藏高原开始隆升,塔里木盆地逐渐形成,周缘的高原和高山阻挡了大气环流及其携带的水汽,导致盆地日益变得干旱,土壤沙漠化程度和范围不断加深扩大,期间虽然由于冰期与间冰期的相互交替使得沙漠与绿洲的范围发生震荡,但总的趋势仍然是沙漠化不断加剧[27-28]。目前,南疆绿洲在盆地周缘主要呈片状间断分布,部分区域片状绿洲可沿河流相互联结呈串珠状[29]。遗传多样性分析结果表明新疆南疆胀果甘草具有较丰富的遗传多样性,且遗传多样性更多地体现在种群之间,同时,种群间的遗传分化与地理距离无相关性。结合地质变迁、气候变化和植物演化的研究资料,推测在塔克拉玛干沙漠形成和不断扩大的过程中,生境片段化带来的种群隔离分化是胀果甘草种群间遗传分化和遗传多样性基本特征形成的主要原因。
蒺藜科白刺属植物大白刺Kom.在地理分布和生境上与胀果甘草十分近似。对大白刺遗传多样性的研究结果很好地支持了这一推论。大白刺主要分布于塔里木盆地、河西走廊和内蒙古阿拉善。陆伟等[30]利用叶绿体基因组DNA片段的序列变异分析了大白刺的种群遗传结构和谱系地理特征,所得研究结果显示,中国西北干旱区更新世以来持续沙漠化扩张导致大白刺栖息地生境破碎化,种群被隔离,使种群间基因流受到限制,致使种群间表现出较高的遗传多样性。在对另一种塔里木盆地中的沙生植物沙生柽柳M.T.Liu所进行的遗传多样性分析中[31],结果也表明,分布于盆地边缘的一些沙生柽柳种群发生了明显的遗传分化,地理隔离可能是这些群体分化的主要因素。
而在种群内,由于地理隔离带来的种群间基因交流受阻,通过杂交增加遗传多样性的效应变小,而在另一方面,胀果甘草较高的自交率[32-34]又使得胀果甘草个体间基因交流的频率显著降低。一些由于生境片段化导致的种群规模变小的种群还会显著偏离哈迪-温伯格平衡状态,进一步加大遗传漂变引起种群遗传多样性降低的效应[35-36]。在诸多因素的综合作用下,胀果甘草种群内遗传多样性趋于丢失和贫乏化,使得胀果甘草的遗传变异更多地存在于种群之间。
4.2 土壤水分含量可能是影响胀果甘草维持或增加种群遗传多样性的制约因素
在所检测的胀果甘草6个野生种群中,阿克苏地区拜城县种群(BC)的遗传多样性水平最高,并且与其它5个种群的遗传距离均很大,在聚类分析中单独成为一类,而同为阿克苏地区的库车市种群(KC)却显示出最低的遗传多样性水平。目前尚没有直接的依据来阐述这一结果,还有待进一步的研究。
土壤水分含量是土壤的一个关键性环境变量。土壤是植物生长必须依赖的基本条件,土壤水分含量是影响干旱半干旱地区沙漠生态系统制约性环境因素,与生态系统的物质循环、能量流动、信息传递过程都有直接或间接的关系,对沙地土壤的发生、演化和土地生产力起着决定性的作用,在土地沙漠化区域作为维持生态系统稳定、正常发挥生态系统结构和功能的关键因子而存在,对整个生态系统的水热平衡状态的维护起决定性作用[37]。辛倩[38]在甘草属植物中开展研究的结果表明土壤因素与遗传多样性趋势存在一致性,胀果甘草分布区的土壤含水量越低,遗传多样性越低,干旱环境的选择压力使胀果甘草耐旱性强的基因型适应极端环境形成,反过来,土壤含水量越高,另一亲本的出现有可能促进杂交和渐渗种的产生,导致遗传多样性升高。宋雪梅[39]通过研究表明内蒙古高原红砂(Pall.) Maxim.种群间遗传变异的形成是生境中水热组合共同作用的结果,红砂种群的遗传差异在很大程度上是由其生长环境中的土壤平均含水量决定的。张志南等[40]对黄土高原半干旱区天然草地的群落结构研究发现,物种多样性和物种丰富度均随着土壤含水量的增加而增加,土壤水分是限制半干旱地区群落生产力和物种多样性的重要因子,而禾本科和豆科作为指示物种可以反映土壤的水分状况,含水量越高,群体的多样性越高。因此,在适宜的生境生长,胀果甘草的基因库不至于遭受破坏,避免了遗传漂变的发生,种群内的遗传多样性也会相应地升高。拜城县的胀果甘草种群生长在河滩地带,而其他5个种群均生长在村落旁,在土壤水分含量方面有着明显不同。土壤水分含量可能是影响胀果甘草遗传分化的核心因素。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典[S].一部.2020: 86.
[2] 韩路, 王家强, 王海珍, 等.塔里木荒漠绿洲过渡带主要种群生态位与空间格局分析 [J].植物科学学报, 2016, 34(3): 352-360.
[3] 李慧, 王欢, 宋经元, 等.新疆地区药用植物地理分布模式和气候特征研究 [J].干旱区地理, 2015, 38(1): 36-42.
[4] 张振巍, 张娜娜, 李月梅.不同品种甘草中总黄酮的含量考察 [J].中国药师, 2013, 16(1): 49-51.
[5] 李薇, 宋新波, 孙成荣, 等.三个不同品种甘草多糖的含量测定 [J].天津中医药, 2013, 30(1): 47-49.
[6] 陆嘉惠.三种药用甘草耐盐性及耐盐机制研究 [D].石河子: 石河子大学, 2014.
[7] Ellegren H, Galtier N.Determinants of genetic diversity [J]., 2016, 17(7): 422-433.
[8] 彭羽, 卿凤婷, 米凯, 等.生物多样性不同层次尺度效应及其耦合关系研究进展 [J].生态学报, 2015, 35(2): 577-583.
[9] 熊海铮.豇豆遗传多样性及若干农艺性状关联分析 [D].杭州: 浙江大学, 2016.
[10] Ge X J, Liu M H, Wang W K,.Population structure of wild bananas,, in China determined by SSR fingerprinting and cpDNA PCR-RFLP [J]., 2005, 14(4): 933-944.
[11] 王刚, 曹佩, 韦学敏, 等.分子标记技术在药用植物种质资源研究中的应用 [J].中国现代中药, 2019, 21(11): 1435-1444.
[12] 胡一凡, 张雪梅, 石乃星, 等.云南草果种质资源DNA条形码序列分析 [J].中草药, 2019, 50(24): 6091-6097.
[13] 李文斌, 罗琳, 崔洁, 等.3种药用甘草的遗传多样性研究进展 [J].中药材, 2019, 42(2): 463-469.
[14] 王艳, 成金乐.改进的CTAB法提取32种中药破壁饮片DNA及物种鉴定 [J].中国中医药现代远程教育, 2018, 16(22): 89-91,130.
[15] 强正泽.基于ISSR标记技术的甘肃地产药材红芪的遗传多样性研究 [D].兰州: 甘肃中医药大学, 2016.
[16] 邱亚玲, 秦民坚, 戴轶群, 等.不同产地猫豆遗传多样性的ISSR分析 [J].中国实验方剂学杂志, 2015, 21(6): 86-90.
[17] 赵娜, 鲁萍, 李景欣.东北地区野豌豆属四个种间遗传关系的ISSR分析 [J].作物杂志, 2011(3): 93-96.
[18] Shah A, Li D Z, Gao L M,.Genetic diversity within and among populations of the endangered species(Taxaceae) from Pakistan and implications for its conservation [J]., 2008, 36(3): 183-193.
[19] 燕雪飞.中国野生大豆遗传多样性及其分化研究 [D].沈阳: 沈阳农业大学, 2014.
[20] Szczecińska M, Sramko G, Wołosz K,.Genetic diversity and population structure of the rare and endangered plant species(L.) mill in east central Europe [J]., 2016, 11(3): e0151730.
[21] Li E X, Yi S, Qiu Y X,.Phylogeography of two East Asian species in(Stemonaceae) inferred from chloroplast DNA and ISSR fingerprinting variation [J]., 2008, 49(3): 702-714.
[22] Li B J, Wang J Y, Liu Z J,.Genetic diversity and ex situ conservation of, an endangered species endemic to China [J]., 2018, 19(1): 12.
[23] 赵春磊.利用ISSR分析中国原生董棕植物遗传多样性 [D].厦门: 厦门大学, 2009.
[24] 吴涛, 陈少瑜, 宁德鲁, 等.怒江州深纹核桃种质资源SSR遗传多样性分析 [J].福建农林大学学报: 自然科学版, 2019, 48(2): 252-258.
[25] 潘裕生, 方爱民.中国青藏高原特提斯的形成与演化 [J].地质科学, 2010, 45(1): 92-101.
[26] 林畅松, 杨海军, 刘景彦, 等.塔里木早古生代原盆地古隆起地貌和古地理格局与地层圈闭发育分布 [J].石油与天然气地质, 2008, 29(2): 189-197.
[27] 葛肖虹, 刘俊来, 任收麦, 等.青藏高原隆升对中国构造-地貌形成、气候环境变迁与古人类迁徙的影响 [J].中国地质, 2014, 41(3): 698-714.
[28] 马志伟, 孙东怀, 易治宇, 等.晚新生代塔里木盆地西部沙漠形成与演化的粒度记录 [J].兰州大学学报: 自然科学版, 2017, 53(2): 152-162.
[29] 李锦轶.新疆东部新元古代晚期和古生代构造格局及其演变 [J].地质论评, 2004, 50(3): 304-322.
[30] 陆伟.基于cpDNA对大白刺(Nitraria roborowskii)的谱系地理研究 [D].石河子: 石河子大学, 2015.
[31] 苏志豪, 卓立, 李文军, 等.塔里木盆地沙生柽柳()遗传多样性 [J].中国沙漠, 2018, 38(5): 1041-1048.
[32] 郭争争, 程瑞婧, 杨丽, 等.不同繁殖模式下甘草药用成分含量积累速度差异研究 [J].现代生物医学进展, 2015, 15(10): 1816-1819.
[33] 谢良碧, 陆嘉惠, 李晓岚, 等.三种甘草属植物的种间杂交亲和性及杂交种子活力 [J].植物分类与资源学报, 2014, 36(3): 342-348.
[34] 田润炜, 陆嘉惠, 谢良碧, 等.光果甘草与乌拉尔甘草开花与传粉方式对生殖及种间关系的影响 [J].西北植物学报, 2012, 32(10): 2004-2008.
[35] 郭洪英.四川桤木优树群体遗传多样性分析及育种群体构建 [D].北京: 北京林业大学, 2019.
[36] 俞文灏, 吴保锋, 刘勇波.生境破碎化对动植物遗传多样性的影响研究进展 [J].应用与环境生物学报, 2019, 25(3): 743-749.
[37] 马芳.毛乌素沙地油蒿种群遗传多样性与环境相关性研究 [D].呼和浩特: 内蒙古大学, 2015.
[38] 辛倩.基于转录组SSR分子标记的甘草属植物杂交区组成及种间基因渐渗研究 [D].石河子: 石河子大学, 2019.
[39] 宋雪梅.内蒙古高原跨地带分布红砂种群遗传多样性研究 [D].呼和浩特: 内蒙古大学, 2012.
[40] 张志南, 武高林, 王冬, 等.黄土高原半干旱区天然草地群落结构与土壤水分关系 [J].草业学报, 2014, 23(6): 313-319.
Genetic diversity ISSR analysis offrom Xinjiang
WANG Li-li1, ALIMJAN·PARHAT2, LI Li-wei1, JURAT·TOHTI2, LIU Zhong1
1.School of Pharmacy, Shanghai Jiao Tong University, Shanghai 200240, China 2.College of Xinjiang Uyghur Medicine, Hotan 848000, China
To evaluate the genetic diversity of, which is one of the source plants ofet, abundantly distributed in the Xinjiang.ISSR molecular marker method was used to analyze 167 individuals from six populations offrom different geographical locations of southern Xinjiang.In the six populations, 46 primers were used to amplify 193 polymorphic bands, accounting for 69.68% of the percentage of polymorphic loci (PPL).Moreover, Nei's genetic diversity index () was 0.272 2, and Shannon's diversity index () was 0.401 0.Nei's genetic diversity index at the level of total populations (t) was 0.513 0; The genetic differentiation coefficient (st) was 0.530 7, showing 0.4388 of the gene flow (m).In contrast, among these populations, PPLs ranged from 52.11% to 81.87%; the observed allele numbers (a) and the effective allele numbers (e) varied from 1.521 1 to 1.818 7 and from 1.307 9 to 1.498 9, respectively; Likewise, the averaged Nei's genetic diversity index () was 0.240 8, while the averaged Shannon's diversity index () was 0.3571.Finally, Mantel test showed that there was no correlation among genetic differentiations and geographical distances.Besides, the level of genetic diversity among populations showed a decreasing tendency of BC> KEL> PS> QM> AQS> KC.In cluster calculation, the six populations were gathered into three groups (clades) at the genetic correlation coefficient of 0.69.The PPL range of six populations was 52.11%—81.87%; The range ofaandewas 1.521 1—1.818 7 and 1.307 9—1.498 9, the averagevalue was 0.240 8, the averagevalue was0.357 1.It is well known thatpossesses comparatively rich genetic diversity.The genetic diversity of inter-populations was higher than that of intra-populations in this species.Habitat fragmentation was considered as the principle factor giving rise to the spatial distribution pattern of the genetic diversity, and the water content of habitat soils might be the crucial factor impacting the differentiation of the genetic diversity of the species.In sum, this study would provide a serviceable reference for a comprehensive and better understanding of the natural resource and their evolutionary potential, contributing to the conservation and sustainable utilization of such unadequately-studied medicinal plants.
Bat.; ISSR; genetic diversity; genetic structure; natural resource conservation
R282.12
A
0253 - 2670(2021)22 - 6975 - 08
10.7501/j.issn.0253-2670.2021.22.024
2021-05-06
新疆维吾尔自治区区域协同创新专项(科技支疆项目)(2017E0230)
王莉莉,硕士研究生,研究方向为药学。Tel: (021)34208145 E-mail: liliwangz@sjtu.edu.cn
通信作者:刘 忠,副教授,研究方向为生药学。Tel: (021)34208148 E-mail: liuzhong@sjtu.edu.cn
#并列第一作者: 阿力木江·排尔哈提,讲师,研究方向为生物科学。Tel: 13899478919 E-mail: 652343507@qq.com
[责任编辑 时圣明]

