超滤亲和液质联用技术筛选显齿蛇葡萄叶中酪氨酸酶抑制剂
周慧吉,张 璐,李廷钊, 2,李 波, 2*
超滤亲和液质联用技术筛选显齿蛇葡萄叶中酪氨酸酶抑制剂
周慧吉1,张 璐1,李廷钊1, 2,李 波1, 2*
1. 安利(中国)研发中心,上海 201203 2. 安利(中国)植物研发中心,江苏 无锡 214145
采用超滤亲和-液质联用技术(ultra-filtration affinity-liquid chromatography-mass spectrometry,UF-LC-MS)结合体外酶活性实验,筛选药茶两用植物显齿蛇葡萄叶(藤茶)中的酪氨酸酶抑制剂。通过体外酶活实验发现藤茶具有很好的酪氨酸酶抑制活性,采用UF-LC-MS筛选并鉴定藤茶中1个主要组分对酪氨酸酶的活性具有抑制作用,并鉴定为二氢杨梅素。进一步通过体外荧光光谱、圆二色谱和分子对接技术研究了二氢杨梅素对酪氨酸酶的分子作用机制。发现二氢杨梅素对酪氨酸酶具有较高的抑制作用,对单酚酶及双酚酶的半数抑制浓度(median inhibition concentration,IC50)分别为37.73、18.87 µg/mL。分子模拟结果显示,二氢杨梅素可以进入酪氨酸酶的活性中心,与氨基酸残基形成4个氢键,改变酶活性中心的构象,从而导致酪氨酸酶催化活性下降。此外,二氢杨梅素能明显抑制B16黑色瘤细胞的增殖,并且显著降低黑色素合成。为利用UF-LC-MS和分子对接技术筛选药用植物中酪氨酸酶抑制剂提供了参考,也为后续研究和开发藤茶及二氢杨梅素用于治疗皮肤色素沉着性疾病提供理论基础。
超滤亲和-液质联用;显齿蛇葡萄;二氢杨梅素;酪氨酸酶;分子对接;B16黑色瘤细胞
藤茶亦称银茶、霉茶,是葡萄科蛇葡萄属植物显齿蛇葡萄(Handel- Mazzetti) W. T. Wang的干燥茎叶,为多年生藤本植物[1],是湘西土家族民间习用药材,用于治疗咽喉炎、口腔炎症及各种痈肿、便秘等病症[2]。藤茶主要分布在长江流域及其以南省份,食用历史悠久,有报道早在东晋时期湖南衡东居民就开始饮用藤茶[3]。2013年国家卫生计生委批准显齿蛇葡萄叶为新资源食品。作为药茶两用植物资源,藤茶开发潜力巨大。藤茶中富含黄酮类化合物[4],主要化学成分有二氢杨梅素、杨梅素、香橙素、杨梅苷等,其中二氢杨梅素的质量分数高达28%[5]。除此之外,藤茶中还含有较多的酚类化合物,如没食子酸、没食子酸酯、儿茶素、表儿茶素等[6]。
酪氨酸酶又被称为多酚氧化酶是一种广泛存在于生物体内的催化黑色素合成的关键酶[7],与生命体的诸多重要生理过程密切相关,过量表达会导致色素沉着性疾病的产生,例如黄褐斑、雀斑和老年痣等色素沉着性疾病。酪氨酸酶抑制剂在医药、化妆品和食品化学方向有着广泛的应用。而随着天然产物研究的兴起,从植物中筛选高效低毒的酪氨酸酶抑制剂已是当前的研究热点。
传统活性成分追踪方法要经过提取、分离、纯化、化合物鉴定,再针对单体化合物进行活性测定,该方法费时费力,还容易造成微量成分流失或者活性追踪消失[8]。因此,操作简便、检测灵敏、结果特异的快速活性成分筛选方法开发一直是研究热点。超滤亲和-液质联用技术(ultra-filtration affinity- liquid chromatography spectrometry,UF-LC-MS)是将超滤技术与质谱技术相结合的一种高效药物筛选方法[9-10],它以酶为靶点成功应用于复杂体系中活性成分的发现和鉴定。如Yang等[11]采用光电二极管阵列检测和电喷雾串联质谱从人参茎叶中筛选出乙酰胆碱酯酶(AChE)抑制剂。Zhang等[12]运用UF-LC-MS方法发现并分析参芪降糖颗粒中α-葡萄糖苷酶抑制成分。
本课题组前期研究发现藤茶具有较好的酪氨酸酶抑制活性,利用UF-LC-MS技术,获得藤茶主要活性成分信息,结合文献和已有对照品对化合物进行推断及验证,从而鉴定藤茶中抑制酪氨酸酶的主要成分。并进一步采用多种光谱学技术结合分子模拟技术初步探究化合物对酪氨酸酶的作用机制,为后续研究和开发藤茶及二氢杨梅素用于治疗皮肤色素沉着性疾病提供理论基础。
1 仪器与材料
1.1 材料
藤茶药材购自湖南省张家界,由上海中医药大学附属龙华医院高级实验师刘书芬博士鉴定为葡萄科蛇葡萄属植物显齿蛇葡萄(Handel- Mazzetti) W. T. Wang的叶,存样于安利(中国)研发中心中药材标本库。
酪氨酸酶(批号9002-10-2)、二甲基亚砜DMSO(批号#D4540)购自美国Sigma公司;超滤离心管购自美国Microcon公司;色谱级甲醇购自美国Honeywell公司;二氢杨梅素(批号RS03841020)购自上海诗丹德生物技术有限公司;B16细胞株购自中国科学院上海细胞生物所;DMEM高糖培养基(批号11965084)、胎牛血清FBS(批号10099141C)、青霉素-链霉素(10 000 U/mL)PS(批号10378016)、胰酶(批号R001100)均购自美国Gibco公司;MTT试剂盒(批号G020-1-2)购自南京建成生物工程研究所;PBS(批号C8020)购自Adamas公司;RIPA裂解液(批号P0013B)购自上海碧云天;其他试剂均购自上海泰坦科技股份有限公司;熊果苷(批号60077B,质量分数>98%)、曲酸(批号60307B,质量分数>99%)、白藜芦醇(批号00308B,质量分数>98%)、水溶性VE(Trolox,批号P1307382,质量分数>98%),购自Adamas公司。咖啡酸(批号ST04140120,质量分数>98%)购自上海诗丹德技术有限公司。
1.2 仪器与设备
超高效液相色谱仪,配PDA检测器,串联QDa质谱仪,美国Waters公司;Milli-Q超纯水系统,上海技舟化工科技有限公司;XS205十万分之一电子天平及MS3002S型电子分析天平,梅特勒-托利多国际贸易有限公司;WF-600EHT 型超声波清洗机,宁波海曙五方超声设备有限公司;RWB3220CY-2高速冷冻离心机,德国Eppendorf公司;恒温水浴锅,美国Thermo公司;多功能酶标仪,美国Molecular公司。
2 方法
2.1 样品处理
藤茶粉碎,过筛,精密称定20.0 g,用12倍体积热水回流提取2次,每次1 h。提取液过滤后真空浓缩到小体积,冻干后−20 ℃保存备用。
2.2 酪氨酸酶抑制实验
2.2.1 酪氨酸酶的单酚氧化酶活力测定 酪氨酸酶单酚氧化酶测定参考文献报道[13]并对方法进行了细微的调整。以酪氨酸为底物,熊果苷为阳性对照,测定藤茶提取物对酪氨酸酶单酚氧化酶的抑制活性。实验分为空白组、空白对照组、样品组和样品对照组(=3)。样品组:50 μL的-酪氨酸(0.5 mmol/L)及100 μL样品液,混匀后37 ℃孵育5 min。随后加入100 μL酪氨酸酶溶液(250 U/mL),混匀后37 ℃孵育15 min。样品对照组:100 µL PBS替代100 µL酪氨酸酶。空白组:100 µL PBS替代100 µL样品溶液。空白对照组:100 µL PBS替代100 µL样品溶液,并用100 µL PBS替代100 µL酪氨酸酶。预孵结束后于475 nm处测定吸光度()值。熊果苷作为阳性对照。按照公式计算抑制率。
抑制率=1-(1-2)/(3-4)
1为样品组;2为样品对照组;3为空白组;4为空白对照组
2.2.2 酪氨酸酶的双酚氧化酶测定 酪氨酸酶双酚氧化酶测定参考文献报道[14]并对方法进行了细微的调整。以多巴为底物,熊果苷为阳性对照,测定藤茶提取物对酪氨酸酶单酚氧化酶的抑制活性。分为空白组、空白对照组、样品组和样品对照组(=3)。样品组:50 μL的多巴溶液(0.5 mmol/L)及100 μL样品液,混匀后37 ℃孵育5 min。随后加入100 μL酪氨酸酶溶液(100 U/mL),混匀后37 ℃孵育5 min。样品对照组:100 µL PBS替代100 µL酪氨酸酶。空白组:100 µL PBS替代100 µL样品溶液。空白对照组:100 µL PBS替代100 µL样品溶液,并用100 µL P BS替代100 µL酪氨酸酶。孵育结束后于475 nm处测定值。熊果苷作为阳性对照。抑制率计算公式同“2.2.1”项。
2.3 UF-LC-MS技术筛选酶抑制剂
UF-LC-MS在线鉴别藤茶中的酪氨酸酶抑制剂的流程见图1。
2.3.1 竞争性配体筛选
(1)配体混合溶液配制:分别称取一定量熊果苷、曲酸、咖啡酸、白藜芦醇和Trolox,溶于含5%DMSO的PBS(pH 6.6)溶液中,5种抑制剂的最终质量浓度分别为5 mg/mL和750、375、200、700 µg/mL。
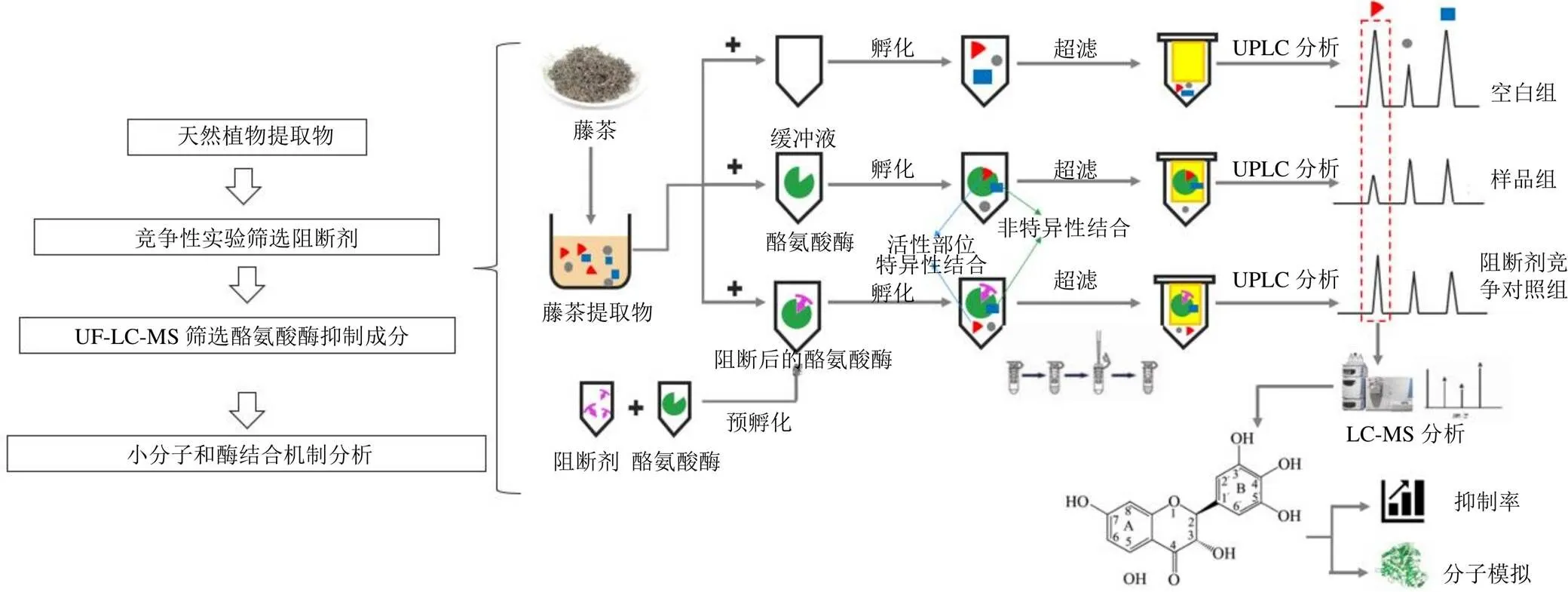
图1 UF-LC-MS流程图
(2)配体与酪氨酸酶结合情况分析:移取50 µL混合溶液,加入250 µL的酪氨酸酶(500 U/mL)溶液,37 ℃下孵育30 min。再将混合溶液转移至超滤离心管(Millipore,UFC501096)中以12 000 r/min的速度离心15 min。混合液用300 µL PBS清洗2次,收集3次离心液,滤过,取续滤液高效液相色谱分析。
(3)配体与酪氨酸酶是特异性结合分析:分别将5种已知抑制剂与250 µL酪氨酸酶在37 ℃下预孵育30 min,转移至超滤离心管后离心,并PBS清洗3次后。舍弃离心液后,在离心管种加入50µL混合溶液和250 µL PBS,37 ℃下继续孵育30 min。12 000 r/min的速度离心15 min,用300 µL PBS清洗2次,收集3次离心液,滤过,取续滤液高效液相色谱分析。
液相条件:Kromasil C18色谱柱(250 mm×4.6 mm,5 µm);流动相:甲醇(A)-0.02%磷酸(B);体积流量1.0 mL/min;柱温30 ℃;进样量10 µL;检测波长280 nm;梯度洗脱,0~3 min,5% A;3~10 min,5%~70% A;10~15 min,70%~95% A;15~25 min,95% A;25.1~35 min,5% A。
2.3.2 超滤离心法分析藤茶提取物中抑制酪氨酸酶的活性成分及结构鉴定 分为空白对照组、样品组和阻断性竞争样品对照组进行实验。空白组:300 µL PBS;样品组:50 µL PBS+250 µL酪氨酸酶溶液(500 U/mL);对照组:50 µL竞争性配体+250 µL酪氨酸酶溶液(500 U/mL),3组样品置于37 ℃恒温水浴锅中同时预孵化30 min。将溶液转移至超滤离心管中12 000 r/min的速度离心15 min,向滤膜中加入PBS清洗3次,彻底洗去未结合的配体。舍弃离心液后,依次往离心管中加入藤茶水溶液(10 mg/mL,50 µL)和250 µL PBS溶液,37 ℃下继续孵育30 min,于12 000 r/min的高速离心15 min,向滤膜中加入300 µL PBS,离心清洗2次。收集滤液,混匀后UPLC-MS分析。
超高效液相条件:色谱柱Agilent Poroshell 120 EC-C18(100 mm×2.1 mm,1.9 μm),编号SR047,流动相为0.1%甲酸(A)-0.1%甲酸乙腈(B),梯度洗脱:0~3 min,12% B;3~11 min,12%~15% B;11~16 min,15%~30% B;16~17min,30%~95% B;17~30 min,95% B;30~31 min,95%~12% B。体积流量为0.3 mL/min,柱温35 ℃,检测波长为292、365 nm,进样量5 µL。
Qda分析采用电喷雾负离子模式,毛细管电压0.8 kV,氮气体积流量28.0 L/min, 干燥气温度500 ℃,锥孔电压15V,全扫描质荷比(/)范围为50~1700。
2.4 活性成分对酪氨酸酶活性及构象的影响
2.4.1 活性成分对酪氨酸酶活性的抑制能力测定 按“2.2.1”项方法测定化合物对单酚氧化酶和双酚氧化酶的抑制率,熊果苷为阳性对照组。
2.4.2 活性成分对酪氨酸酶的抑制可逆性测定 设置4组实验,固定底物左旋多巴胺(-DOPA)的浓度(0.5 mmol/L),加入不同浓度的化合物溶液,测定酪氨酸酶浓度变化时值的变化(Δ),作出Δ与酶浓度的关系曲线,并由该关系曲线判断化合物对酪氨酸酶的抑制作用是否可逆[15];每隔15 s检测反应体系在475 nm处的值,通过测定475随时间的变化曲线,计算曲线的斜率即得Δ。
2.4.3 活性成分对酪氨酸酶的荧光光谱的测定[16]以ex=280 nm为激发波长,发射波长em范围290~450 nm,激发和发射狭缝宽度均为5 nm。移取100 μL的100 U/mL的酪氨酸酶溶液,加入不同体积(0、10、20、30、40、50 μL)的化合物,并用缓冲溶液补充至300 μL,于酶标仪上进行荧光光谱的扫描和测定。
2.4.4 圆二色谱的测定[17]扫描范围为190~260 nm,带宽1 nm,扫描速度60 nm/min。移取980 μL的500 U/mL的酪氨酸酶溶液,分别加入0、10、20 μL的100 μg/mL二氢杨梅素溶液,并用缓冲溶液补充至1 mL,充分混匀后,于室温下测定二氢杨梅素-酪氨酸酶混合体系的圆二色谱。以磷酸盐缓冲液作为空白,实验结果均扣除缓冲液背景峰。
2.4.5 分子对接研究 从RSCB PDB蛋白数据库(rcsb.org/)中下载酪氨酸酶的晶体结构(PDB:2Y9X)。去掉原有的小分子配体及水分子后保存为2y9x-protein.pdb。从PubChem网站(https://pubchem.ncbi.nlm.nih.gov/)下载二氢杨梅素的SDF文件,并用OpenBabel软件转化为mol2格式,保存为ligand.Mol2。酪氨酸酶和二氢杨梅素均加力场,选择酪氨酸酶自带小分子配体的位置作为对接位点,保留活性位点的2个铜离子。最后,运用殷斌云计算平台(http://cloud.yinfotek.com)进行分子对接模拟计算。选择结合能最低的构象分析酪氨酸酶与配体的相互作用。
2.5 活性成分对B16黑色素瘤细胞的影响
2.5.1 小鼠B16黑色素瘤细胞培养 小鼠B16黑色素瘤细胞培养于含有10% FBS的DMEM高糖培养基中(含100 U/mL青霉素、100 μg/mL链霉素),置CO2孵箱,于37 ℃、5% CO2、饱和湿度环境下。每2~3天用0.25%胰酶消化,以1∶3~1∶5传代。当细胞生长状态稳定,呈对数生长期时,用于实验。
2.5.2 MTT法测定化合物对小鼠B16黑色素瘤细胞活性的影响[18]当细胞生长至对数期时,消化制成细胞悬液。每孔100 μL,密度为5×104个/mL,接种于96孔板中。培养24 h,待细胞贴壁后,弃去培养液。实验分为空白组:只含培养液;对照组:加培养液正常培养细胞;实验组:加不同浓度样品的培养液培养细胞。测试的样品均设置5个浓度,每个浓度设置6个复孔。培养48 h后,每孔加MTT溶液50 μL,继续培养4 h,弃去上清液,每孔加DMSO 150 μL,振荡20 min,酶标仪于570 nm处测定各孔的值。按照公式计算细胞存活率。
细胞存活率=(实验-空白)/(对照-空白)
2.5.3 氢氧化钠裂解法测定化合物对小鼠B16黑色素瘤细胞中黑色素合成的影响[19]细胞培养同上,当细胞生长至对数期时,消化制成细胞悬液,以每孔体积2 mL,密度1×105个/mL,接种于6孔板中。培养24 h,弃去培养液,PBS洗涤2次。实验分为空白组:加入不含样品的培养液;给药组:加入含不同浓度样品的培养液。培养48 h,弃去培养液,每孔加0.5 mL胰酶细胞消化液进行消化,然后收集细胞至离心管中,1500 r/min,离心5 min,离心后弃去上清液,得到细胞团。PBS洗涤,6400 r/min,离心5 min后,弃去上清液,每管中加入100 μL裂解液,放置于冰上,充分裂解30 min,每10 min混匀1次。之后4 ℃,12 000 r/min,离心15 min,弃去上清后,在细胞沉淀中加入100 μL的1 mol/L氢氧化钠溶液,置于水浴锅80 ℃水浴1 h,使黑素颗粒能够充分溶解,酶标仪于400 nm处测定。按公式计算细胞中黑色素抑制率。
黑色素抑制率=(给药-空白)/空白
2.6 数据处理及分析
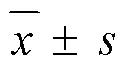
3 结果
3.1 藤茶提取物对酪氨酸酶活性的影响
酪氨酸酶单酚酶、二酚酶的抑制活性测定结果见表1。藤茶提取物质量浓度为50.00 μg/mL、0.16 mg/mL时,其对酪氨酸酶单酚酶、双酚酶的抑制率分别为62.91%、68.87%,相同浓度下熊果苷的抑制率分别为39.53%、9.02%,显示藤茶提取物具有较好的酪氨酸酶抑制活性且呈现剂量相关性。推测藤茶提取物中可能存在一些有效成分通过占据酪氨酸酶活性位点形成受体-配体复合物,从而抑制了酪氨酸酶的活性。
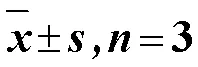
表1 藤茶提取物、二氢杨梅素和熊果苷对酪氨酸酶抑制活性()
3.2 酪氨酸酶竞争性配体筛选
小分子化合物可以和酶发生特异性结合,占据酶的活性位点,从而阻断其他化合物与酶的结合。然而在活性筛选的试验中也会出现化合物和酶发生非特异性结合,出现假阳性的结果。为了避免大量的假阳性,采用竞争性实验,通过已知配体阻断酶的特定位点来识别特异性结合[20]。因此,如何选择特异性结合的阳性药物至关重要。
选择5种已知的酪氨酸酶抑制剂(熊果苷、曲酸、白藜芦醇、咖啡酸、Trolox),进行配体筛选实验。图2-a是5种配体混合液的液相色谱图(空白组);图2-b是配体混合液和酪氨酸酶预孵育后的液相色谱图(酶结合组),从峰面积的下降程度可以推测Trolox与酪氨酸酶没有显著结合,而熊果苷、曲酸、咖啡酸、白藜芦醇均能与酪氨酸酶发生显著结合,可作为潜在的竞争性配体继续筛选。分别用熊果苷、曲酸、咖啡酸、白藜芦醇与酪氨酸酶进行预孵化实验,结果显示白藜芦醇预孵化后可以显著提高其它抑制剂的峰面积(图2-c,白藜芦醇预孵化组),推测白藜芦醇与酪氨酸酶紧密结合并占据酶的活性位点,从而阻止了其他抑制剂与酶结合。因此,最终选择白藜芦醇作为竞争性配体进行阳性对照实验。
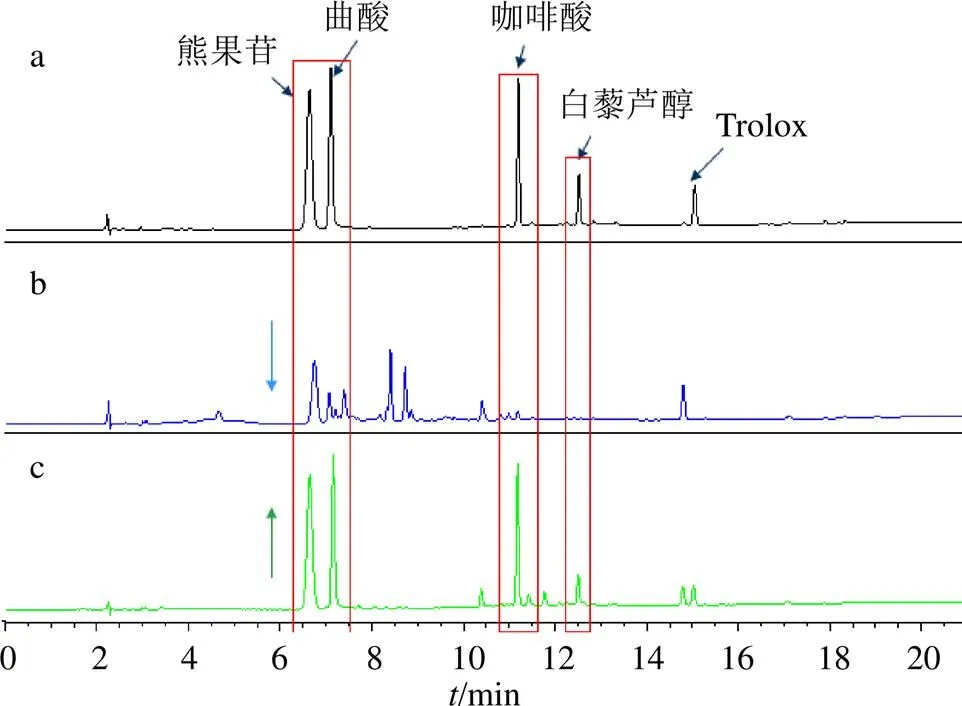
a-空白组 b-酶结合组 c-白藜芦醇预孵化组
3.3 超滤离心法分析藤茶提取物中抑制酪氨酸酶的活性成分
在超滤筛选实验过程中发现,样品组(图3-B)的藤茶提取物中活性成分与酪氨酸酶发生结合后的色谱峰面积要低于空白组(图3-A)。为避免非特异性结合而造成的假阳性结果,设计竞争性抑制试验阳性对照组(图3-C)。酪氨酸酶与阳性药物白藜芦醇预孵化后,白藜芦醇会提前占据酪氨酸酶的活性位点。此时藤茶提取物中活性成分则无法与酪氨酸酶进一步结合,活性成分的色谱峰面积较样品组则会升高。亲和超滤实验发现,藤茶提取物中化合物1和2的峰面积较空白组(图3-A)有较明显的降低(图3-B)。而在添加了竞争性配体阳性实验中,化合物1和2的峰面积得以恢复(图3-C),因此推测化合物1和2对应的物质与酪氨酸酶发生了特异性结合,可能是潜在的酶抑制剂。图3-B中化合物4的峰面积明显升高,可能是藤茶与酪氨酸酶的催化产物。

A-藤茶溶液 B-藤茶溶液与酶共孵化后 C-藤茶溶液与白藜芦醇预孵化后 D-二氢杨梅素断裂模式
采用超高效液相色谱-高分辨质谱联用方法(UPLC-Q-TOF/MS)对藤茶样品进行分析,根据多级质谱信息,结合天然产物高分辨质谱数据库及相关文献[21-24],从藤茶水提取物中鉴定出15个化合物峰,鉴定结果见表2。化合物1(R=3.74 min)在一级全扫描质谱中/319.046 0 [M-H]−、193.014 3和125.024 7碎片离子分别是母离子按照图3-D断裂模式产生的。以上数据结合文献信息[23],推测化合物1为二氢杨梅素。化合物2(R=4.71 min)在一级全扫描质谱中/319.046 5 [M-H]−,是二氢杨梅素的同分异构体。结合文献信息[21],推测化合物2为二氢杨梅素差向异构体(2,3)-5,7,3′,4′,5′-五羟基二氢黄酮醇;化合物5、7、14、15分别为黄酮类化合物花旗松素、杨梅苷、槲皮苷及杨梅素;化合物3、6、8~13分别为化合物1或(和)2的二聚体,8个化合物均为同分异构体。
3.4 活性成分二氢杨梅素对酪氨酸酶的抑制活性验证
体外活性试验进一步验证二氢杨梅素对单酚酶、二酚酶均有明显的抑制作用,结果见表1。通过计算,二氢杨梅素抑制单酚酶及双酚酶的IC50值分别为37.73、18.87 µg/mL,阳性对照组熊果苷抑制单酚酶及双酚酶的IC50值分别为117.6、1181 µg/mL,表明二氢杨梅素是对单酚酶和双酚酶的抑制效果更强,并呈现剂量依赖性。
3.5 活性成分二氢杨梅素对酪氨酸酶的抑制可逆性测定
图4表示在不同浓度的二氢杨梅素体系中,酶促反应速率(Δ)与酪氨酸酶浓度关系的5条直线均相交。且随着二氢杨梅素浓度的增加,直线的斜率不断减少,由此可以说明二氢杨梅素对酪氨酸酶的抑制作用是可逆的。二氢杨梅素与酪氨酸酶结合导致酪氨酸酶活力被抑制,使其催化速率降低。

表2 藤茶样品成分分析结果

a~e-质量浓度20、40、60、80、100 μg·mL−1的二氢杨梅素
3.6 二氢杨梅素对酪氨酸酶荧光光谱的影响分析
荧光分光光度法是一种用于研究蛋白质与小分子相互作用及蛋白质结构的方法。在280 nm的激发波长下,含有Phe、Tyr和Trp的蛋白质会发射荧光,被称为蛋白质的内源性荧光,当蛋白质与小分子发生相互作用,或蛋白质结构发生变化时,由于其荧光对环境非常敏感,会发生荧光猝灭现象[25]。
图5为二氢杨梅素与酪氨酸酶相互作用的同步荧光谱图。如图5所示,酪氨酸酶在波长320 nm处有较强的荧光峰,二氢杨梅素及反应体系中的溶剂荧光强度均很弱,不影响酪氨酸酶的荧光发射光谱。但随着体系中二氢杨梅素浓度的增大,能够有规律猝灭酪氨酸酶的内源荧光,荧光峰更为平缓,说明二氢杨梅素与酪氨酸酶发生了相互作用。而发射峰的位置没有发生变化,说明酪氨酸酶的色氨酸残基本身没有变化。
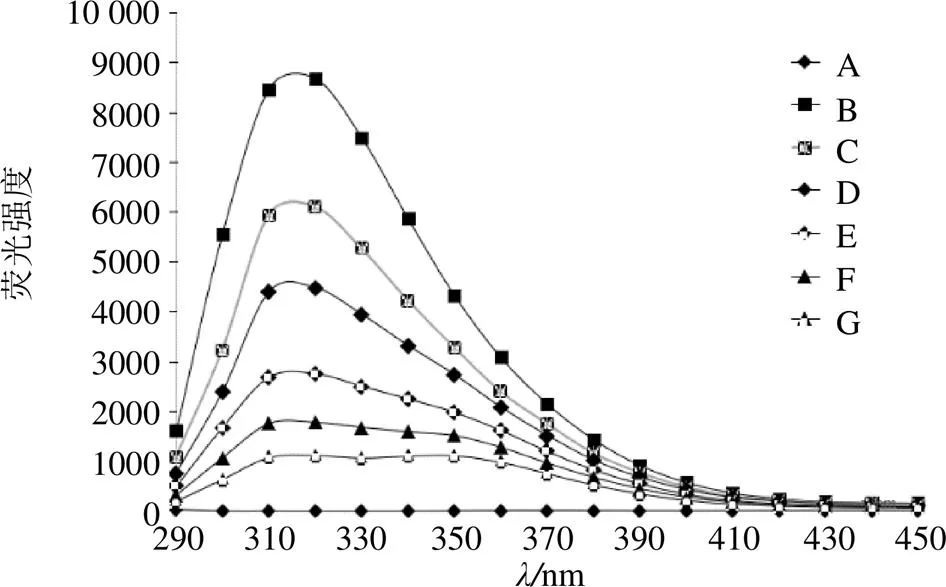
A-二氢杨梅素 B~G-酪氨酸酶(100 U·mL−1)+二氢杨梅素0, 10, 20, 30, 40, 50 μL
3.7 二氢杨梅素对酪氨酸酶圆二色谱的影响
圆二色谱法是一种用于分析溶液中大分子二级结构的方法[26],它突破了X射线生理状态下的情况。蛋白质的旋光性源于其组分的不对称性,如α-螺旋、β-折叠等二级结构均为不对称的立体结构[27]。如图6所示,酪氨酸酶在波长208、222 nm左右有明显的负峰,这是蛋白质二级结构中α-helix的特征峰[28]。随着二氢杨梅素的加入,圆二色谱光谱强度逐渐减小,谱图向零水平移动,但峰位几乎没有改变,表明二氢杨梅素对酪氨酸酶的构象产生了一定的影响[29-30]。

图6 二氢杨梅素对酪氨酸酶圆二色谱的影响
3.8 二氢杨梅素与酪氨酸酶的分子对接研究
对接结果表明,二氢杨梅素能进入酪氨酸酶的疏水腔(如图7),靠近酪氨酸酶的铜离子活性位点。His244、Met280、Glu256、Asn260与二氢杨梅素的3C-OH、7C-OH、4C=O、3′C-OH形成4个氢键,键长分别为0.22、0.179、0.316、0.274 nm,表明氢键是二氢杨梅素与酪氨酸酶结合的一种重要作用力。此外,从图中还可以看出,二氢杨梅素的6C-OH还与Val248和Asn260均有疏水作用,His263和Phe264分别与二氢杨梅素的A环、B环存在π-π堆积作用。从对接结果可推测,二氢杨梅素抑制酪氨酸酶活性机制可能表现在以下2方面:(1)二氢杨梅素进入酪氨酸酶疏水腔,可能形成空间位阻效应,阻碍其他底物靠近活性口袋;(2)二氢杨梅素在活性中心部位与氨基酸残基发生非共价结合,改变酶活性中心的构象,导致酶活性受到影响。
3.9 二氢杨梅素对B16小鼠黑色素瘤细胞活性及黑色素形成的影响
由图8可知,阳性药物熊果苷及二氢杨梅素2种化合物能明显抑制B16黑色瘤细胞的增殖。阳性药物熊果苷及二氢杨梅素浓度与黑色素的生成有明显的量效关系。随着待测物浓度的增加,对黑色素生成的抑制作用越大,呈正相关。
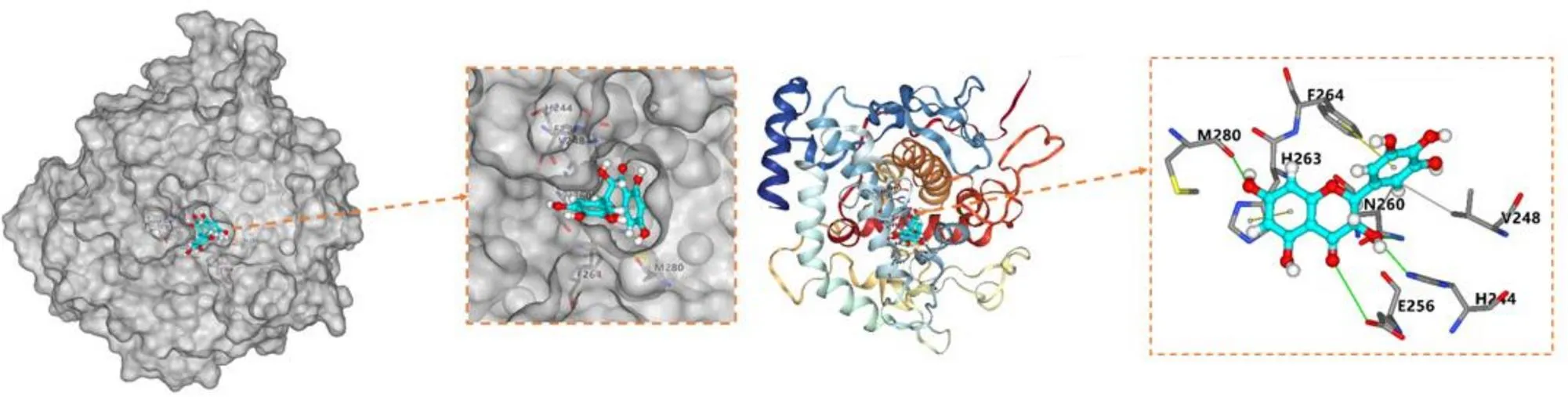
图7 二氢杨梅素与酪氨酸酶的分子对接
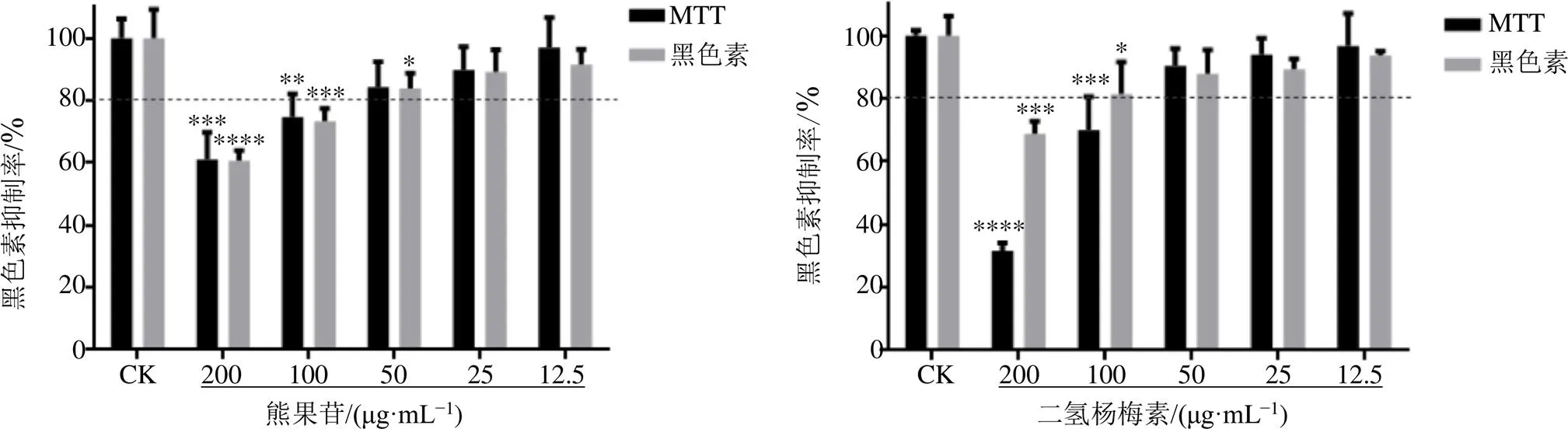
与空白组(CK)比较,*P<0.05 **P<0.01 ***P<0.001 ****P<0.000 1
4 讨论
本研究在体外提取物活性评价的基础上,采用UF-UPLC-MS技术筛选藤茶中酪氨酸酶抑制剂的活性成分。该方法操作简单,无需对化学成分进行常规的分离鉴定,为从植物中快速筛选酪氨酸酶抑制剂提供了一种简洁有效的方法利用UF-UPLC- MS技术从藤茶提取物中筛选到二氢杨梅素为潜在的抑制酪氨酸酶活性成分,体外酶活性试验也显示随着化合物浓度的升高,其抑制作用逐渐增强,且在一定质量浓度范围内呈良效抑制关系。通过荧光分光光度法、圆二色谱分光光度法和分子对接技术,推测二氢杨梅素可进入酪氨酸酶活性中心,引起酪氨酸酶二级结构的改变,从而降低酶的活性。进一步的细胞试验也验证二氢杨梅素能抑制黑色瘤细胞生长,抑制黑色素合成。该研究结论可为开发新的酪氨酸酶抑制剂提供参考依据。
利益冲突 所有作者均声明不存在利益冲突
[1] 冉京燕, 方建国, 谢雪佳, 等. 藤茶的本草资源学研究概况 [J]. 中草药, 2016, 47(20): 3728-3735.
[2] 诸国本. 《土家族医学研究新论》序 [J]. 中国民族医药杂志, 2007, 13(2): 48.
[3] 王婉莹. 藤茶传统药物学及抗氧化活性的初步研究 [D]. 北京: 北京协和医学院, 2014.
[4] 刘慧颖, 崔秀明, 刘迪秋, 等. 显齿蛇葡萄的化学成分及药理作用研究进展 [J]. 安徽农业科学, 2016, 44(27): 135-138.
[5] 冯淳, 张妮, 周大颖, 等. HPLC测定显齿蛇葡萄叶中4种黄酮类化合物的含量 [J]. 食品工业科技, 2018, 39(24): 240-245.
[6] 白秀秀, 夏广萍, 赵娜夏, 等. 张家界产莓茶中的酚性化学成分 [J]. 中药材, 2013, 36(1): 65-67.
[7] Halaouli S, Asther M, Kruus K,. Characterization of a new tyrosinase fromspecies with high potential for food technological applications [J]., 2005, 98(2): 332-343.
[8] Shi S Y, Peng M J, Zhang Y P,. Combination of preparative HPLC and HSCCC methods to separate phosphodiesterase inhibitors frombark guided by ultrafiltration-based ligand screening [J]., 2013, 405(12): 4213-4223.
[9] Priya Rani M, Padmakumari K P. HPTLC and reverse phase HPLC methods for the simultaneous quantification andscreening of antioxidant potential of isolated sesquiterpenoids from the rhizomes of[J]., 2012, 904: 22-28.
[10] Mulabagal V, Calderón A I. Development of an ultrafiltration-liquid chromatography/mass spectrometry (UF-LC/MS) based ligand-binding assay and an LC/MS based functional assay forshikimate kinase [J]., 2010, 82(9): 3616-3621.
[11] Yang Y, Liang X, Jin P,. Screening and determination for potential acetylcholinesterase inhibitory constituents from ginseng stem-leaf saponins using ultrafiltration (UF)-LC-ESI-MS2[J]., 2019, 30(1): 26-33.
[12] Zhang H, Zhang X J, Jiang H J,. Screening and identification of α-glucosidase inhibitors from Shenqi Jiangtang Granule by ultrafiltration liquid chromatography and mass spectrometry [J]., 2018, 41(3): 797-805.
[13] Chen Y S, Lee S M, Lin C C,. Kinetic study on the tyrosinase and melanin formation inhibitory activities ofyellow isolated fromL [J]., 2013, 115(3): 242-245.
[14] 王苗苗, 严欢, 田合, 等. 薰衣草提取物的体外抗氧化活性及酶抑制活性研究 [J]. 食品工业科技, 2019, 40(16): 14-20,26.
[15] 张国文, 宋欣, 曾霓. 根皮素对酪氨酸酶活性与构象的影响[J]. 南昌大学学报: 理科版, 2018(6): 557-562.
[16] 尹燕霞, 向本琼, 佟丽. 荧光光谱法在蛋白质研究中的应用 [J]. 实验技术与管理, 2010, 27(2): 33-36,40.
[17] Fan M H, Zhang G W, Hu X,. Quercetin as a tyrosinase inhibitor: Inhibitory activity, conformational change and mechanism [J]., 2017, 100(Pt 1): 226-233.
[18] 马姣. 酪氨酸酶抑制剂的筛选及其作用机理的研究 [D]. 郑州: 郑州大学, 2018.
[19] Arung E T, Matsubara E, Kusuma I W,. Inhibitory components from the buds of clove () on melanin formation in B16 melanoma cells [J]., 2011, 82(2): 198-202.
[20] Wang Z, Hwang S H, Huang B,. Identification of tyrosinase specific inhibitors fromfruit extract using ultrafiltration-high performance liquid chromatography [J]., 2015, 1002: 319-328.
[21] Carneiro R C V, Ye L Y, Baek N,. Vine tea (): A review of chemical composition, functional properties, and potential food applications [J]., 2021, 76: 104317.
[22] Gao Q, Ma R, Chen LAntioxidant profiling of vine tea (): Off-line coupling heart-cutting HSCCC with HPLC-DAD-QTOF-MS/MS [J]., 2017, 225(15):55-61.
[23] 吴佳, 叶文卉, 卢宗元, 等. 藤茶不同部位指纹图谱及其差异研究 [J]. 天然产物研究与开发, 2020, 32(9): 1507-1514.
[24] 程丹, 畅洪昇, 王旭, 等. 超高压液相色谱/线性离子阱-静电场轨道阱高分辨质谱法鉴定锁阳有效部位的化学成分[J]. 世界中医药, 2019, 14(2): 306-310.
[25] Zhang Y Z, Zhou B, Zhang X P,. Interaction of malachite green with bovine serum albumin: Determination of the binding mechanism and binding site by spectroscopic methods [J]., 2009, 163(2/3): 1345-1352.
[26] 李冬梅. 蛋白质圆二色谱解析研究 [D]. 北京: 中国农业大学, 2001.
[27] Wang Q, Zhang Y H, Sun H J,. Study of interaction of butyl-hydroxybenzoate with human serum albumin by molecular modeling and multi-spectroscopic method [J]., 2011, 131(2): 206-211.
[28] Zhang C, Zhang G W, Pan J H,. Galangin competitively inhibits xanthine oxidase by a Ping-pong mechanism [J]., 2016, 89(Pt 1): 152-160.
[29] Tian Z, Zang F, Luo W,. Spectroscopic study on the interaction between mononaphthalimide spermidine (MINS) and bovine serum albumin (BSA) [J]., 2015, 142: 103-109.
[30] Liu M, Zhang W, Wei J T,. Synthesis and α-glucosidase inhibitory mechanisms of bis (2, 3- dibromo-4, 5-dihydroxybenzyl) ether, a potential marine bromophenol α-glucosidase inhibitor [J]., 2011, 9(9): 1554-1565.
Screening and identification of natural inhibitors of tyrosinase fromusing ultra-filtration affinity-liquid chromatography-mass spectrometry
ZHOU Hui-ji1, ZHANG Lu1, LI Ting-zhao1, 2, LI Bo1, 2
1. Amway (China) R&D Center, Shanghai 201203, China 2. Amway (China) Botanical R&D Center, Wuxi 214145, China
To screen tyrosinase inhibitors from the leaf extract of(vine tea) by ultra-filtration affinity-liquid chromatography-mass spectrometry (UF-LC-MS) technique combined with enzyme activity.The inhibitory activity of vine tea extract was evaluated by enzyme activity test. Meanwhile one major component from vine tea was screened by UF-LC-MS and identified as potential tyrosinase inhibitor, which was identified as dihydromyricetin. The molecular mechanism of dihydromyricetin on tyrosinase was further studied byfluorescence spectroscopy, circular dichroism and molecular docking techniques.The tyrosinase inhibitor was identified as dihydromyricetin, and IC50of monophenolase and diophenolase were 37.73 μg/mL and 18.87 μg/mL, respectively. The docking results demonstrated that dihydromyricetin entered the active center of tyrosinase, forming four hydrogen bonds with the amino acid residues, and changed the conformation of the active center, which lead to inactivation of tyrosinase. In addition, dihydromyricetin could significantly inhibit the proliferation of B16 melanoma cells, then dramatically reduce the synthesis of melanin.Our research provided theoretical reference for screening natural and high affinity tyrosinase inhibitors from herbal medicines by using UF-LC-MS and molecular docking, which could provide a basis for the subsequent research and development of vine tea and dihydromyricetin for the treatment of skin pigmentation diseases.
UF-LC-MS;(Handel- Mazzetti) W. T. Wang; dihydromyricetin; tyrosinase; molecular docking; B16 melanoma cell
R284.1
A
0253 - 2670(2021)22 - 6796 - 10
10.7501/j.issn.0253-2670.2021.22.004
2021-03-24
国家重点研发计划中医药现代化研究重点专项(2018YFC1706800)
周慧吉(1990—),硕士研究生,研究方向为天然产物开发。Tel: (021)23056907 E-mail: cassie.zhou@amway.com
通信作者:李 波,博士,研究方向为天然产物开发。Tel: (021)23056985 E-mail: robert.li@amway.com
[责任编辑 王文倩]

