固定化酶技术在中药酶抑制剂筛选中的研究现状
安 琼,李国峰,郎一帆,杨武亮,陈春兰,张武岗,陈海芳*
固定化酶技术在中药酶抑制剂筛选中的研究现状
安 琼1,李国峰1,郎一帆1,杨武亮1,陈春兰1,张武岗2*,陈海芳1*
1.江西中医药大学现代中药制剂教育部重点实验室,江西 南昌 330004 2.江西中医药大学中药固体制剂制造技术国家工程研究中心,江西 南昌 330004
固定化酶技术是利用物理或化学方法将游离酶固定在相应的载体上用于筛选酶抑制剂的方法,该方法选择性高、稳定性好。基于疾病相关靶点—生物酶,采用固定化酶技术从中药中筛选疾病相关酶抑制剂,有望成为中药新药研发的重要手段。以固定化酶应用的载体材料为分类综述了近十年来固定化酶技术用于筛选中药中酶抑制剂的研究现状,以期为后续的相关研究提供理论基础。
固定化酶;生物酶;中药;载体材料;筛选;酶抑制剂
中药资源丰富,历史悠久,在预防与治疗疾病中扮演着重要的角色。然而,中药的化学成分多种多样,作用机制更是复杂多样,如何从中药中筛选疾病相关药效物质是当前亟待解决的关键问题。大量研究表明,人体许多疾病过程都与体内生物酶调节作用相关,如痛风[1]、阿尔茨海默症[2]、糖尿病[3-5]等。而且,中药在治疗各种疾病中也扮演着重要角色,如白芷提取物能促进新生血管形成与成熟,从而提高自发2型糖尿病小鼠创面愈合速率和质量[6];绞股蓝叶水提物能够降低链脲佐菌素诱导的糖尿病大鼠的血糖,其作用机制可能与增加骨骼肌肌膜葡萄糖转运体4蛋白表达和抑制骨骼肌炎症有关[7]。因此,基于酶在疾病发生发展的重要性,以酶为靶点从中药中筛选新药是一有力途径,而且开发一种快速、高效的酶抑制剂筛选方法是当前首要任务。
固定化酶技术是20世纪60年代发展起来的,该技术利用物理或化学方法将游离酶固定在相应的载体上用于筛选酶抑制剂。固定化酶技术可以有效提高酶的催化性能和操作稳定性,并降低成本,是目前广泛使用的技术[8]。此外,相比于游离酶,固定酶更有利于酶-配合物的分离纯化,在pH耐受性,底物选择性,热稳定性和可回收性等方面表现出优越的性能[9-10]。不同的酶发挥催化作用的活性部位不同,将酶进行固定时,要使载体材料与酶的非活性部位结合,才可以保留酶的活性,因此载体材料的选择是固定化酶技术发挥作用的关键。本文以固定载体材料(表1)为分类综述了近10年固定化酶技术在中药酶抑制剂[α-葡萄糖苷酶(α-glucosidase,α-Glu)、脂肪酶等] 筛选中的研究现状,希望可以为后续的相关研究提供一定的参考依据。
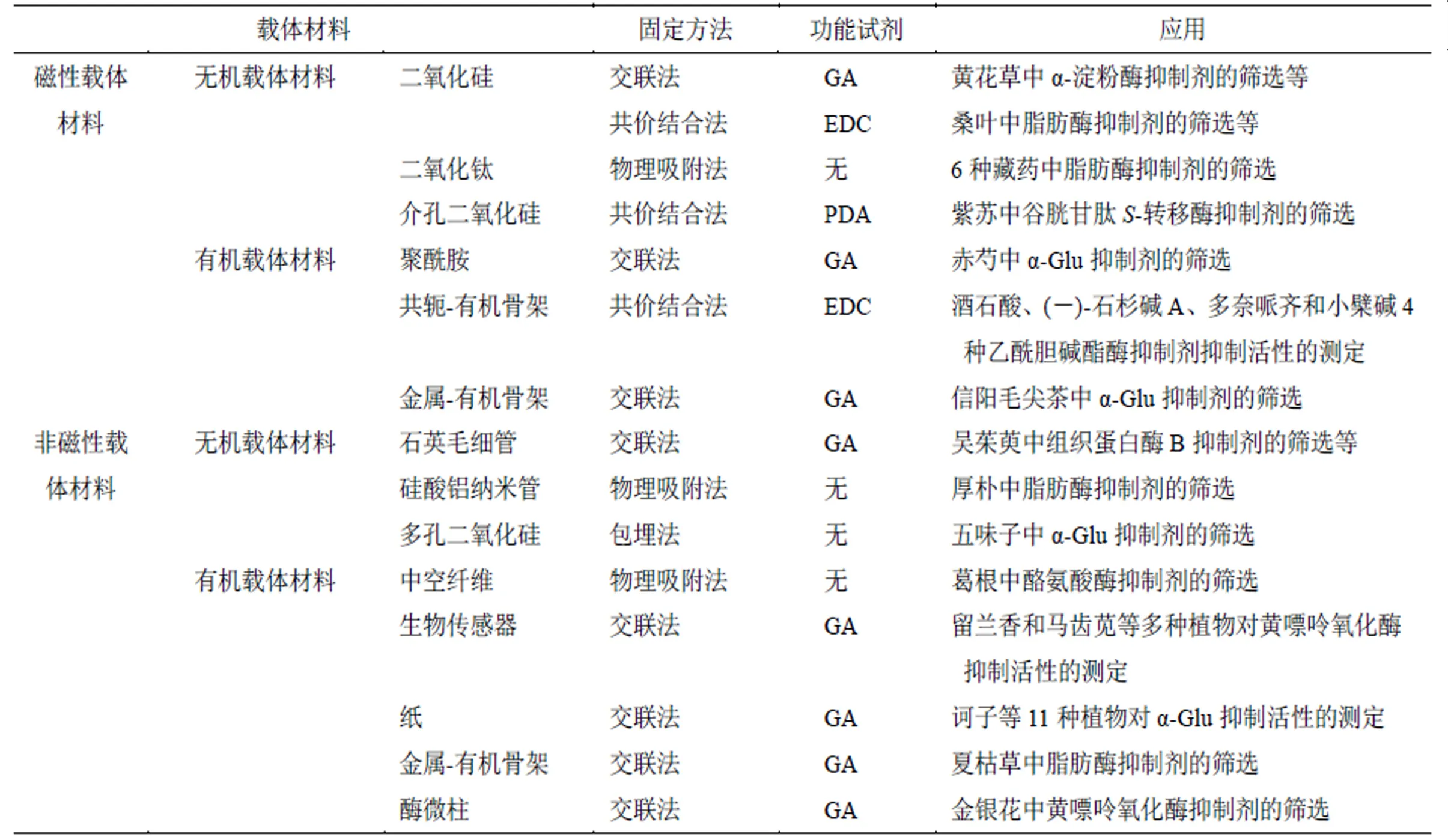
表1 固定化载体材料
GA-戊二醛 PDA-聚多巴胺 EDC-1-(3-二甲基氨丙基)-3-乙基羰基二胺甲碘
GA-glutaric dialdehyde PDA-polydopamine EDC-1-(3- dimethylaminopropyl)-3-ethylcarbodiimide
1 磁性载体
磁性载体材料是利用铁、锰、钴及其氧化物等化合物制备的一类具有磁性的材料[11],通过改变磁力大小和外部磁场的方向来改变粒子的运动轨迹,从而使酶与载体的结合与分离可以在可控条件下完成,便于固定化酶的分离和收集,并用于酶抑制剂的筛选[12]。以磁性载体为材料的固定化酶技术的最大优点在于利用磁力吸引可使固定化酶快速从反应体系中分离,且固定化方法简单,能有效减少筛选时间及实验试剂的消耗。因此,通过不同方法对磁性载体材料进行功能化修饰,在充分发挥磁性材料优势的基础上改善其表面性质,提高对不同类型目标物的特异性,从而在各类复杂样品的前处理过程中有着良好的应用潜力[13]。目前,磁珠是近年来发展起来的一种常用的磁性载体材料,也叫做磁性纳米粒子,包括氧化铁(Fe3O4和γFe2O3)、合金(CoPt3和FePt)等。其中,Fe3O4纳米粒子具有生物相容性和无毒性等优点,被广泛应用于酶的固定化。中药酶抑制剂筛选中的常用磁珠其磁核以Fe3O4纳米粒子为主,壳层为二氧化硅、琼脂糖、葡聚糖等,是具有超顺磁性的小球形磁性粒子[14-15],可借助外部磁场从生物催化体系中分离酶抑制剂。该方法机械稳定性高、孔隙率低,利于降低反应中的传质阻力,提高了固定化酶的重复使用性。由于其具有操作稳定性高、磁响应强、磁分离速度快等优点,在生物和药物研究中得到了广泛的应用[16]。在进行酶抑制剂筛选时,磁珠的修饰位置不同,所固定的位点也不同。因此,在实验中,往往要根据靶蛋白的分子结构选择合适的磁珠或将某一磁珠进行修饰后作为固定载体。将酶固定在合适的磁珠上会增强酶与待筛选酶抑制剂的亲和力,利用磁力将固定化酶及其抑制剂从提取液中分离,然后洗去与酶不相互作用的化合物,随后可得到酶固定化磁珠配体配合物,最后通过洗脱溶剂使配体释放进而通过质谱表征[17]。在这种方法中,潜在的配体与酶相互作用,生成酶配体配合物,这有利于利用磁性[18-23]从复杂混合物中分离活性化合物。在酶抑制剂的筛选中,磁性载体材料是最常用的固定化载体材料[24-30]。
1.1 无机载体材料
二氧化硅是磁性纳米粒子表面修饰最常用的无机材料[23,31-34],此外还有二氧化钛[35]、介孔二氧化硅[16]等。Li等[23]首先将Fe3O4分散在水中加入聚乙烯吡咯烷酮(polyvinylpyrrolidone,PVP)室温搅拌得到产物。然后在超声作用下将产物分散在含有异丙醇和氨水的混合溶剂中,室温搅拌下缓慢加入正硅酸乙酯(tetraethyl orthosilicate,TEOS)溶液得到SiO2@Fe3O4磁性微球,并加入3-氨丙基三甲氧基硅烷(3-aminopropyltrimethoxysilane,ATPES)对其表面进行改性。最后将α-淀粉酶固定在表面改性的SiO2@Fe3O4磁性微球上。将制得的酶固定化磁性微球用于黄花草中α-淀粉酶抑制剂的筛选,最终得到3种黄酮类化合物对α-淀粉酶具有较好抑制作用。Liu等[35]采用溶剂热法(也称水热法或水热合成法)制备了Fe3O4@TiO2纳米粒子,并通过静电相互作用固定脂肪酶。采用透射电镜、傅里叶变换红外光谱和X射线衍射等方法对磁性纳米粒子进行表征,以确定脂肪酶是否已经被固定。研究中应用脂肪酶固定化Fe3O4@TiO2纳米粒子从6种具有脂肪酶抑制活性的藏药中筛选出脂肪酶抑制剂,获得5种具有与临床常用减肥药物奥利司他活性类似的化合物,其中1种化合物(山柰酚)的抑制活性优于奥利司他。Yi等[16]将谷胱甘肽S-转移酶固定在介孔二氧化硅磁性微球表面筛选紫苏中的酶抑制剂,利用高效液相色谱和四极飞行时间质谱法进行鉴定,筛选出6种具有谷胱甘肽-转移酶抑制作用的物质,其中,迷迭香酸、(−)表没食子儿茶素-3-没食子酸酯和(−)-表儿茶素-3-没食子酸酯具有较好的抑制活性。最后利用分子对接技术确定潜在抑制剂与谷胱甘肽-转移酶的结合方式。首先,用FeCl3与柠檬酸三钠和乙酸钠合成Fe3O4,然后将其分散在含有乙醇、去离子水和氨水的混合溶液中,搅拌均匀后加入TEOS制得SiO2@Fe3O4磁性微球。为进一步合成介孔二氧化硅磁性微球(mSiO2@SiO2@Fe3O4),将SiO2@Fe3O4磁性微球分散在十六烷基三甲基氯化铵、去离子水和三乙醇胺中并滴加TEOS,产物用磁铁分离并清洗除杂后得mSiO2@SiO2@Fe3O4磁性微球。最后用PDA对mSiO2@SiO2@Fe3O4磁性微球进行表面改性并将谷胱甘肽-转移酶固定在其表面。
1.2 有机载体材料
在酶抑制剂的筛选中,有机载体材料相比于无机载体材料应用较少。目前,用于磁性纳米粒子表面修饰的有机载体材料有聚酰胺(polyamidoamine,PAMAM)[36]、共轭-有机骨架[37]和金属-有机骨架[38]等。Jiang等[36]以PAMAM包覆磁性微球为基础,建立了一种筛选和鉴定赤芍提取物中α-Glu抑制剂的方法。首先,采用微修饰法合成了Fe3O4-COOH微球。然后,通过Fe3O4-COOH微球表面羧基与PAMAM氨基的偶联反应,制备了Fe3O4@PAMAM微球。最后,通过GA的交联,成功地将α-Glu连接到其表面。结果表明,没食子酸和(+)-儿茶素对α-Glu均具有较好抑制作用。Zhao等[37]将乙酰胆碱酯酶(acetylcholinesterase,AchE)固定在适配体功能化磁性纳米颗粒共轭有机骨架上构建固定化酶反应器,并将该方法用于酒石酸、(−)-石杉碱A、多奈哌齐和小檗碱4种AchE抑制剂抑制活性的测定,发现酒石酸的IC50与已报道的结果相当,证明了该固定化酶反应器的可行性。Wu等[38]将α-Glu固定在磁性纳米材料Fe3O4@ZIF-67上,构建了快速筛选α-Glu抑制剂的生物微反应器。然后,将酶生物微反应器通过外加磁场固定在连接高效液相色谱仪(high performance liquid chromatography,HPLC)和微注射泵2端的管中,形成一个磁性在线筛选系统。以信阳毛尖粗茶提取物为实验对象,对该在线筛选方法进行验证,利用该在线筛选系统筛选出3种抑制剂(儿茶素、表没食子儿茶素没食子酸酯和表没食子酸酯)。与传统方法相比,该方法可将筛选、洗脱和分析结合起来,可以简单、高效、直接地从天然来源筛选和鉴定潜在的α-Glu抑制剂。
磁珠分散性好,磁分离速度快,酶结合量大,酶活性高,是固定化酶的理想载体,现已广泛应用于酶抑制剂的筛选中。将酶固定在特定的磁珠上,可实现酶抑制剂的分离。此方法操作较稳定,非特异性结合率低。因此,酶固定化磁珠技术因其快速的生物分析、导向性分离和从复杂混合物中直接捕获配体而受到越来越多的关注。
2 非磁性载体
2.1 无机载体材料
2.1.1 石英毛细管 毛细管电泳(capillary electrophoresis,CE)具有分离效率高、分析速度快、操作简单和样品消耗少以及可与多种检测手段联用等优点,在酶分析研究中越来越受到关注[39-41]。近年来,固定化酶微反应器与生物活性靶向技术相结合已应用于中药酶抑制剂的筛选[42]。该方法将酶固定在经过修饰的石英毛细管内,捕获抑制剂后,洗涤未结合组分,进而通过蛋白质变性洗脱活性结合配体,允许直接并可重复注射生物样品到高效液相色谱上进行检测,筛选和分离一步完成,大大缩短了操作时间。但该方法制备过程中是比较复杂繁琐的[43-44],而且载体的孔隙率[45]、孔径[46]和表面化学[47-48]等因素也很容易影响固定化酶的性能。
Wu等[49-50]用PDA对石英毛细管进行表面改性,并与氧化石墨烯共聚形成聚多巴胺/氧化石墨烯涂层,增加了固定化酶的结合率,并将该方法成功用于凝血酶和凝血因子Xa以及黄嘌呤氧化酶抑制剂的筛选。有研究者用3-氨基丙基三乙氧基硅烷对石英毛细管进行表面改性,采用戊二醛交联法进行酶的固定,并成功用于酶制剂的筛选。Rodrigues等[51]将此修饰方法用于黄嘌呤氧化酶(xanthine oxidase,XOD)抑制剂的筛选,成功地从不同天然产物中筛选出30个潜在的XOD抑制剂。Zhang等[52]将此修饰方法用于组织蛋白酶B抑制剂筛选,并从中药中发现了17个具有抑菌潜力的活性成分,发现山柰酚等5种天然产物有潜在的抑制作用,并以分子对接进行验证。Tang等[53]将此修饰方法用于脂肪酶抑制剂的在线筛选,结果发现6种天然产物对脂肪酶活性均有抑制作用。Zhao等[54]将此修饰方法用于神经氨酸酶抑制剂的筛选,发现了6种天然产物为潜在抑制剂。进一步测定了这6种化合物对神经氨酸酶潜在的抑制活性,由大到小分别为:甲基补骨脂黄酮A>补骨脂甲素>黄芩素>黄芩苷>白杨素和牡荆素。此外,还有研究者采用单片毛细管固定化酶反应器与液相色谱-串联质谱联用技术,成功用于酶抑制剂的筛选[55-56]。
毛细管的高表面体积比有利于足够高浓度的酶用于酶促反应[57-58]。此外,由于注入的底物溶液直接与固定化酶分子接触,使传统的采样、反应、分离和检测多步操作简化为一步操作,因此该分析变得更简单,不需要额外的混合程序。与磁性载体相比,该技术将筛选和分离集成为一步,大大缩短了操作时间。该技术适用于复杂混合物中酶抑制剂的快速筛选,而且样品消耗量少,节省了试剂成本,可以实现酶抑制剂的快速分离。
2.1.2 硅酸铝纳米管 硅酸铝纳米管(halloysite nanotubes,HNTs)是一种天然存在的硅酸盐纳米管,由于其优异的物理特性,引起了人们越来越多的兴趣。HNTs的内径为20~30 nm,外径为30~50 nm,长度为1~2 µm,为药物、酶和杀菌剂的储存提供了理想的纳米级包埋系统。更重要的是,HNTs的外表面主要由-Si-基团组成,内表面由Al2O3组成,为酶提供了更多的选择性结合位点,从而减少了配体在HNTs上的非特异性吸附[59]。因此,有研究者将HNTs作为一种新的酶固定载体材料用于酶抑制剂的筛选。Wang等[59]通过静电吸附作用将脂肪酶固定到羟基纳米管上用于厚朴中脂肪酶抑制剂的筛选,发现厚朴三酚和厚朴醛B 2种化合物对脂肪酶抑制活性较好。HNTs的内外表面为酶提供了更多的选择性结合位点,降低了非特异性吸附,但其合成较为复杂,收率较低,因此应用有限。
2.1.3 多孔二氧化硅 多孔二氧化硅材料具有表面张力低、粘温系数小、压缩性高、气体渗透性高等基本性质,同时还具有耐高温和低温、电气绝缘、耐氧化稳定性、耐候性、难燃、耐腐蚀、无毒无味以及生理惰性等特性[60]。Hou等[61]首先将α-Glu结合到脂质体囊泡中,然后采用反蒸发法将其负载到多孔二氧化硅表面,制备成受体脂质体生物膜色谱柱,用于五味子提取物的α-Glu抑制剂筛选,并通过体外实验进一步证实了五味子苷的降糖作用。
2.2 有机载体材料
2.2.1 中空纤维 中空纤维是一种具有孔径和内腔的有机聚合物,具有比表面积大、生物材料和有机溶剂消耗低,且设备便宜、用于中空纤维制备的材料来源丰富,是酶、细胞、脂质体等生物材料的理想载体,已被应用于酶固定化中。首先,对中空纤维进行活化。然后,将酶与已活化的中空纤维孵育使酶被吸附在中空纤维上。最后,将待测物与中空纤维固定化酶孵育,筛选待测物中潜在酶抑制剂。Zhao等[62]提出了一种基于吸附中空纤维固定化酪氨酸酶(tyrosinase,TYR)的方法,从葛根提取物中筛选潜在的TYR抑制剂。通过液相色谱-质谱分析,成功地检测出了7种潜在活性化合物,并进一步结合体外实验,发现葛根素、葛根素-6--木糖苷、葛根素和阿片苷具有良好的TYR抑制活性。中空纤维因其具有孔径、内腔及比表面积大等优点,为酶提供了充分的附着空间,但由于其清洗较为困难,导致重复利用率低。
2.2.2 生物传感器 生物传感器是一种对生物物质敏感并可将其浓度转换为电信号进行检测的仪器。丝网印刷电极因其具有批量生产、低成本、高重现性、小尺寸等特点而被广泛应用于分析领域。所谓酶生物传感器法,是将酶固定在经过修饰的丝网印刷电极上,当与抑制剂接触时会发生电信号变化,通过检测电信号的变化,达到分析检测的目的。Elharrad等[63]为筛选药用植物中潜在的XOD抑制剂,研制了一种简便、灵敏的安培生物传感器,并用于测定多种药用植物对黄嘌呤氧化酶的抑制率,发现留兰香和马齿苋2种植物对黄嘌呤氧化酶抑制活性较高。以普鲁士蓝修饰丝网印刷电极表面,极大降低了生物传感器的检测电位,使该装置具有较高的选择性。该传感器具有结构简单、选择性好、成本低、稳定性好、结果快速等优点。
2.2.3 纸 自2007年Whiteside研究小组首次提出微流体装置概念以来,纸作为一种新的载体材料,以其良好的生物相容性、大的比表面积、易于修饰、价格低廉等优点,在环境监测、化学检测、生物医学诊断等领域具有广阔的应用前景[64]。
(1)滤纸:三维打印技术是利用一种纸分析仪器将纸张制作成为一种特殊的微流体装置,该装置成本低,具有较高的比表面积,易于结合分子吸附蛋白质。使用过的纸张设备可以很容易地通过燃烧来处理,可减少实验消耗品造成的污染。Guo等[65]将三维打印技术用于酶抑制剂的筛选,首先,用3D印刷的聚己内酯对滤纸进行改性,形成疏水区。然后,对滤纸进行准确切割,得到既具有亲水性又具有疏水性的改性纸。接下来,用壳聚糖对亲水区进行改性。最后,将α-Glu固定在亲水区,制备出具有独特微流体结构的三维打印技术微装置,并成功地将该方法用于筛选植物提取物中具有α-Glu抑制活性的物质,发现绿原酸、槲皮素-3--葡萄糖醛酸、异槲皮素和槲皮素4种化合物对α-Glu的抑制活性较好。该方法结合一些便携式探测器,如手机和照相机,可以获得定性和定量的结果。因此,很容易判断酶在纸上的固定化效果。
(2)纤维素滤纸:纤维素滤纸(cellulose filter paper,CFP)具有成本低、来源广、表面积大、生物相容性好、表面羟基含量高等优点,被选为新型酶固定化载体,而且CFP可以快速从酶反应混合物中分离并终止反应,从而缩短了操作时间,简化了其他载体(如纳米材料和磁性纳米颗粒)所需的分离过程。Li等[66]以纤维素滤纸为载体,对α-Glu进行固定化。利用多巴胺的自聚-粘附行为,通过希夫碱反应和迈克尔加成反应,将聚多巴胺复合层包覆α-Glu与改性后的CFP共价结合形成固定化酶(CFP/DOPA/α-Glu)。用CFP/DOPA/α-Glu筛选11种中药中的α-Glu抑制剂,发现诃子对α-Glu的抑制作用最强。Zhao等[67]以CFP为载体,以壳聚糖为物理包覆剂引入氨基基团,然后以戊二醛为交联剂,通过希夫碱反应,将AchE与氨基功能化的CFP共价键合进行固定化酶。最后,将CFP固定化AchE应用于17种中药的抑制剂筛选。
2.2.4 金属-有机骨架 金属-有机骨架(metal- organic framework,MOFs)为一种杂化多孔材料,由有机连接体和金属节点通过强的化学键组装而成。MOFs具有可调节孔径、大比表面积和热稳定性等优点。有研究表明,酶被固定在MOFs上后,其在可重用性、催化活性和稳定性方面的性能都有了很大的提高。Chen等[68]首先将ZrCl4和氨基对苯二甲酸溶于,-二甲基甲酰胺溶液中进行超声,然后分别加入HCl和HAc,得到混合物。随后,将混合物转移到不锈钢聚四氟乙烯内衬的高压釜中密封加热,反应混合物在空气中冷却至室温,然后离心。沉淀物用新鲜,-二甲基甲酰胺和无水乙醇洗净,后减压干燥,合成了金属有机骨架UiO-66-NH2。UiO-66-NH2通过沉淀交联固定化猪胰脂肪酶(porcine pancreatic lipase,PPL),得到的PPL@MOF具有较高的PPL载量和相对活力恢复率,并将PPL@MOF复合物用于筛选夏枯草脂肪酶抑制剂,发现了13种潜在的脂肪酶抑制剂。与磁珠、纳米粒子相比,MOFs材料酶固定量大、相对活力恢复率高。
2.2.5 酶微柱 有研究者采用酶微柱法用于酶抑制剂的筛选,该方法属于固相萃取技术,操作简单,可与高效液相色谱耦合,实现了在线筛选,提高了酶抑制剂的筛选和分析效率。首先将硅胶分散在乙醇中,加入3-氨基丙基三乙氧基硅烷形成氨基功能化硅胶,然后将氨基功能化的硅胶与酶液混合,使酶固定在硅胶表面,洗去未结合酶,最后将酶固定化硅胶填入不锈钢微柱中形成酶微柱。Peng等[69]运用该方法成功的从金银花中筛选和鉴定XOD抑制剂。该方法与高效液相色谱的在线耦合提高了筛选和分析效率。与传统的与二维色谱耦合相比,该方法为直接与HPLC耦合,缩短了分析检测时间。
3 总结与展望
中药含有的化学成分复杂、种类繁多、作用机制比较复杂,一直是获取活性成分或者先导化合物的重要来源。以酶为靶标进行药物筛选是发现和寻找新药的重要环节之一。随着固定化酶技术的发展,研究者将固定化酶技术与中药酶抑制剂的筛选相结合,并通过高效液相色谱-质谱联用技术进行鉴定,筛选得到很多具有酶抑制活性的化合物,在一定程度上明确了中药发挥作用的活性成分及其作用机制。本文以不同载体材料为分类,综述了固定化酶技术在中药酶抑制剂筛选中的应用。磁珠是最常用的磁性载体材料,该类材料利用磁力吸引可使固定化酶配体配合物快速从体系中分离,且固定化方法简单,而且使用后的磁珠可以回收利用,能有效减少人力物力的投入。非磁性载体材料主要以石英毛细管应用最为广泛。此外,还有中空纤维、纳米管、生物传感器等材料用于筛选中药中的酶抑制剂,丰富了固定酶的载体材料。固定化酶技术在酶抑制剂筛选上的应用前景十分广泛,不仅节省了人力物力而且提高了新药研发的效率。目前,固定化酶技术仍然存在一些问题,如酶与载体材料的结合率较低、固定化酶的活力也会有所下降等。但相信随着科学技术的不断发展及酶抑制剂研究的不断深入,固定化酶技术会成为酶抑制剂筛选最有前景的方法之一。
利益冲突 所有作者均声明不存在利益冲突
[1] Robinson P C, Horsburgh S.Gout: joints and beyond, epidemiology, clinical features, treatment and co-morbidities [J]., 2014, 78(4): 245-251.
[2] Semenov V E, Zueva I V, Mukhamedyarov M A,.Novel acetylcholinesterase inhibitors based on uracil moiety for possible treatment of alzheimer disease [J]., 2020, 25(18): E4191.
[3] Özenver N, Güvenalp Z, Kuruüzüm-Uz A,.Inhibitory potential on key enzymes relevant to type II diabetes mellitus and antioxidant properties of the various extracts and phytochemical constituents fromL [J]., 2020, 44 (10):1-12.
[4] Petersen M J, de Cássia Lemos Lima R, Kjaerulff L,.Immobilized α-amylase magnetic beads for ligand fishing: Proof of concept and identification of α-amylase inhibitors in[J]., 2019, 164: 94-101.
[5] 卢伟炽, 许帅, 朱章志, 等.2型糖尿病中医临床路径的应用效果[J].世界中医药, 2019, 14(6): 1594-1597.
[6] 雷思思, 胡志波, 郭俊, 等.白芷提取物促糖尿病溃疡新生血管成熟作用及机制研究 [J].中草药, 2020, 51(12): 3223-3233.
[7] 王同壮, 王尚, 马朋, 等.绞股蓝叶水提物对糖尿病大鼠降血糖作用研究 [J].中草药, 2020, 51(10): 2828-2834.
[8] Kim K, Lee E.Environmentally-benign dimethyl carbonate-mediated production of chemicals and biofuels from renewable bio-oil [J]., 2017, 10(11): 1790.
[9] Ansari S A, Husain Q.Potential applications of enzymes immobilized on/in nano materials: A review [J]., 2012, 30(3): 512-523.
[10] Meryam Sardar R A.Enzyme immobilization: An overview on nanoparticles as immobilization matrix [J]., 2015, 4(2): 1-8.
[11] 刘涛.磁性纳米颗粒定向固定化脂肪酶及其应用研究 [D].武汉: 华中科技大学, 2013.
[12] 邓涛, 余旭亚, 徐军伟.磁性高分子微球固定化脂肪酶的研究进展 [J].化工新型材料, 2013, 41(11): 4-6.
[13] 李菲, 吴昊宬, 李一峻, 等.功能化磁性纳米材料在样品前处理中的应用研究进展 [J].色谱, 2020, 38(1): 2-13.
[14] Ruffert C.Magnetic bead—magic bullet [J]., 2016, 7(2): 21.
[15] Muzzio M, Li J R, Yin Z Y,.Monodisperse nanoparticles for catalysis and nanomedicine [J]., 2019, 11(41): 18946-18967.
[16] Yi R X, Fu R J, Li D P,.Identification of ligands from natural products as inhibitors of glutathione S-transferases using enzyme immobilized mesoporous magnetic beads with high-performance liquid chromatography plus quadrupole time-of-flight mass spectrometry and molecular docking [J]., 2019, 42(24): 3611-3620.
[17] Zhuo R J, Liu H, Liu N N,.Ligand fishing: A remarkable strategy for discovering bioactive compounds from complex mixture of natural products [J]., 2016, 21(11): 1516.
[18] Cieśla Ł, Moaddel R.Comparison of analytical techniques for the identification of bioactive compounds from natural products [J]., 2016, 33(10): 1131-1145.
[19] Zhang A Z, Ye F G, Lu J Y,.Screening α-glucosidase inhibitor from natural products by capillary electrophoresis with immobilised enzyme onto polymer monolith modified by gold nanoparticles [J]., 2013, 141(3): 1854-1859.
[20] Liu D M, Chen J, Shi Y P.Screening of enzyme inhibitors from traditional Chinese medicine by magnetic immobilized α-glucosidase coupled with capillary electrophoresis [J]., 2017, 164: 548-555.
[21] Wubshet S G, Brighente I M, Moaddel R,.Magnetic ligand fishing as a targeting tool for HPLC-HRMS-SPE-NMR: α-glucosidase inhibitory ligands and alkylresorcinol glycosides from[J]., 2015, 78(11): 2657-2665.
[22] Tao Y, Zhang Y F, Cheng Y Y,.Rapid screening and identification of α-glucosidase inhibitors from mulberry leaves using enzyme-immobilized magnetic beads coupled with HPLC/MS and NMR [J]., 2013, 27(2): 148-155.
[23] Li Y F, Chen Y, Xiao C Y,.Rapid screening and identification of α-amylase inhibitors fromusing enzyme-immobilized magnetic nanoparticles coupled with HPLC and MS [J]., 2014, 960: 166-173.
[24] Wang Z, Li X Q, Chen M H,.A strategy for screening of α-glucosidase inhibitors fromroot bark based on the ligand fishing combined with high-performance liquid chromatography mass spectrometer and molecular docking [J]., 2018, 180: 337-345.
[25] Cheng G R, Pi Z F, Zheng Z,.Magnetic nanoparticles-based lactate dehydrogenase microreactor as a drug discovery tool for rapid screening inhibitors from natural products [J]., 2020, 209: 120554.
[26] Liu L L, Yuan M M, Huang S Q,.Analysis of xanthine oxidase inhibitors fromwith xanthine oxidase immobilized silica coated Fe3O4nanoparticles [J]., 2018, 8(2): 158.
[27] Liu L, Shi S, Zhao H,.Selective fishing and analysis of xanthine oxidase binders from two Fabaceae species by coupling enzyme functionalized core-shell magnetic nanoparticles with HPLC-MS [J]., 2014, 945/946: 163-170.
[28] Zhang Y P, Shi S Y, Chen X Q,.Functionalized magnetic nanoparticles coupled with mass spectrometry for screening and identification of cyclooxygenase-1 inhibitors from natural products [J]., 2014, 960: 126-132.
[29] Wan L H, Jiang X L, Liu Y M,.Screening of lipase inhibitors fromextract using lipase immobilized on magnetic nanoparticles and study on the inhibitory mechanism [J]., 2016, 408(9): 2275-2283.
[30] Zhu Y T, Ren X Y, Yuan L,.Fast identification of lipase inhibitors in oolong tea by using lipase functionalised Fe3O4magnetic nanoparticles coupled with UPLC-MS/MS [J]., 2015, 173: 521-526.
[31] Zhang Y, Wang Q, Liu R,.Rapid screening and identification of monoamine oxidase-A inhibitors fromusing enzyme-immobilized magnetic beads based method [J]., 2019, 1592: 1-8.
[32] Vanzolini K L, Ainsworth S, Bruyneel B,.Rapid ligand fishing for identification of acetylcholinesterase- binding peptides in snake venom reveals new properties of dendrotoxins [J]., 2018, 152: 1-8.
[33] Zhao Y M, Wang L H, Luo S F,.Magnetic beads-based neuraminidase enzyme microreactor as a drug discovery tool for screening inhibitors from compound libraries and fishing ligands from natural products [J]., 2018, 1568: 123-130.
[34] Ma R, Weng H, Liang J.Screening of lipase inhibitors inwith lipase-linked magnetic microspheres by high-performance liquid chromatography and evaluation in diabetic mice [J]., 2016, 39(23): 4474-4483.
[35] Liu J, Ma R T, Shi Y P.An immobilization enzyme for screening lipase inhibitors from Tibetan medicines [J]., 2020, 1615: 460711.
[36] Jiang J, Yu Y, Wang L,.Enzyme immobilized on polyamidoamine-coated magnetic microspheres for α-glucosidase inhibitors screening fromextracts accompanied with molecular modeling [J]., 2019, 195: 127-136.
[37] Zhao L P, Yang G, Li L S,.Aptamer-functionalized magnetic nanoparticles conjugated organic framework for immobilization of acetylcholinesterase and its application in inhibitors screening [J]., 2020, 1140: 228-235.
[38] Wu X R, Qiu B B, Chen Y N,.Online coupling Fe3O4@ZIF-67@α-glucosidase biomicroreactor with high performance liquid chromatography for rapid screening of α-glucosidase inhibitors in tea and their inhibitory activity research [J]., 2020, 1159: 122398.
[39] Schejbal J, Glatz Z.Immobilized-enzyme reactors integrated with capillary electrophoresis for pharmaceutical research [J]., 2018, 41(1): 323-335.
[40] Iqbal J, Iqbal S, Müller C E.Advances in immobilized enzyme microbioreactors in capillary electrophoresis [J]., 2013, 138(11): 3104-3116.
[41] 宋佳一, 李梦琦, 沈昊, 等.基于DNA定向固定化技术构建毛细管固定化酶微反应器的研究进展 [J].色谱, 2020, 38(10): 1206-1210.
[42] Cheng M X, Chen Z L.Recent advances in screening of enzymes inhibitors based on capillary electrophoresis [J]., 2018, 8(4): 226-233.
[43] Ma J F, Liang Z, Qiao X Q,.Organic-inorganic hybrid silica monolith based immobilized trypsin reactor with high enzymatic activity [J]., 2008, 80(8): 2949-2956.
[44] Sakai-Kato K, Kato M, Toyo'oka T.On-line trypsin-encapsulated enzyme reactor by the Sol-gel method integrated into capillary electrophoresis [J]., 2002, 74(13): 2943-2949.
[45] Magner E.Immobilisation of enzymes on mesoporous silicate materials [J]., 2013, 42(15): 6213-6222.
[46] Bayne L, Ulijn R V, Halling P J.Effect of pore size on the performance of immobilised enzymes [J]., 2013, 42(23): 9000-9010.
[47] Kim J, Grate J W, Wang P.Nanostructures for enzyme stabilization [J]., 2006, 61(3): 1017-1026.
[48] Vlakh E G, Tennikova T B.Flow-through immobilized enzyme reactors based on monoliths: I.Preparation of heterogeneous biocatalysts [J]., 2013, 36(1): 110-127.
[49] Wu Z Y, Zhang H, Yang Y Y,.An online dual-enzyme co-immobilized microreactor based on capillary electrophoresis for enzyme kinetics assays and screening of dual-target inhibitors against thrombin and factor Xa [J]., 2020, 1619: 460948.
[50] Wu Z Y, Zhang H, Li F,.Evaluation of xanthine oxidase inhibitory activity of flavonoids by an online capillary electrophoresis-based immobilized enzyme microreactor [J]., 2020, 41(15): 1326-1332.
[51] Rodrigues M V N, Rodrigues-Silva C, Boaventura S,.On-Flow LC-MS/MS method for screening of xanthine oxidase inhibitors [J]., 2020, 181: 113097.
[52] Zhang B, Chen Z.Screening of cathepsin B inhibitors in traditional Chinese medicine by capillary electrophoresis with immobilized enzyme microreactor [J]., 2019, 176: 112811.
[53] Tang Y X, Li W, Wang Y Y,.Rapid on-line system for preliminary screening of lipase inhibitors from natural products by integrating capillary electrophoresis with immobilized enzyme microreactor [J]., 2020, 43(5): 1003-1010.
[54] Zhao H Y, Chen Z L.Screening of neuraminidase inhibitors from traditional Chinese medicines by integrating capillary electrophoresis with immobilized enzyme microreactor [J]., 2014, 1340: 139-145.
[55] Lin H, Zhang C F, Lin Y J,.A strategy for screening trypsin inhibitors from traditional Chinese medicine based on a monolithic capillary immobilized enzyme reactor coupled with offline liquid chromatography and mass spectrometry [J]., 2019, 42(11): 1980-1989.
[56] Wang L, Zhao Y M, Zhang Y Y,.Online screening of acetylcholinesterase inhibitors in natural products using monolith-based immobilized capillary enzyme reactors combined with liquid chromatography-mass spectrometry [J]., 2018, 1563: 135-143.
[57] Cheng M, Chen Z.Trypsin inhibitor screening in traditional Chinese medicine by using an immobilized enzyme microreactor in capillary and molecular docking study [J]., 2017, 40(15): 3168-3174.
[58] Ji X, Ye F, Lin P,.Immobilized capillary adenosine deaminase microreactor for inhibitor screening in natural extracts by capillary electrophoresis [J]., 2010, 82(4): 1170-1174.
[59] Wang H, Zhao X, Wang S,.Fabrication of enzyme-immobilized halloysite nanotubes for affinity enrichment of lipase inhibitors from complex mixtures [J]., 2015, 1392: 20-27.
[60] 贾艳萍, 马姣, 张兰河, 等.多孔二氧化硅材料的应用进展 [J].硅酸盐通报, 2014, 33(12): 3206-3212.
[61] Hou X, Lou X, Guo Q,.Development of an immobilized liposome chromatography method for screening and characterizing α-glucosidase-binding compounds [J]., 2020, 1148: 122097.
[62] Zhao C P, Yin S J, Chen G Y,.Adsorbed hollow fiber immobilized tyrosinase for the screening of enzyme inhibitors fromextract [J]., 2021, 193: 113743.
[63] El Harrad L, Amine A.Amperometric biosensor based on Prussian blue and nafion modified screen-printed electrode for screening of potential xanthine oxidase inhibitors from medicinal plants [J]., 2016, 85: 57-63.
[64] Martinez A W, Phillips S T, Butte M J,.Patterned paper as a platform for inexpensive, low-volume, portable bioassays [J]., 2007, 46(8): 1318-1320.
[65] Guo S X, Lin X T, Wang Y,.Fabrication of paper-based enzyme immobilized microarray by 3D-printing technique for screening α-glucosidase inhibitors in mulberry leaves andleaves [J]., 2019, 14: 13.
[66] Li P, Ma X H, Dong Y M,.α-Glucosidase immobilization on polydopamine-coated cellulose filter paper and enzyme inhibitor screening [J]., 2020, 605: 113832.
[67] Zhao H H, Liu Y Q, Chen J.Screening acetylcholinesterase inhibitors from traditional Chinese medicines by paper-immobilized enzyme combined with capillary electrophoresis analysis [J]., 2020, 190: 113547.
[68] Chen X L, Xue S, Lin Y L,.Immobilization of porcine pancreatic lipase onto a metal-organic framework, PPL@MOF: A new platform for efficient ligand discovery from natural herbs [J]., 2020, 1099: 94-102.
[69] Peng M J, Shi S Y, Chen L,.Online coupling solid-phase ligand-fishing with high-performance liquid chromatography-diode array detector-tandem mass spectrometry for rapid screening and identification of xanthine oxidase inhibitors in natural products [J]., 2016, 408(24): 6693-6701.
Research status of immobilized enzyme technology in screening of enzyme inhibitors of traditional Chinese medicine
AN Qiong1, LI Guo-feng1, LANG Yi-fan1, YANG Wu-liang1, CHEN Chun-lan1, ZHANG Wu-gang2, CHEN Hai-fang1
1.Key Laboratory of Modern Preparation of Traditional Chinese Medicine, Ministry of Education, Jiangxi University of Chinese Medicine, Nanchang 330004, China 2.National Engineering Center for Manufacturing Technology of Solid Preparation in Traditional Chinese Medicine, Jiangxi University of Chinese Medicine, Nanchang 330004, China
Immobilized enzyme technology is a physical or chemical method to fix free enzyme on the corresponding carrier for screening enzyme inhibitors.This method has high selectivity and high stability.Starting from the different pharmacological effects of traditional Chinese medicine (TCM), using disease-related biological enzymes and combining with immobilized enzyme technology to screen related enzyme inhibitors in TCM, this method may become an important means for new drug research and development.In this paper, the research status of immobilized enzyme in the screening of enzyme inhibitors in TCM in recent ten years was reviewed based on the carrier materials used for immobilized enzyme in order to provide a certain theoretical basis for the subsequent research.
immobilized enzyme; biological enzymes; traditional Chinese medicine; carriermaterial; screening; enzyme inhibitor
R28;R283.6
A
0253 - 2670(2021)22 - 7057 - 09
10.7501/j.issn.0253-2670.2021.22.032
2021-02-07
江西省自然科学基金资助项目(20192BAB205109);国家自然科学基金项目(81903917);江西省教育厅项目(GJJ19067);博士启动基金项目(2018WBZR002)
安 琼(1996—),女,硕士研究生,研究方向为中药药效物质基础和作用机制研究。Tel: 17807051975 E-mail: 569946976@qq.com
通信作者:张武岗(1979—),男,副教授,硕士生导师。Tel: 15083551442 E-mail: zwgchf98@foxmail.com
陈海芳(1979—),女,副教授,硕士生导师。Tel: 15350004308 E-mail: chenhf88@126.com
[责任编辑 王文倩]

