胃癌发病关键基因调控网络构建及其靶向治疗中药活性成分筛选研究
宋厚盼,刘恒铭,仇婧玥,冯 瑶,吴嫚婷,喻 昶,熊 萌,曾梅艳
胃癌发病关键基因调控网络构建及其靶向治疗中药活性成分筛选研究
宋厚盼1, 3,刘恒铭2,仇婧玥1, 3,冯 瑶2,吴嫚婷1, 3,喻 昶1, 3,熊 萌1, 3,曾梅艳3*
1.湖南中医药大学中医诊断学湖南省重点实验室,湖南 长沙 410208 2.湖南中医药大学医学院,湖南 长沙 410208 3.湖南中医药大学中医心肺病证辨证与药膳食疗重点研究室,湖南 长沙 410208
通过生物信息学方法分析与胃癌发病密切相关的基因调控网络,探讨其在胃癌预后中的价值,并进一步挖掘靶向治疗胃癌的中药活性成分。通过GEO数据库获取GSE103236胃癌芯片数据,对芯片数据进行均一化处理,分析胃癌组织与正常胃组织的差异表达基因(differentially expressed genes,DEGs);应用Metascape数据库对DEGs进行基因本体论(genetic ontology,GO)和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路分析;通过String数据库构建DEGs蛋白交互作用网络;采用Cytohubba筛选关键基因,分析关键基因表达程度与患者的预后及免疫细胞浸润的相关性;运用CTD数据库筛选能靶向作用于关键DEGs的中药活性成分。共获得45 015个胃癌组织与正常组织的DEGs,其中显著性DEGs 176个。它们与细胞周期过程调控、丝裂原活化蛋白激酶(mitogen activated protein kinases,MAPK)级联调控等生物过程密切相关,集中于细胞外区域、细胞外泌体等细胞组分,主要参与胰岛素样生长因子结合、Wnt蛋白结合等细胞功能。KEGG分析发现显著性DEGs主要参与环磷酸酰胺(cyclic adenosine monophosphate,cAMP)信号通路、磷脂酰肌醇3-激酶/蛋白激酶B(phosphatidylinositide 3-kinases/protein kinase B,PI3K/Akt)信号通路、癌症转录失调、p53信号级联等信号通路。筛选出、、、、、、、、、10个关键基因。这些基因表达异常均与免疫细胞的大范围浸润存在极高的相关性,其中、、、、、6个关键基因的异常表达显著影响患者的生存率。进一步挖掘出桦木酸、长春新碱、丹参酮等30个可能靶向治疗胃癌的中药活性成分。筛选出10个与胃癌发病密切相关的核心基因,并分析了这些核心基因与胃癌患者预后及免疫细胞浸润的相关性;挖掘出30个可能用于胃癌靶向治疗的中药活性成分;研究结果可为胃癌生物标志物的筛选、胃癌的防治及预后分析提供思路和参考。
胃癌;差异表达基因;生物信息学;中药活性成分;免疫细胞浸润;预后分析;桦木酸;长春新碱;丹参酮
胃癌是一种在发生在胃黏膜上皮的恶性肿瘤,我国胃癌的发病率和死亡率分别占世界比例的42.6%和45.0%[1];2019年中国胃癌新发病例约为42.4万,全国胃癌发病率为每千人0.312 8[2],主要集中于中西部等经济欠发达地区[3]。胃癌发病初期患者较少出现自觉症状,偶见的腹胀、消化不良等症状极易被当做普通胃炎进行治疗。随着病情的发展,患者开始出现消瘦、营养不良、腹痛、贫血等症状,到了晚期开始出现黑便、呕血、体质量急剧下降甚至“皮包骨”。手术切除是根治早期胃癌的主要医学手段,但由于早期胃癌难以被发现、诊断、治疗,导致大量患者错过黄金治疗期。胃癌在我国的发病率逐年攀升,给患者及其亲属带来了极大的心理压力及沉重的经济负担。
胃癌是多因素共同作用所导致的恶性肿瘤疾病,现普遍认为幽门螺旋杆菌感染是诱发胃癌最主要的因素,此外还包括不良的饮食习惯、长期食用过量的腌制食品、高盐饮食、遗传易感性、慢性胃炎、微量元素失调等因素[4]。胃癌的主流治疗手段包括手术切除、放疗、化疗、免疫疗法、中医药治疗,对于早期胃癌还可使用创伤更小的内窥镜切除术[4]。
生物信息学分析是通过收集大量生物学芯片数据、高通量测序数据,运用计算机算法系统地对其进行整合、对比、分析,从非编码RNA、mRNA、蛋白等分子层面揭示机体与疾病的相互作用关系。本研究通过挖掘GEO数据库中胃癌基因芯片生物学数据,从分子层面对胃癌的发生发展过程进行研究。通过分析胃癌组织与周围正常组织之间的差异表达基因(differentially expressed genes,DEGs),对基因功能进行富集与分类,通过拓扑学网络分析其重要节点,寻找影响胃癌发病的关键基因。通过对关键基因的免疫细胞浸润以及预后分析综合判定关键基因的表达对患者生存的影响,并进一步发掘出可能通过靶向作用于这些关键基因治疗胃癌的中药活性成分。本研究旨在为胃癌的临床诊断和治疗提供新的思路和方法,为中药抗癌新药及其靶点的研发提供理论依据。
1 材料和方法
1.1 材料来源
登录美国国立生物信息中心(NCBI)的GEO数据库,以“gastric cancer”为关键词找到符合本研究所需的胃癌组织与周围正常组织差异表达基因谱数据集GSE103236,下载该数据集的series matrix文件以获取样本信息(矩阵数据)。本数据集依托于Agilent公司的GPL4133芯片,包含19个样本,其中10个为来源于胃癌患者的组织样本,样本编号为GSM2758661、GSM2758663、GSM2758665、GSM2758667、GSM2758669、GSM2758671、GSM2758673、GSM2758674、GSM2758676、GSM2758678;其余9个为胃癌组织周围的正常组织样本,样本编号为GSM2758660、GSM2758662、GSM2758664、GSM2758666、GSM2758668、GSM2758670、GSM2758672、GSM2758675、GSM2758677。
1.2 实验方法
1.2.1 胃癌组织与周围正常组织DEGs筛选 将数据集GSE103236中的所有样本分2组,一组为胃癌组织样本,一组为周围正常组织。利用GEO 2R分析工具对GSE103236数据集数据进行比较分析,获得胃癌的DEGs。将得到的DEGs以<0.05,|log2FC|>1 [FC表示差异倍数(fold change)] 为条件进行筛选,得到2991个较高相关性DEGs,以此筛选结果绘制DEGs火山图;进一步以<0.01,|log2FC|>2为条件进行筛选,以获得显著性DEGs,以此结果绘制层次聚类热图。
1.2.2 胃癌组织与周围正常组织DEGs基因本体论(genetic ontology,GO)和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析 GO富集分析包括生物学过程(biological process,BP)、分子功能(molecular function,MF)、细胞组分(cell components,CC)3个独立的本体论,其通过建立一套具有动态形态的控制集解释基因及蛋白在细胞内所产生的作用,进而分析出DEGs在BP、MF、CC 3个方面的富集情况。KEGG信号通路分析是以基因组、化学和系统功能信息为基础,预测蛋白在细胞活动中的作用,并对信号通路中的关键基因进行富集。Metascape(https://metascape.org/)是一个可对基因和蛋白组的生物学功能进行注解的资源库,本研究使用Metascape网站对胃癌特异性DEGs进行GO功能富集分析和KEGG通路富集分析,以是否具有统计学意义(<0.05)作为判断显著性DEGs富集的信号通路、BP、MF、CC是否具有特异性的依据。
1.2.3 胃癌组织与周围正常组织DEGs编码蛋白质相互作用(protein-protein interaction,PPI)网络的构建及模块分析 String数据库(https://string-db.org/)可在线分析预测蛋白质之间直接或间接相互作用关系,并可构建PPI可视化网络。将参与GO功能富集和KEGG通路富集的显著DEGs导入String数据库,进行PPI分析;构建并下载显著性DEGs的PPI网络,将其导入Cytoscape软件,去除游离靶点后进行可视化处理及网络拓扑学分析;节点(node)代表基因,边(edge)代表基因之间的相互作用情况;使用Network Analyzer分析蛋白网络的拓扑学特征,得到可以反映每个蛋白与其他蛋白相互作用情况以及作用程度的PPI网络。
1.2.4 与胃癌发病相关的核心基因筛选 CytoHubba是一款Cytoscape的内置插件,根据网络特征对网络中的节点进行排序,提供了11种基于最短路径的拓扑分析方法,包括度、边缘穿透分量、最大邻域分量、最大邻域分量密度、最大集团中心度和6个中心度(瓶颈、边缘中心度、紧密度、径向度、中间度和应力)。CytoHubba可以准确地筛选出网络中的重要节点,其中最大集团中心度(maximal clique centrality,MCC)算法是已被证实的预测重要靶点较为精确的方法。通过使用MCC算法计算网络中的核心靶点,选出排名前10的核心(hub)基因即胃癌发病过程中的关键基因,这些基因在PPI网络中发挥着极为重要的作用。
1.2.5 作用于胃癌发病过程中关键基因靶点的中药活性成分分析 比较毒理基因组数据库(Comparative Toxicogenomics Database,CTD)是研究中药活性成分与基因靶点或者人体病患之间相互作用关系的数据库,其整合了大量的基因靶点信息和化合物的生物活性数据;通过内置于CTD数据库的PTS网络服务器,可迅速准确地分析与靶基因相互作用的分子结构,并进一步发掘可能与之相互作用的中药活性成分。CTD数据库目前已更新至2021年6月1日,共包含1568个化合物、146 689个基因、7212个疾病表型、1 812 207个化合物-基因关系、37 782个基因-疾病关系、211 974个化合物-疾病关系;通过与其他数据库交集,可提供超过4700万个交互作用关系。将关键基因导入搜索框,检索得到与关键基因相互作用的化合物,以Excel表格的形式导出,依据度值大小选择其中与关键基因相互作用的中药活性成分。
1.2.6 胃癌发病过程中关键基因表达高低与患者预后情况相关性分析 GEPIA(http://gepia.cancer-pku.cn)是一个包含各种肿瘤和癌症基因表达谱的数据库,其可通过对肿瘤不同阶段基因表达量的高低对患者预后情况进行分析。登录GEPIA数据库,依次导入关键基因,将高表达与低表达的患者分为2组,选择95%的置信区间,以是否具有统计学意义(<0.05)作为判断关键基因与患者预后是否存在相关性的依据,探究关键基因表达值的高低对于胃癌患者总生存率的影响。
1.2.7 胃癌发病过程中关键基因表达值与免疫细胞浸润程度相关性分析 TIMER(https://cistrome.shinyapps.io/timer/)是一个对肿瘤或癌组织芯片或高通量测序数据进行免疫细胞浸润程度分析的数据库,其囊括B细胞、CD4+T细胞、CD8+T细胞、中性粒细胞、巨噬细胞和树突状细胞6种免疫细胞的浸润数据。将关键DEGs导入,选择关键基因所在的胃癌组织并选择免疫细胞类型,获得关键DEGs在胃癌组织中表达量与免疫细胞浸润情况之间的相关性。
2 结果
2.1 数据均一化处理结果
将基因芯片GSE103236数据集映射到同一个度量体系中进行数据分析和权重比较(即标准正态化处理),绘制出每个样本相对表达值的均一化图(图1);其中横坐标代表数据集中各样本的编号,纵坐标表示样本中基因的相对表达值(relative expression value,RLE),小提琴图上下端点表示RLE的95%置信区间,小提琴图中四边形的上下边表示RLE四分位点,四边形的中间短线代表中位数。图1结果显示,19个样本数据的中位数均位于95%的置信区间,且基本处于一条直线上,表明数据集质量优良、样本数据可靠,可对胃癌组织与周围正常组织的差异表达基因进行下一步分析。

图1 标准化后GSE103236数据集各样本基因表达值的小提琴图
2.2 胃癌组织与周围正常组织DEGs筛选
将GSE103236芯片中的9例正常胃组织设为空白组,10例胃癌组织设为对照组,对其数据进行分析,共获得45 016个基因。以<0.05且|log2(FC)|>1作为初步筛选条件,得到2991个较高相关性的DEGs(图2),其中1128个上调基因(红色小点),1863个下调基因(绿色小点),通过火山图可直观地观察到总体DEGs的分布情况。以<0.01且|log2(FC)|>2为筛选条件,获得显著DEGs 176个,其中77个上调基因,99个下调基因;对其进行聚类分析,绘制层次聚类热图(图3);图中绿色小块代表下调基因,红色小块代表上调基因,方块颜色越深表示差异表达的倍数越高,其中差异表达上调倍数最大的5个基因:、、、、;差异表达下调倍数最大的5个基因:、、、;热图结果表明胃癌组织与周围正常组织基因的差异表达明显,分层和聚类情况良好。

图2 胃癌组织与周围正常组织DEGs火山图
2.3 胃癌组织与正常组织显著性DEGs GO功能富集分析
GO分析结果显示,胃癌组织与正常组织显著性DEGs的BP主要富集在胶原分解代谢、细胞外基质拆卸、消化、细胞黏附、细胞迁移、上皮细胞增殖负向调控、钾离子转运负调控、肌酸代谢、蛋白水解、内胚层细胞分化等方面。CC主要富集在细胞外区域、细胞外空间、质膜外侧、胶原三聚体、细胞外基质、细胞表面、中间丝、细胞外泌体、分泌颗粒等部位。MF主要富集在丝氨酸型内肽酶活性、胰岛素样生长因子结合、细胞骨架的结构成分、钙离子结合、细胞因子活性、相同的蛋白质结合等方面。图4展示了BP、CC和MF中−lg排名前10的富集组分。
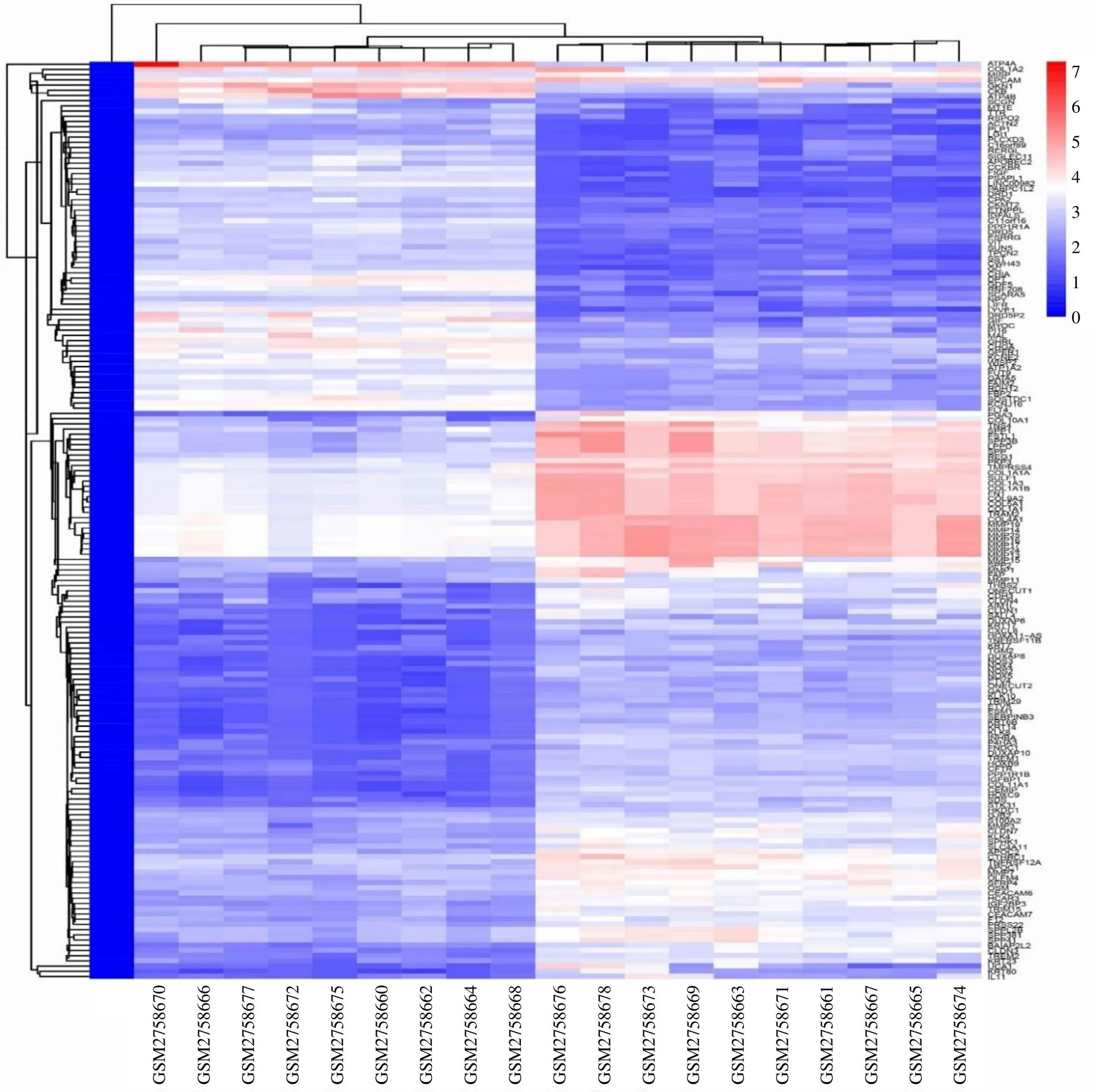
图3 胃癌组织与正常组织显著性DEGs聚类热图
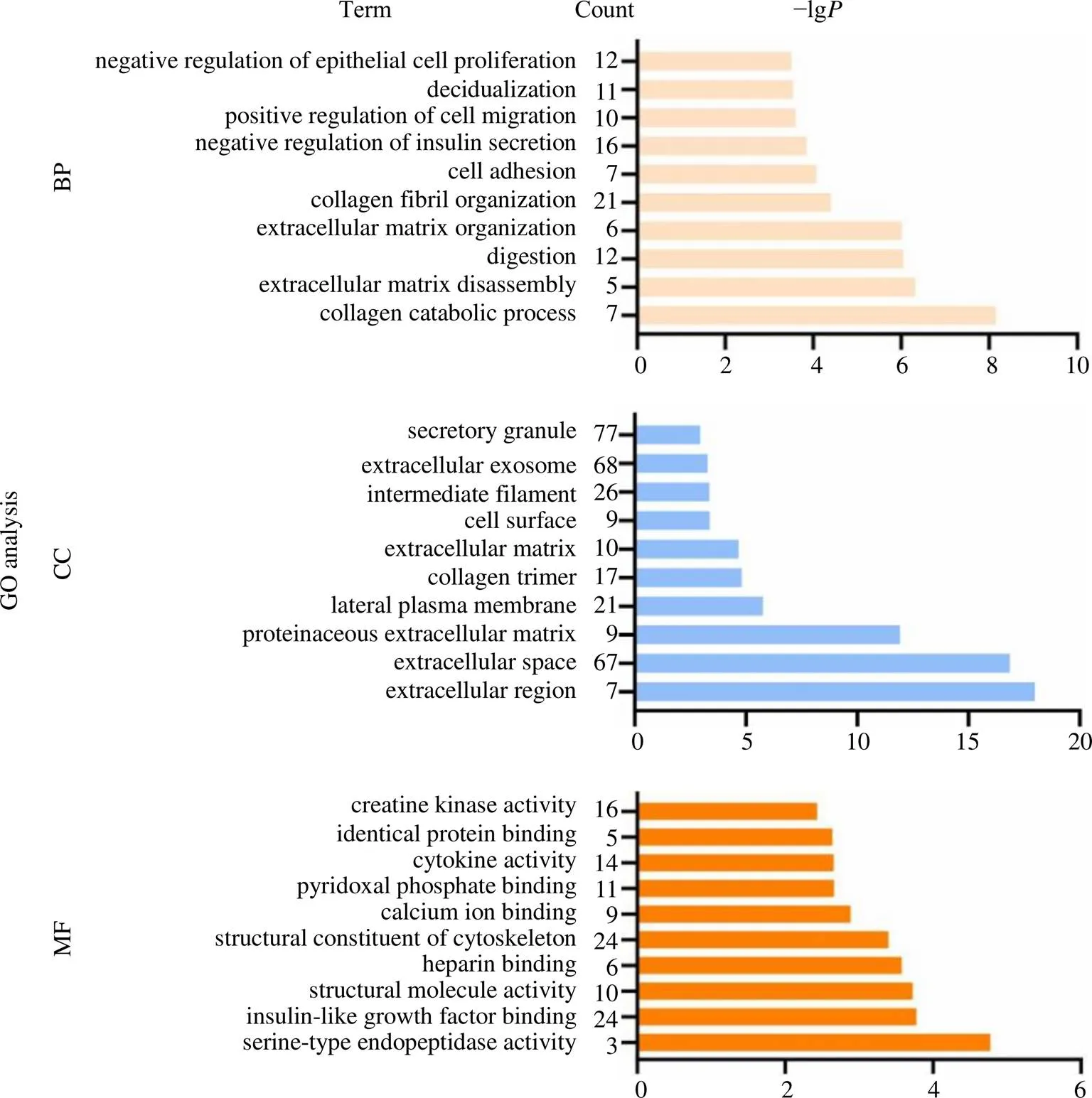
图4 胃癌组织与正常组织显著性DEGs的GO富集分析
2.4 胃癌组织与正常组织显著性DEGs的KEGG通路分析
对基因芯片中的显著性DEGs进行KEGG分析后发现其主要富集于20条信号通路:细胞外基质(extracellular matrix,ECM)-受体相互作用信号通路、蛋白质消化吸收信号通路、黏着斑信号通路、细胞因子与细胞因子受体相互作用信号通路、细胞周期信号通路、环磷酸酰胺(cyclic adenosine monophosphate,cAMP)信号通路、磷脂酰肌醇3-激酶/蛋白激酶B(phosphatidylinositide 3-kinases/protein kinase B,PI3K/Akt)信号通路、胃酸分泌、癌症转录失调信号通路、缺氧诱导因子1(hypoxia-inducible factor 1,HIF-1)信号通路、癌症中央碳代谢信号通路、癌症相关信号通路、维生素消化吸收信号通路、p53信号通路、细胞黏附分子信号通路、碳水化合物消化吸收通路、过氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptor,PPAR)信号通路及丙氨酸、天冬氨酸和谷氨酸代谢信号通路。将结果绘制为气泡图(图5),图中纵坐标代表通路名称,横坐标代表通路富集度;气泡颜色代表值,颜色越深提示值越小;气泡大小代表富集通路含有基因的数量,气泡面积越大表示该通路含有的基因数量越多。
2.5 与胃癌发病密切相关的基因靶点网络构建
将显著性DEGs进行扩展并生成可视化的PPI网络,去除游离基因后得到由388个节点,1449条边构成的圆形网络;其中节点代表靶基因,边代表靶基因之间的相互作用关系。使用CytoHubba插件对PPI网络进行分析,采用MCC算法分析得到排名前10的hub基因:金属蛋白酶组织抑制因子1(tissue inhibitor of metalloproteinase 1,)、分泌磷蛋白1(secreted phosphoprotein 1,)、载脂蛋白E(apolipoprotein E,)、载脂蛋白B(apolipoprotein E,)、纤维蛋白原α(fibrinogen α,)、纤维蛋白原γ(fibrinogen γ,)、富半胱氨酸蛋白61(cysteine-rich61,)、胰岛素样生长因子结合蛋白1(insulin-like growth factor-binding protein-1,)、嗜铬粒蛋白B(chromogranin B,)、分泌粒蛋白III(secretory granule protein III,)(图6),拓扑学数据见表1;其中、、的度值、介数中心性、最短路径中心3个数据均排名前3。上述10个hub基因即为与胃癌发病密切相关的核心基因。
2.6 靶向作用于胃癌发病密切相关基因的中药活性成分筛选
根据相互作用指数筛选与胃癌发病密切相关的10个hub基因靶向结合的中药活性成分,结果(表2)显示,可靶向作用于的中药活性化合物有辣椒素、槟榔碱、桦木酸、苦瓜碱、长春新碱;可靶向作用于的中药活性化合物有柚皮苷、苦瓜素、穿心莲内酯、银杏酸、丹参酮;可靶向作用于的中药活性化合物有三七皂苷、植物固醇、杨桃素、茶黄素、姜黄素;可靶向作用于的中药活性化合物有槲皮素、麻黄碱、葡萄籽原花青素;可靶向作用于的中药活性化合物有槲皮素、茶碱;可靶向作用于的中药活性化合物有香豆素、皂苷、雷公藤甲素;可靶向作用于的中药活性化合物有鱼藤酮;可靶向作用于的中药活性化合物有白藜芦醇、棕榈酸、花青素、五味子素B;可靶向作用于的中药活性化合物有番茄红素、鱼藤酮;可靶向作用于的中药活性化合物有类黄酮。
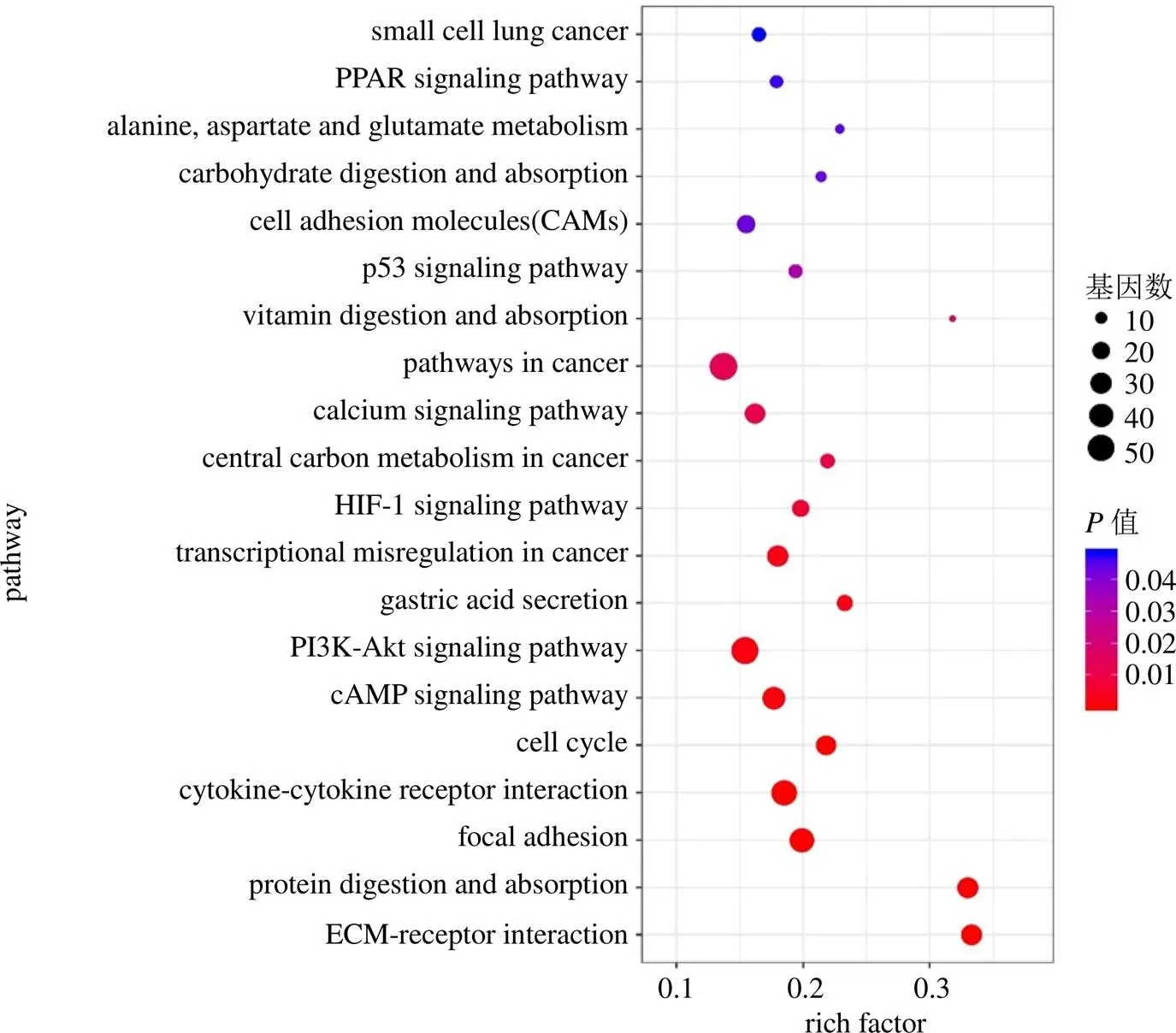
图5 胃癌组织与正常组织显著性DEGs信号通路富集气泡图
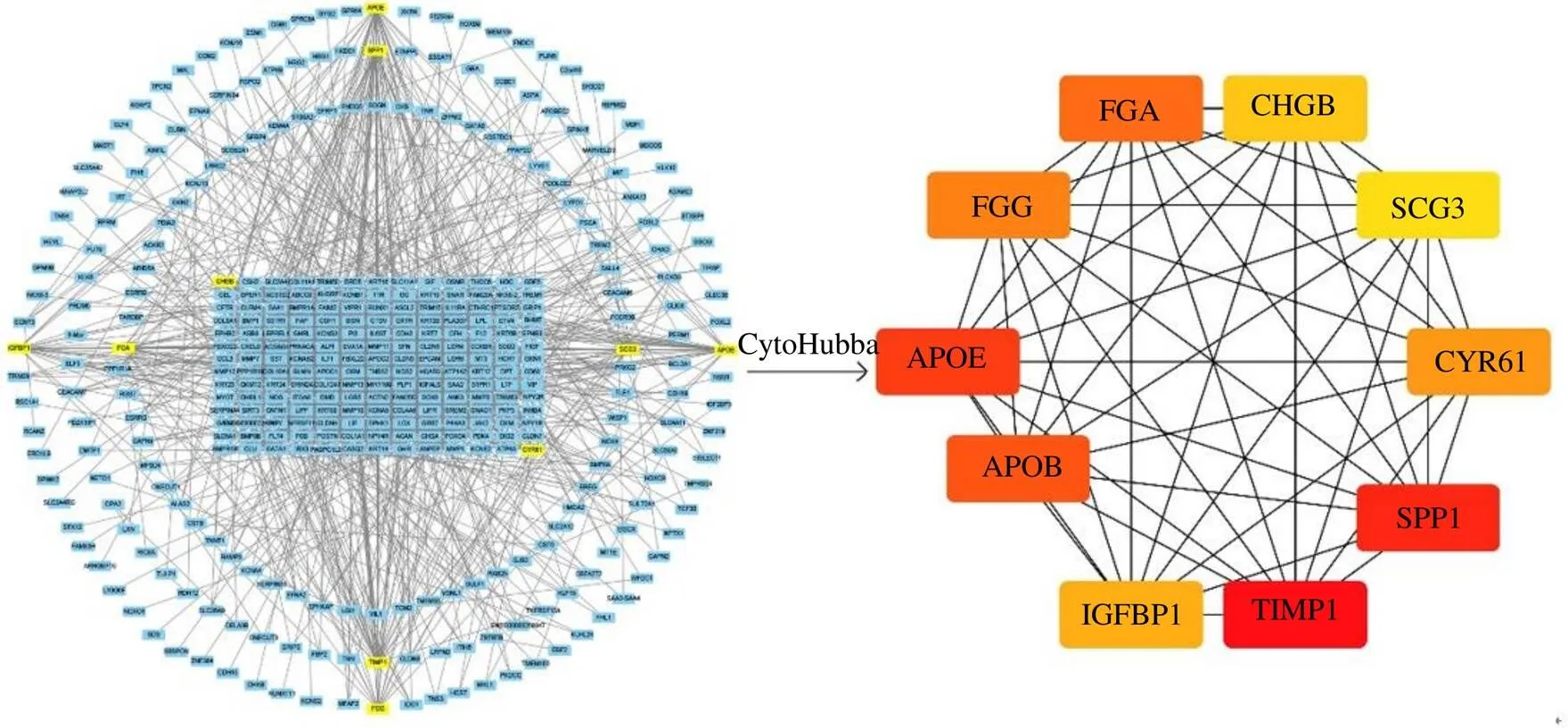
图6 与胃癌发病密切相关的核心基因PPI网络
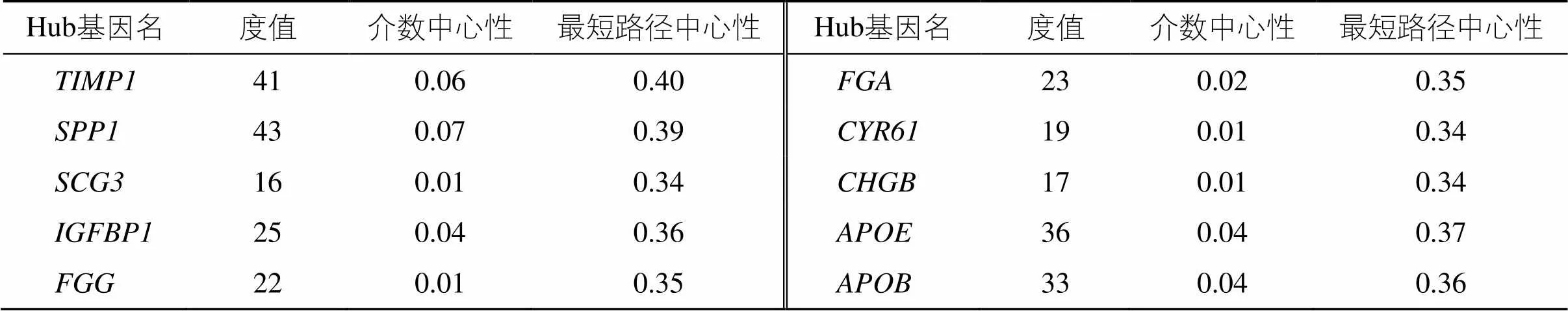
表1 与胃癌发病密切相关的核心基因PPI网络拓扑学数据
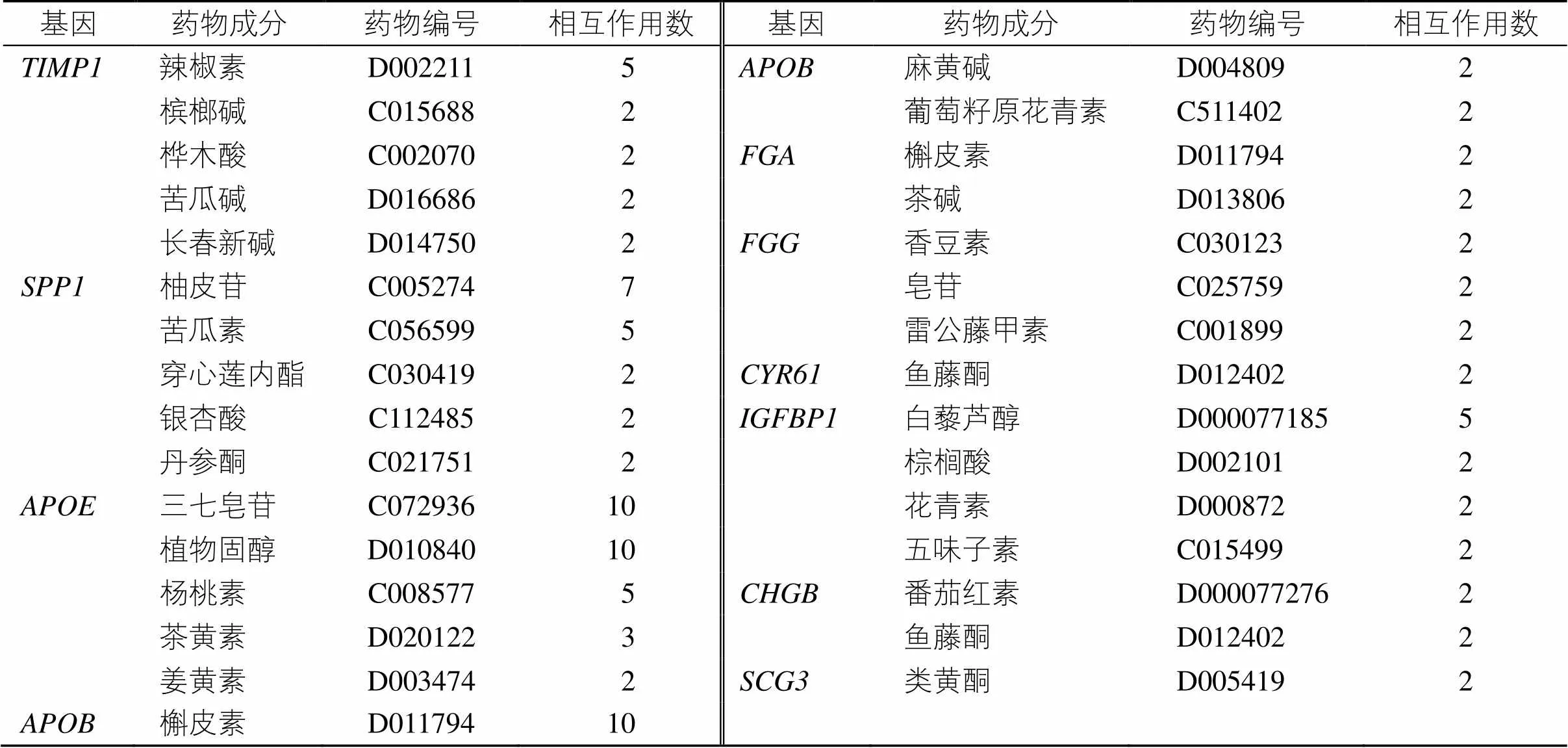
表2 与胃癌发病相关Hub基因相互作用的中药活性成分
2.7 与胃癌发病相关的核心基因对疾病预后意义的分析
通过研究关键基因对患者预后的价值,发现、、、、、6个关键基因对患者预后总生存率具有重要的影响。图7描述了关键基因表达高低与患者总生存率的相关性,图中横坐标代表患者生存时间,纵坐标代表患者的总生存率,红色线条代表基因高表达患者,蓝色线条代表基因低表达患者;风险比logrank<0.05表示基因高表达患者的预后生存率与基因低表达者存在统计学差异;危害比(hazard ratios,HR)表示基因高表达患者相对于基因低表达患者发生癌症进展或死亡的概率,如HR=1.8说明基因高表达患者的癌症进展或死亡风险是基因低表达患者的1.8倍。结果显示,、、、、、6个基因的HR值分别为1.8、1.7、1.5、2.4、1.5、1.4。
2.8 胃癌核心致病基因与免疫细胞浸润相关性分析
通过评估胃癌相关免疫细胞的浸润情况及分析关键基因表达水平的高低与不同免疫细胞(B细胞、CD4+T细胞、CD8+T细胞、中性粒细胞、巨噬细胞和树突状细胞)浸润程度的相关性,发现这10个关键基因的异常表达均与免疫细胞的大量浸润有一定相关性,其中、、、、5个基因与免疫细胞的大范围浸润有较高的相关性。结果如图8所示,图中横坐标代表免疫细胞丰度,纵坐标代表基因表达量,其中<0.05表示基因的异常表达与引发免疫细胞浸润之间存在相关性。基因对不同免疫细胞浸润相关性统计学分析结果见表3。
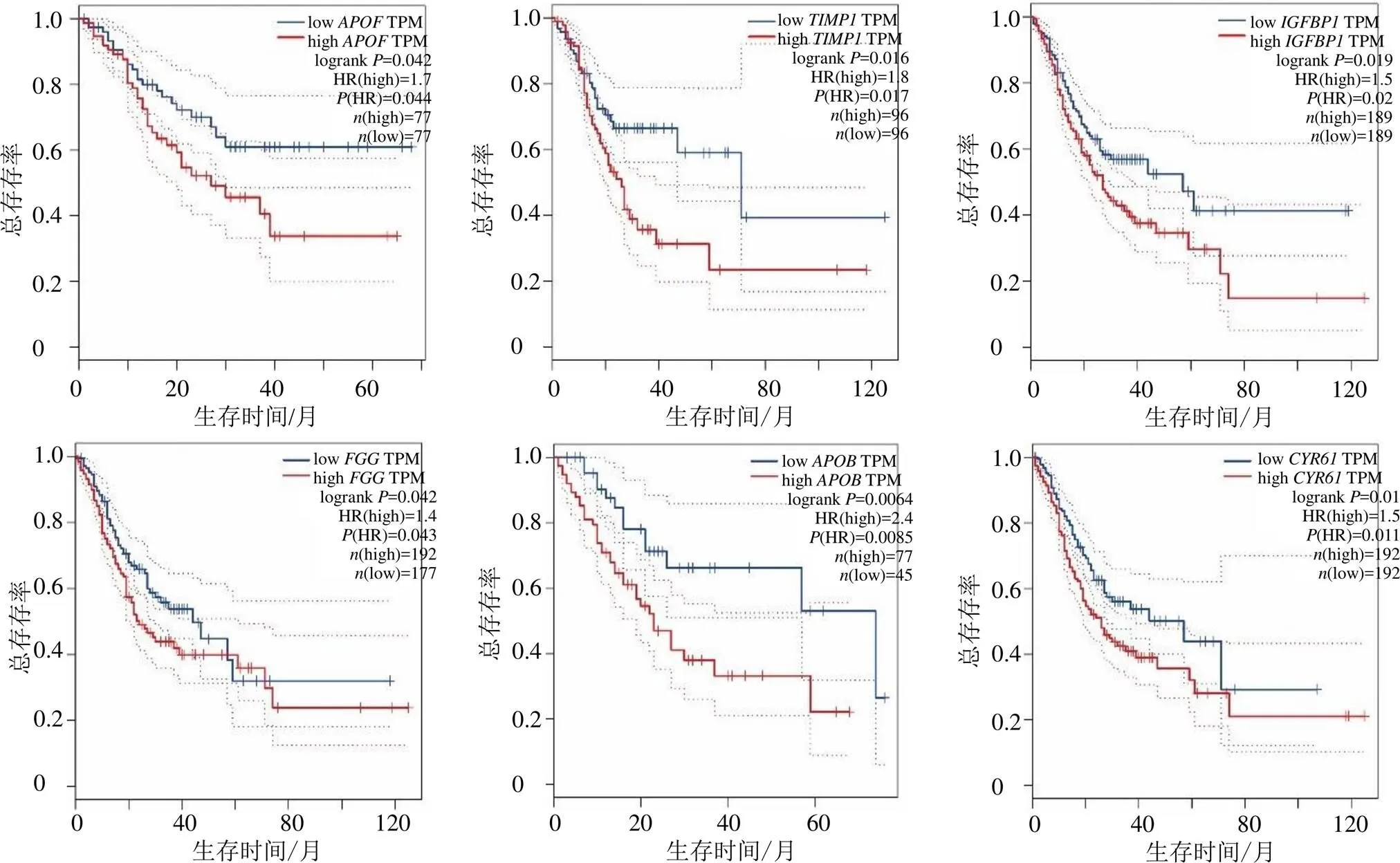
图7 胃癌组织与正常组织核心DEGs表达值高低与患者预后情况分析
3 讨论
胃癌是一种发生于胃黏膜上皮的恶性肿瘤,全世界每年大约有100万新增病例,约有85万人死于胃癌[5]。胃癌的发病具有地区和年龄特征,农村高于城市,40岁以上人群发病率显著升高[5]。胃癌发病的危险因素包括:幽门螺杆菌感染、饮食因素、吸烟、肥胖、辐射、恶性贫血等[4];涉及的基本发病机制包括:炎症因子浸润、氧化应激、细胞周期调控异常、自噬调控异常等[6]。近年来,研究者们对胃癌发病的认识程度在不断地加深,一系列靶向药物陆续地被探索发掘,但目前对于胃癌靶点的发掘还不够全面和深入,无法进行多靶点、多层次的系统性治疗。因此,对胃癌潜在靶点的扩大研究和发掘具有重要的临床意义。
本研究通过GEO数据库获得胃癌及周围正常组织基因芯片数据集GSE103236,对正常和胃癌组织进行DEGs分析,筛选出45 015个DEGs;其中表达差异达2倍以上的基因共有176个,包括上调基因77个和下调基因99个。对这些显著性差异表达基因进行GO和KEGG分析,结果显示,胃癌组织在BP、CC、MF上和正常组织细胞之间均存在巨大差异;主要表现在胶原分解代谢过程、细胞外基质拆卸、胶原原纤维组织合成等生物学过程;差异的细胞组分包括细胞外区域、蛋白质细胞外基质、胶原三聚体等;这些BP和CC均在肿瘤细胞的迁移过程中发挥了重要作用。细胞外基质(extracellular matrix,ECM)是一种位于细胞外的疏松结缔组织,内含多种生物大分子物质如胶原蛋白、黏附因子、糖蛋白、细胞因子等,在细胞间信号传递、细胞间的相互作用以及调控细胞增殖、分化、迁移等功能上具有重要的生理意义[7-8];ECM不仅为正常组织细胞的生长代谢提供了一个良好的环境,还是阻碍肿瘤细胞迁移和侵袭的天然保护屏障,一旦ECM的完整性遭到破坏,肿瘤细胞就更容易发生迁移和侵微环境,为其侵袭提供便利条件[10]。研究表明[11],细胞外基质蛋白1(ECM1)可直接与整合素β4(integrin beta 4,ITGB4)相互作用,激活ITGB4/黏着斑激酶(focal adhesion kinase,FAK)/糖原合成酶激酶3β信号通路,促进胃癌细胞对葡萄糖的吸收和利用,有利于胃癌细胞的增殖与迁移,因此血清ECM1含量的增高往往提示恶性肿瘤的强侵袭性以及患者预后的不佳。

图8 胃癌与正常组织关键DEGs表达水平与不同免疫细胞浸润程度关系

表3 胃癌与正常组织关键DEGs与免疫细胞浸润相关性统计学分析
√表示<0.05,提示该基因与免疫细胞浸润有较强相关性
√indicates0.05, suggesting a strong correlation between the gene and immune cell infiltration
KEGG结果显示,胃癌显著性DEGs主要富集于ECM-受体相互作用通路、PI3K/Akt信号通路、HIF-1信号通路、p53信号通路等。PI3K/Akt通路是一条主要调控细胞凋亡、生长、分化的信号通路,在胃癌组织中过表达而参与癌组织的血管生成,促进癌细胞生长、抑制癌细胞凋亡、促进癌细胞恶性转化等生物学过程[12]。研究表明[13],通过microRNA或小分子蛋白酶阻断PI3K/Akt信号通路激活,可减少胃癌细胞的增殖与侵袭,诱导胃癌细胞凋亡。HIF-1是一种缺氧诱导因子,可促进微血管的生长,增强组织在低氧环境中的适应能力,在多种肿瘤组织中表达量均显著提高[14],是肿瘤细胞耐受低氧环境的重要因子。研究[15-16]发现,HIF-1信号通路与PI3K/Akt信号通路存在重要的交互作用,胃癌细胞可通过PI3K/Akt信号通路上调HIF-1表达,使其在缺氧条件下的黏附和侵袭能力显著增强。p53信号通路是最经典的抑癌通路之一,p53转录因子参与调控众多转录过程及细胞程序的运行,如维持基因组稳定性、细胞代谢、细胞凋亡、非凋亡细胞死亡、迁移/侵袭等生物过程[17]。p53可通过激活AMP依赖的蛋白激酶(AMP-activated protein kinase,AMPK),抑制雷帕霉素靶蛋白(target of rapamycin,mTOR)活性,诱导细胞自噬水平提高[18]。研究[19]还发现,p53过表达可显著抑制肿瘤细胞的生长与转移,这些都是p53有着极强抗癌作用的分子基础,同时也解释了为什么有接近一半癌症患者体内的p53基因位点都发生突变[17]。综上所述,已有大量研究表明细胞外基质信号通路、PI3K/Akt信号通路、HIF-1信号通路、p53信号通路与胃癌的发生发展有着密切的联系,表明本研究对于胃癌发病机制调控网络的生物信息学分析结果可靠。
通过Cytohubba软件的MCC算法,研究预测了与胃癌发病具有紧密关联的10个核心靶点基因:、、、、、、、、、。运用GEPIA数据库考察这些hub基因的预后价值发现,、、、、、这6个基因的异常表达与患者的总体生存率不良密切相关。TIMP1是一种基质金属蛋白酶抑制蛋白,广泛地存在于细胞外基质,对肿瘤细胞的转移和侵袭具有重要影响[20]。Huang等[21]发现,TIMP1在结直肠癌中的持续高表达是结直肠癌预后不良的重要指标。Laitinen等[22]研究表明,血清TIMP1水平升高与胃癌患者预后不佳显著相关,高表达的TIMP1是患者预后不良的独立指征,本研究结果与上述研究结果一致。APOE与APOB属于载脂蛋白家族,由胆固醇、磷脂、三酰甘油等组分构成,可与血脂结合以调节机体脂质代谢。随着现代医学对载脂蛋白研究的深入,发现其与癌症、自噬、氧化应激等生物学过程密切相关。研究表明[23],通过实时PCR技术监测mRNA表达,发现胃癌组织中表达量显著增高,该基因的高表达不仅与胃癌的肌肉层、浆膜层侵袭以及远处淋巴结转移有着密切的联系,并且会导致患者预后生存期缩短。研究表明[24],APOB/APOA1值较高的患者生存时长较短,这可能与APOB高表达促进癌细胞的迁移和侵袭有关。APOB与APOE可作为许多癌症预后不良的生物学标志物,二者的高表达会导致胃癌、乳腺癌、肝细胞癌、肺小细胞癌、卵巢癌患者预后不良[25]。胰岛素/类胰岛素生长因子(insulin/insulin like growth factor,IGF)是一类小分子生物活性肽,可促进有丝分裂,调控细胞生长,目前认为肿瘤细胞可自分泌IGF,从而促进肿瘤的生长与恶变;IGFBP1属于胰岛素样生长因子家族,它主要通过与IGF结合形成IGF/IGFBP1复合物而限制IGF的生物学活性,发挥负向调节的作用。目前对IGFBP1的报道较少,但对于其同家族的IGFBP3报道较多,研究发现[26],结肠癌组织相比于正常组织IGFBP1水平显著升高,而IGFBP3的表达水平显著低于正常组织;鉴于当前已有的对IGFBP1的研究,无法验证其表达水平与患者预后的相关性,本研究对IGFBP1D预测结果可为之后的胃癌预后研究提供一定的思路。CYR61是基质蛋白家族中的重要因子,具有促进血管生成、促进血管内皮新生、抑制细胞凋亡、刺激肿瘤增殖与侵袭等功能,参与了包括Wnt/β-catenin信号通路、核因子-κB(nuclear factor-κB,NF-κB)信号通路、Akt信号通路等多条信号通路,CYR61的高表达与各类癌症新生血管的形成均有密切的关系。研究表明[27],CYR61高表达的胃癌患者多见于更远处淋巴结转移、更晚期的肿瘤分期以及更频繁的复发,将CYR61转染到人胃腺癌细胞系中可大大增强其侵袭性。Yan等[28]运用miR-142-5p阻断CYR61的生物学作用,发现胃癌细胞的侵袭与转移明显减弱,患者的预后明显转好,提示CYR61有望成为反映胃癌预后情况的重要指标。FGG是纤维蛋白原的组成成分之一,主要参与组织的早期凝血和创伤组织细胞的迁移,在癌症组织中,主要参与癌细胞的增殖和侵袭。研究表明[29],FGG可通过EMT信号通路增强癌细胞运动性和侵袭性,导致肿瘤细胞的早期浸润及术后复发,FGG表达水平较高的患者,预后生存期较短。本预测结果与Duan等[30]研究结果一致,认为FGG是评定胃癌患者预后情况的生物标志物之一。
辣椒素、桦木酸、长春新碱、柚皮苷、穿心莲内酯、丹参酮、三七皂苷、姜黄素、槲皮素、白藜芦醇等中药活性成分均可用于胃癌的防治,对提高患者的预后具有显著的疗效。辣椒素是辣椒的主要活性成分,宋文龙等[31]研究表明,辣椒素可通过凋亡相关因子及其配体途径上调半胱氨酸蛋白酶-8(Caspase-8)、Caspase-3表达,从而促进胃癌细胞凋亡。桦木酸是来源于白桦树皮的五环三萜类化合物,有研究表明桦木酸可通过抑制细胞周期蛋白 D1(Cyclin D1)和Cyclin B1表达降低胃癌细胞的增殖能力[32]。长春新碱是从中药长春花中提取的主要活性成分,可显著抑制胃癌细胞增殖[33]。柚皮苷是从橙或柚的果皮中提取的黄酮类化合物,有研究发现柚皮苷可通过增加癌细胞内溶酶体膜的通透性诱导胃癌细胞发生自噬[34]。穿心莲内酯是穿心莲的主要活性成分,研究表明穿心莲内酯可抑制拓扑异构酶IIα的活性,导致DNA损伤,从而诱导胃癌细胞凋亡[35]。丹参酮是丹参的主要活性成分,丹参酮可通过加强p53介导的铁死亡和下调信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)表达抑制胃癌细胞生长[36]。三七皂苷是三七的重要活性成分,三七皂苷可通过上调p21、Caspase-3和B淋巴细胞瘤-2基因相关X蛋白(B lymphocytoma-2 gene associated X,Bax)蛋白表达而发挥胃黏膜保护作用及胃癌细胞的生长抑制作用[37]。姜黄素是姜科植物根茎的主要活性成分,其可通过调控多条信号通路和多种蛋白表达以抑制胃癌细胞的迁徙和转移[38]。槲皮素是一类常见的黄酮类化合物,是许多中草药的活性成分,它可通过抑制胃癌细胞的间充质转化而减少胃癌细胞转移[39]。
本研究基于生物信息学对胃癌发病机制的调控网络进行了分析,对胃癌发病过程中的关键基因进行了预测,并对关键基因的预后价值及其与免疫细胞浸润的相关性进行了探究,阐明了胃癌发病中各基因靶点之间的相互作用、参与的信号通路以及关键基因的预后价值,并进一步挖掘得到多种可以靶向作用于关键基因用于胃癌治疗的中药活性成分,本研究结果可为胃癌生物标志物的检测、胃癌的临床治疗及抗癌中药活性成分的研发提供新的思路和参考。
利益冲突 所有作者均声明不存在利益冲突
[1] Ferlay J, Soerjomataram I, Dikshit R,.Cancer incidence and mortality worldwide: Sources, methods and major patterns in GLOBOCAN 2012 [J]., 2015, 136(5): E359-E386.
[2] 吴秋雪, 孙梦瑶, 许博, 等.左金丸醇提物抑制人胃癌SGC-7901细胞糖酵解的作用机制 [J].中草药, 2021, 52(1): 145-151.
[3] Wu C C, Li M N, Meng H B,.Analysis of status and countermeasures of cancer incidence and mortality in China [J]., 2019, 62(5): 640-647.
[4] Smyth E C, Nilsson M, Grabsch H I,.Gastric cancer [J]., 2020, 396(10251): 635-648.
[5] Machlowska J, Baj J, Sitarz M,.Gastric cancer: Epidemiology, risk factors, classification, genomic characteristics and treatment strategies [J]., 2020, 21(11): E4012.
[6] Niikura R, Hirata Y, Hayakawa Y,.Effect of aspirin use on gastric cancer incidence and survival: A systematic review and meta-analysis [J]., 2020, 4(2): 117-125.
[7] Paolillo M, Schinelli S.Extracellular matrix alterations in metastatic processes [J]., 2019, 20(19): E4947.
[8] Gopal S, Multhaupt H A B, Couchman J R.Calcium in cell-extracellular matrix interactions [J]., 2020, 1131: 1079-1102.
[9] Jang M, Koh I, Lee J E,.Increased extracellular matrix density disrupts E-cadherin/β-catenin complex in gastric cancer cells [J]., 2018, 6(10): 2704-2713.
[10] Moreira A M, Pereira J, Melo S,.The extracellular matrix: An accomplice in gastric cancer development and progression [J]., 2020, 9(2): E394.
[11] Gan L, Meng J, Xu M,.Extracellular matrix protein 1 promotes cell metastasis and glucose metabolism by inducing integrin β4/FAK/SOX2/HIF-1α signaling pathway in gastric cancer [J]., 2018, 37(6): 744-755.
[12] Zhang X, Huang L F, Hua L,.Resveratrol protects myocardial apoptosis induced by ischemia-reperfusion in rats with acute myocardial infarction via blocking P13K/Akt/e-NOS pathway [J]., 2019, 23(4): 1789-1796.
[13] Peng X C, Zhou J R, Li B,.Notch1 and PI3K/Akt signaling blockers DAPT and LY294002 coordinately inhibit metastasis of gastric cancer through mutual enhancement [J]., 2020, 85(2): 309-320.
[14] Kitajima S, Lee K L, Hikasa H,.Hypoxia-inducible factor-1α promotes cell survival during ammonia stress response in ovarian cancer stem-like cells [J]., 2017, 8(70): 114481-114494.
[15] Liu X Q, Wang Y F, Sun L,.Long noncoding RNA BC005927 upregulates EPHB4and promotes gastric cancer metastasis under hypoxia [J]., 2018, 109(4): 988-1000.
[16] Courtnay R, Ngo D C, Malik N,.Cancer metabolism and the Warburg effect: The role of HIF-1 and PI3K [J]., 2015, 42(4): 841-851.
[17] Mello S S, Attardi L D.Deciphering p53 signaling in tumor suppression [J]., 2018, 51: 65-72.
[18] Shi J F, Wu J F, Ni H B,.Effect of AMPK/Akt/mTOR pathway on cytokine-induced killer cells immunotherapy on colorectal cancer cells [J]., 2019, 24(1): 116-122.
[19] Xu Q, Jia X Y, Wu Q,.Esomeprazole affects the proliferation, metastasis, apoptosis and chemosensitivity of gastric cancer cells by regulating lncRNA/circRNA-miRNA-mRNAnetworks [J]., 2020, 20(6): 329.
[20] Park K C, Dharmasivam M, Richardson D R.The role of extracellular proteases in tumor progression and the development of innovative metal ion chelators that inhibit their activity [J]., 2020, 21(18): E6805.
[21] Huang R, Wang K, Gao L,.TIMP1 is a potential key gene associated with the pathogenesis and prognosis of ulcerative colitis-associated colorectal cancer [J]., 2019, 12: 8895-8904.
[22] Laitinen A, Hagström J, Mustonen H,.Serum MMP-8 and TIMP-1 as prognostic biomarkers in gastric cancer [J]., 2018, 40(9): 1010428318799266.
[23] Zheng P M, Luo Q, Wang W W,.Tumor-associated macrophages-derived exosomes promote the migration of gastric cancer cells by transfer of functional apolipoprotein E [J]., 2018, 9(4): 434.
[24] Ma M Z, Yuan S Q, Chen Y M,.Preoperative apolipoprotein B/apolipoprotein A1 ratio: A novel prognostic factor for gastric cancer [J]., 2018, 11: 2169-2176.
[25] Deng W, Liu H L, Luo S,.genotypes andhaplotypes in the cholesterol-related pathway genes predict non-small cell lung cancer survival [J]., 2020, 29(6): 1204-1213.
[26] 王焕成.GF-I与GFBP-3在结直肠癌患者血清中的表达意义 [J].当代医学, 2020, 26(26): 138-139.
[27] Hyun H, Moon J, Cho S.Quercetin suppresses CYR61-mediated multidrug resistance in human gastric adenocarcinoma AGS cells [J]., 2018, 23(2): 209.
[28] Yan J, Yang B, Lin S Y,.Downregulation of miR-142-5p promotes tumor metastasis through directly regulating CYR61 expression in gastric cancer [J]., 2019, 22(2): 302-313.
[29] Zhang X, Wang F, Huang Y B,.FGG promotes migration and invasion in hepatocellular carcinoma cells through activating epithelial to mesenchymal transition [J]., 2019, 11: 1653-1665.
[30] Duan S J, Gong B C, Wang P L,.Novel prognostic biomarkers of gastric cancer based on gene expression microarray: COL12A1, GSTA3, FGA and FGG [J]., 2018, 18(4): 3727-3736.
[31] 宋文龙, 汪建军.辣椒素通过Fas/FasL死亡受体通路诱导胃癌细胞发生凋亡的研究 [J].实用中医内科杂志, 2021, 35(5): 129-132, 155.
[32] 陈亚楠, 邵淑丽, 何孟奇, 等.桦木酸对人胃癌SGC-7901细胞增殖的影响 [J].中国应用生理学杂志, 2020, 36(6): 628-632.
[33] 陈通克, 汤陌生, 姜程曦, 等.长春新碱对人胃癌BGC细胞增殖与凋亡的影响及其机制 [J].中草药, 2015, 46(5): 703-709.
[34] Raha S, Kim S M, Lee H J,.Naringin induces lysosomal permeabilization and autophagy cell death in AGS gastric cancer cells [J]., 2020, 48(3): 679-702.
[35] Monger A, Boonmuen N, Suksen K,.Inhibition of topoisomerase IIα and induction of apoptosis in gastric cancer cells by 19-triisopropyl andrographolide [J]., 2017, 18(10): 2845-2851.
[36] Guan Z H, Chen J, Li X L,.Tanshinone IIA induces ferroptosis in gastric cancer cells through p53-mediated SLC7A11 down-regulation [J]., 2020, 40(8): BSR20201807.
[37] 石维娜, 郝杰, 石新涛.三七总皂苷抑制胃癌进程的体外研究 [J].中国免疫学杂志, 2020, 36(3): 349-354.
[38] Barati N, Momtazi-Borojeni A A, Majeed M,.Potential therapeutic effects of curcumin in gastric cancer [J]., 2019, 234(3): 2317-2328.
[39] 许振, 彭琼, 甘惠中, 等.槲皮素对胃癌细胞SGC-7901上皮间质转化的抑制作用 [J].中华实用诊断与治疗杂志, 2017, 31(3): 227-230.
Construction of regulatory network of key genes in gastric cancer and screening of active components of traditional Chinese medicine for targeted therapy
SONG Hou-pan1, 3, LIU Heng-ming2, QIU Jing-yue1, 3, FENG Yao2, WU Man-ting1, 3, YU Chang1, 3, XIONG Meng1, 3, ZENG Mei-yan3
1.Hunan Provincial Key Laboratory of Diagnostic Research in Chinese Medicine, Hunan University of Chinese Medicine, Changsha 410208, China 2.Faculty of Medicine, Hunan University of Chinese Medicine, Changsha 410208, China 3.Key Laboratory of TCM Heart and Lung Syndrome Differentiation & Medicated Diet and Dietotherapy, Hunan University of Chinese Medicine, Changsha 410208, China
To analyze the gene regulatory network closely related to gastric cancer through bioinformatics methods, explore its value in the prognosis of gastric cancer, and further explore the active ingredients of traditional Chinese medicine for targeted therapy of gastric cancer.GSE103236 gastric cancer chip data was obtained from the GEO database, and the chip data was homogenized to analyze the differentially expressed genes (DEGs) between gastric cancer tissue and normal gastric tissue.The genetic ontology (GO) and Kyoto encyclopedia of genes and genomes (KEGG) pathways were analyzed on DEGs using the Metascape database, and DEGs protein interaction network was constructed through String database.The key genes were screened by Cytohubba, and the correlation between the expression of key genes and prognosis and infiltration of immune cells was analyzed.CTD database was used to screen active components of traditional Chinese medicine which could target the key genes.A total of 45 015 DEGs from gastric cancer and normal tissue were obtained, of which 176 were significant DEGs.These significant DEGs were closely related to cell cycle process regulation, mitogen activated protein kinases (MAPK) cascade regulation and other biological processes.They were concentrated in the extracellular werea, cellular exosomes and other cellular components, and were mainly involved in cell functions such as insulin-like growth factor binding and Wnt protein binding.The KEGG analysis found that DEGs were mainly involved in cyclic adenosine monophosphate (cAMP) signaling pathway, phosphatidylinositide 3-kinases/protein kinase B (PI3K/Akt) signaling pathway, cancer transcription disorder, p53 signaling cascade and other signaling pathways.Ten hub genes:,,,,,,,,,were screened out.The abnormal expression of these genes were highly correlated with the large-scale infiltration of immune cells.Among them, the abnormal expression of the six key genes of,,,,, andcould significantly affect the survival rate of patients.Thirty active ingredients of traditional Chinese medicine, such as betulinic acid, vincristine, and tanshinone, etc., that may be targeted for the treatment of gastric cancer have been further unearthed.Ten core genes that may be closely related to the pathogenesis of gastric cancer are screened out, and the correlation of these core genes with the prognosis of gastric cancer patients and immune cell infiltration are analyzed, and 30 active ingredients of traditional Chinese medicine for targeted therapy of gastric cancer are screened out.This study can provide ideas and references for the prevention and prognosis of gastric cancer.
gastric cancer; differentially expressed genes; bioinformatics; active components of traditional Chinese medicine; immune cell infiltration; prognosis analysis; betulinic acid; vincristine; tanshinone
R284
A
0253 - 2670(2021)22 - 6939 - 14
10.7501/j.issn.0253-2670.2021.22.020
2021-06-20
国家自然科学基金青年科学基金项目(81703920);湖湘青年科技创新人才项目(2021RC3101);湖南省自然科学基金青年科学基金项目(2019JJ50442);湖南中医药大学校级科研基金项目(2020XJJJ012);湖南省教育厅科研一般项目(19C1426)
宋厚盼(1988—),博士,副教授,主要从事中医药防治脾胃病和眼底病研究。Tel: (0731)88459435 E-mail: hpsong2015@126.com
通信作者:曾梅艳(1989—),讲师,主要从事方剂配伍规律研究。Tel: (0731)88458206 E-mail: zengmy2018@126.com
[责任编辑 潘明佳]

