HBV-DNA定量检测方法学的性能验证分析
宋丽影 李雨艳 周婷婷 路放
(吉林金域医学检验所有限公司 吉林长春 130000)
1 前言
方法学性能验证是指为确保实验室开展的检测项目中,所应用的检测系统的分析性能或检测项目的方法学能够满足检测及临床要求,进行的一项质量保证工作,只有通过性能验证才能开展相关工作。HBV-DNA定量(实时荧光定量PCR方法)是分子实验室中最常见的一种项目。本文以HBV-DNA定量检测为例,对如何进行分子诊断定量项目的分析性能验证进行简要分析。
2 材料与方法
2.1 标本来源
HBV-DNA标本(吉林金域医学检验所有限公司);正确度验证室间质评样本(国家卫生健康委临床检验中心,吉林市临床检验中心);重复性精密度和中间精密度验证高低值室内质控品(北京康斯坦彻)。
2.2 仪器
实时荧光定量PCR仪(ABI7500);DP-1OOO提取仪(上海科华生物技术有限公司);5424R高速冷冻离心机(Eppendorf)。
2.3 试剂
乙型肝炎病毒核酸测定试剂盒(磁珠/PCR-荧光探针法,国械注准20193401792,试剂批号20031611,上海科华生物技术有限公司)。
2.4 方法
2.4.1 正确度验证
使用已经通过室间质评的20例样本进行验证,计算出每个样本的偏倚百分比,偏倚百分比=(测量值-理论值)/理论值×100%。留样再测判断标准:按照项目稳定性要求,选取能够覆盖测量区间的最长期限的5个样本,其中至少4个样本的测量结果偏倚<±7.5%。
2.4.2 精密度验证
(1)重复性精密度:选取高低值质控品,在同一次实验中重复检测高低值质控品各20次,记录结果并计算均值、标准差和变异系数CV(%)。以能力验证/室间质评评价界限(靶值±0.4对数值)作为允许总误差(TEa),重复性精密度<3/5TEa(TEa=0.4Lg),即为通过。
(2)中间精密度:选取高低值质控品,利用不同日期累计的20个测定值的数据,记录结果并计算均值、标准差和变异系数CV(%)。以能力验证/室间质评评价界限(靶值±0.4对数值)作为允许总误差(TEa),中间精密度<4/5TEa(TEa=0.4Lg),即为通过[1]。
2.4.3 线性验证
取临床HBV-DNA混合血清定值为3.48E+06 IU/mL的样本进行验证,使用阴性血清10倍梯度稀释至5、4、3、2次方。每个浓度重复检测3次,用阴性标本按1∶10、1∶100、1∶1 000、1∶10 000、1∶100 000系列进行稀释,以稀释计算值作为理论值,对各稀释样品的实测值与理论值进行回归分析,对每个样本进行3次检测,经统计后拟合回归线y=bx+a。
2.4.4 抗干扰能力验证
取2种不同浓度(E3和E5)的HBV血清样本,将血清样本和相应的干扰物进行一定比率的混合,混合后对应浓度分别为:胆红素18 mg/mL,甘油三酯3 g/dL,血红蛋白2 g/dL;按照相同的比率将混合血清和相应的干扰物空白对照(阴性血清)混合后再检测。每个混合品重复检测3次,计算均值(lg值)。评价标准:实验样本与对照样本lg值偏倚<±7.5%。
2.4.5 质控
每次实验时均做阴性、低值与高值室内质控。在实验结束时将低值与高值质控结果进行对数转换并录入系统。当质控结果理想时,实验数据才能被采用,否则需要重新进行检测[2]。
3 试验结果
3.1 正确度验证结果
试验正确度验证结果见表1。

表1 HBV-DNA正确度验证结果
3.2 精密度验证结果
3.2.1 重复性精密度
重复性精密度测定S低值为0.12,S高值为0.08,详见表2。
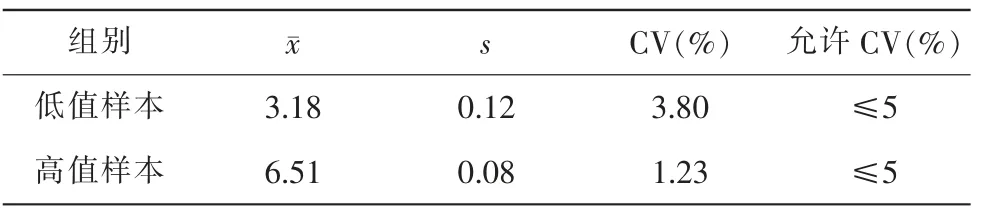
表2 HBV-DNA重复性精密度验证结果
3.2.2 中间精密度
中间精密度统计不同日期累积的S低值为0.11,详见表3。

表3 HBV-DNA中间性精密度验证结果
3.3 线性验证结果
将3.48E+06 IU/mL浓度的样本稀释至3.48E+02 IU/m。
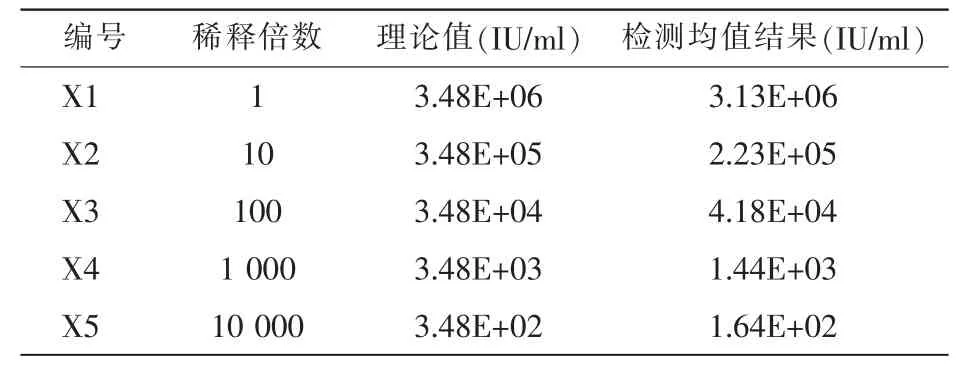
表4 HBV-DNA线性验证结果
3.4 抗干扰能力验证结果
本次实验样本与对照样本的lg值偏倚均符合<±7.5%的标准,验证合格。

表5 抗干扰能力样本定量值
4 讨论
荧光定量PCR是实验室最常用的检测方法之一,具有高敏感性和特异性,被广泛应用于临床诊断和治疗,在临床分子诊断中展现出巨大的应用价值,检测人员必须充分掌握其方法性能,并采取相应质控措施,才能确保实验结果的准确性[3]。因此,本文通过对本实验室开展的HBV-DNA定量检测方法学性能验证情况进行分析,为PCR检测项目的方法学验证提供设计方案。
荧光定量PCR检测HBV-DNA方法的正确度验证,可以采用室间质评结果或CAP能力验证结果,验证检测方法的准确性和可比性,该方法更权威可靠,更具可比性[4]。精密度验证可以使用第三方质控品或采用室内质控检测数据进行统计分析,由于质控是每天随病人标本同时检测,因此该方法既能够节约成本,又能够真实反映检测系统的重复性,可以为精密度验证评价提供更充分依据[5]。
表1和表3的验证结果显示,偏倚百分比均<±7.5%。从线性验证结果来看,5个浓度的样本均检出,相关系数R=0.9913,与理论值呈显著的相关性。用于线性范围验证的样本应覆盖整个检测系统的范围,且样本的稀释和检测都可能存在误差,所以暂定1.00E+02为检测下限,但并没有得到具体的检测上限,暂定线性范围为1.00E+02~5.00E+08 IU/ml。由于抗干扰能力也会影响检测准确性,故本文分别对黄疸、脂血、溶血样本进行验证,结果均与试剂生产厂家的声明结果一致。
综上所述,实验室在开展PCR检测项目前,需对正确度、精密度、线性范围、抗干扰能力等方法学性能进行验证。本文验证的方法学性能指标均能满足预期临床用途,表明本实验室能够为临床工作提供有效支持。

