花色苷脂肪酸脂酚衍生物工艺优化及功能性脂肪酸分析
李珊,孙万成,罗毅皓
(青海大学 农牧学院,西宁 810016)
牦牛是我国的青藏高原地区最主要的家畜,从其牛奶中提取的脂肪称为牦牛酥油,性状类似黄油。牦牛酥油富含多种功能性脂肪酸[1],且一些功能性脂肪酸含量较普通黄油差异明显,譬如亚油酸是普通黄油的3倍,花生四烯酸和二十碳五烯酸(EPA)是普通奶油4倍和2倍,二十二碳六稀酸(DHA)含量也较普通奶油中的含量高[2]。
黑枸杞(LyciumruthenicumMurr.)为茄科枸杞属多棘刺灌木,在我国主要分布于青海、宁夏、甘肃等西部地区,其果实味甜多汁,富含花青素和多糖等多种类活性成分,营养丰富[3]。花青素作为一种植物色素,是单糖通过糖苷键连接形成的花色苷[4],由于花色苷的糖基化B环结构,使其具有较强的抗氧化活性,可以很好地清除自由基[5]。花青素归属酚类化合物中的类黄酮类,其最大的特点是具有数量不等的酚羟基[6]。
功能性脂肪酸可以有效降低人体血脂、血糖水平,减少心血管疾病的发病率和死亡率,具有预防癌症、糖尿病、婴儿发育不良和神经及精神类疾病的作用[7],尤其对胃癌、乳腺癌、肝癌等恶性肿瘤具有很强的抑制作用,能使大脑功能和视觉功能最佳化[8]。研究最广泛的是不饱和脂肪酸n-3系列和n-6系列[9]。不饱和脂肪酸作为多种代谢物(白细胞三烯、羟基脂肪酸和前列腺素)的前体,具有重要的生物活性[10]。由于哺乳动物缺乏合成不饱和脂肪酸的能力,必须进行膳食干预。然而,这种脂肪酸用于预防目的的实际用途是有限的,它们大部分易氧化,发生酸败,产生不良风味[11]。近年来,人们从一些天然脂酚中发现了两种物质的结构关系,对具有强抗氧化性的抗氧化剂如多酚类物质与易氧化的化合物进行反应结合生成脂酚衍生物产生了兴趣,将天然抗氧化剂与功能性脂肪酸进行反应制备脂酚衍生物,终止脂肪酸氧化的同时提高多酚的脂溶性,可将衍生物复配添加至脂质基质中,将大大拓展多酚的应用市场[12]。Young等[13]将白藜芦醇与不同链长的脂肪酸发生酯化反应,对其进行结构修饰后发现白藜芦醇衍生物的脂溶性和抗氧化性都有所增强,拓展了其在调味品保鲜及亲油性食品中的潜在应用。本研究选择黑枸杞中提取的花色苷作为抗氧化剂,以牦牛酥油中提取的游离脂肪酸作为酰基供体发生酶法酯化反应制备衍生物,对其反应进行优化,研究反应后功能性脂肪酸是否进行富集,制备功能性脂肪酸含量高的脂酚衍生物,为今后的研究奠定了基础。
1 材料与方法
1.1 试验材料
牦牛酥油:青海省祁连县;新鲜黑枸杞:青海省格尔木市;三氟化硼甲醇:成都艾科达化学试剂有限公司;南极洲假丝酵母脂肪酶(CALB):杭州创科生物科技有限公司;AB-8大孔吸附树脂:东鸿试剂有限公司。分析纯正己烷、无水乙醇、异丙醇、氯仿、乙酸乙酯、石油醚、丙酮、甲醇:北京捷联特科技有限公司;分析纯氢氧化钾、磷酸二氢钾、氢氧化钠、浓盐酸、95%乙醇、氯化钠、无水硫酸钠:苏州清泉化工贸易有限公司。
1.2 仪器与设备
GC-MS-TQ8050 NX气相色谱-质谱联用仪 日本岛津公司;电热恒温水浴锅 上海比朗仪器有限公司;电热鼓风干燥箱、MVS-1旋涡混合器、THZ-A2恒温振荡器 常州国华电器有限公司;LC-04C高速4 ℃离心机 江苏正基仪器有限公司;JM-13 3003电子天平 诸暨市超泽衡器设备有限公司。
1.3 试验方法
1.3.1 黑枸杞花色苷提取、分离及纯化
参照文献[14]并稍作改动,称取2 g黑果枸杞干粉于锥形瓶中,加入50 mL 80%乙醇(1%盐酸酸化),避光恒温超声辅助提取,保留滤液。将滤液减压浓缩(50 ℃),回收乙醇。将50 mL浓缩液置于锥形瓶中,加入5 g树脂和100 mL蒸馏水,于30 ℃,150 r/min 的恒温摇床中进行振荡10 h,使其充分吸附至饱和。将吸附饱和的大孔树脂充分过滤后,加入pH 3.0的80%酸性乙醇溶液20 mL,于30 ℃,150 r/min的恒温摇床中进行振荡处理,使其充分解吸,将解吸液在40 ℃条件下减压蒸馏,再冷冻干燥,得到纯度为85%的黑果枸杞花色苷粉末。
1.3.2 牦牛酥油尿素络合纯化游离脂肪酸
本研究采用皂化-酸化法粗提游离脂肪酸,再经络合结晶法纯化游离脂肪酸。
1.3.3 酶法酯化反应
将花色苷粉末、游离脂肪酸、有机溶剂、分子筛和磁力转子依次加入到螺旋玻璃反应管中。将反应管放置于设有一定温度的磁力搅拌器中溶解花色苷粉末。溶解完全后加入催化剂脂肪酶CALB,在一定温度下反应若干小时后取出。反应完成后,用滤纸滤除酶和分子筛终止反应。用旋转蒸发器回收乙醇,得到酶法酯化产物粗品。将上述酯化产物粗品用乙酸乙酯-水混合液萃取3次,收集乙酸乙酯层,用旋转蒸发器浓缩干燥后得到酶法酯化产物。
1.3.4 酶法酯化产物转化率的计算

1.3.5 单因素试验
本研究酯化反应以反应溶液、脂肪酶添加量、反应温度、反应时间和纯化后的花色苷与游离脂肪酸底物摩尔比作为单因素进行试验,并计算酯化反应的转化率确定,最优反应发生的条件,单因素试验设计如下:
反应溶剂:取0.50 g花色苷粉末和1.00 g游离脂肪酸加入2.0%(W/W)CALB,在反应温度为50 ℃、反应时间为12 h的条件下,考察50 mL反应溶剂(乙酸乙酯、甲醇、乙醇、丙酮、异丙醇)对酯化反应的影响。
脂肪酶添加量:取0.50 g花色苷粉末和1.00 g游离脂肪酸加入到装有50 mL乙醇的螺旋玻璃反应管中,在反应温度为50 ℃、反应时间为12 h的条件下,考察脂肪酶添加量(1.0%、1.5%、2.0%、2.5%、3.0%)对酯化反应的影响。
反应温度:取0.50 g花色苷粉末和1.00 g游离脂肪酸混合到装有50 mL乙醇的螺旋玻璃反应管中,加入2.0%(W/W)CALB,在反应时间为12 h的条件下,考察反应温度(40,45,50,55,60 ℃)对酯化反应的影响。
反应时间:取0.50 g花色苷粉末和1.00 g游离脂肪酸加入2.0%(W/W)CALB,在反应温度为50 ℃的条件下,考察反应时间(4,8,12,16,20 h)对酯化反应的影响。
花色苷与游离脂肪酸底物摩尔比:取花色苷粉末和游离脂肪酸不同底物摩尔比加入2.0%(W/W)CALB,在反应温度为50 ℃、反应时间为12 h的条件下,考察花色苷与游离脂肪酸不同摩尔比(1∶1、1∶1.5、1∶2、1∶2.5、1∶3)对酯化反应的影响。
1.3.6 响应面法优化酯化反应工艺条件
根据单因素试验确定的因素和水平,采用响应面设计最佳反应条件。根据Box-Benhnken的中心组合试验设计原理,研究脂肪酶添加量(A)、反应温度(B)、反应时间(C)、底物摩尔比(D)对酯化反应转化率的影响。
1.3.7 脂肪酸组成分析
1.3.7.1 样品甲酯化
取适量样品,加入5 mL正己烷溶解,加入0.5 mol/L氢氧化钾甲醇溶液,超声10 min,定容至10 mL,静置2 h,取上清液,加入无水硫酸钠除水后待GC-MS分析使用。
1.3.7.2 GC-MS分析
GC-MS条件:进样量1 μL,汽化温度:280 ℃,气体流量:50 mL/min,载气:氦气。
升温程序:150 ℃(5 min),5 ℃/min→200 ℃(6 min),2 ℃/min→230 ℃(25 min)。
质谱条件:DB-5MS色谱柱(60 m×0.25 mm×0.25 μm);离子源温度:250 ℃;接口温度:285 ℃。
1.3.8 数据处理
采用Excel 2007进行数据处理,结合 SPSS 数据处理软件进行统计分析。
2 结果与分析
2.1 单因素试验分析
2.1.1 反应溶液对酶法酯化反应的影响
5种不同的反应溶剂作为发生反应的介质,对酯化反应转化率的影响见图1。

图1 反应溶液对酶法酯化反应转化率的影响 Fig.1 Effect of reaction solution on conversion rate of enzymatic esterification
由图1可知,反应溶剂为乙醇时,酯化反应的转化率最高,这可能与有机溶剂的油水分配系数(log p)值有关。Laane等[15]研究发现反应酶活与有机溶剂的log p值有关,有机溶剂的log p值越低,反应转化率越高。本研究选用5种不同的有机溶剂,乙酸乙酯(log p=0.68)、甲醇(log p=-0.76)、乙醇(log p=-0.24)、丙酮(log p=-0.23)、异丙醇(log p=0.28)。作为反应溶剂,酶法酯化反应转化率依次为乙醇>丙酮>甲醇>异丙醇>乙酸乙酯。因此,试验选择乙醇为反应溶剂。
2.1.2 脂肪酶添加量对酶法酯化反应的影响
反应中添加不同量的脂肪酶对酯化反应转化率的影响见图2。
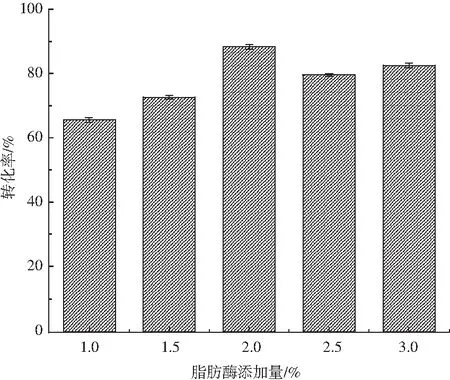
图2 脂肪酶添加量对酶法酯化反应转化率的影响Fig.2 Effect of lipase additive amount on conversion rate of enzymatic esterification
脂肪酶作为催化剂会直接影响反应速率及达到平衡的时间,是影响酯化反应的一个重要因素。由图2可知,选用的CALB对酯化反应的催化效果明显。添加1.0%的脂肪酶时,酯化反应的转化率为65.67%。当脂肪酶添加量为2.0%时,酶法酯化反应的转化率最高,可达88.20%。当脂肪酶添加量超过2.0%后,反应转化率呈现下降趋势,这可能是因为适量的酶作为催化剂可以加速反应的进行,但过量会导致酶与底物的接触面积减少,从而降低酶与底物的活性位点的接触,最终影响反应的进行[16]。因此,确定脂肪酶添加量为2.0%。
2.1.3 反应温度对酶法酯化反应的影响
反应温度对酶法酯化反应的影响见图3。

图3 反应温度对酶法酯化反应转化率的影响Fig.3 Effect of reaction temperature on conversion rate of enzymatic esterification
由图3可知,酶法酯化反应的转化率随着温度的升高而增加,当温度达到50 ℃时,反应的转化率最高,达86.20%。对于酯化反应而言,提高温度可以促进底物分子之间的碰撞,从而加快反应速率,当温度达到酶的最适温度时,酶的活性最高[17]。继续提高温度,转化率有下降的趋势。由于酯化反应是吸热的可逆反应,当温度过高时会发生水解反应,导致转化率下降[18]。且超过酶最适温度的高温会使酶活性及选择性丧失,也会导致转化率降低。因此,选择50 ℃为酶法酯化反应的最佳温度。
2.1.4 反应时间对酶法酯化反应的影响
反应时间对酶法酯化反应的影响见图4。

图4 反应时间对酶法酯化反应转化率的影响Fig.4 Effect of reaction time on conversion rate of enzymatic esterification
由图4可知,当反应时间由4 h增加到12 h时,发现酶法酯化反应的转化率显著增加。当反应时间为12 h时,转化率高达86.10%。当反应时间超过12 h后,反应转化率无明显差异,表明反应趋于平稳,考虑试验条件及效率,选择12 h为酶法酯化反应的最佳反应时间。
2.1.5 花色苷与游离脂肪酸底物摩尔比对酶法酯化反应的影响[19]
花色苷与游离脂肪酸底物摩尔比对酶法酯化反应的影响见图5。

图5 底物摩尔比对酶法酯化反应转化率的影响Fig.5 Effect of substrate molar ratio on conversion rate of enzymatic esterification
酯化反应作为一个可逆反应,底物的用量是影响转化率的一个重要因素。由图5可知,将花色苷粉末与脂肪酸质量比从1∶1增加到1∶2时,反应的转化率明显提高,最高达86.5%。当底物质量比超过1∶2时,反应的转化率开始降低,这是因为当脂肪酸含量较多时会稀释脂肪酶的浓度,影响酶的催化作用,从而降低转化率。
2.2 响应面法优化酯化反应工艺条件
根据单因素试验确定的因素和水平,采用响应面设计确定最佳工艺条件。根据Box-Benhnken的中心组合试验设计原理,研究了脂肪酶添加量(A)、反应温度(B)、反应时间(C)、底物摩尔比(D)对酶法酯化反应转化率的影响。响应面试验因素与水平和响应面试验设计及结果见表1和表2。

表1 响应面试验因素与水平Table 1 Response surface experimental factors and levels

表2 响应面试验设计与结果Table 2 Response surface experimental design and results
2.2.1 转化率的响应面模型的建立与方差分析
各因素经回归拟合得到转化率与脂肪酶添加量、反应时间、反应温度和底物摩尔比的二次多项式回归模型:Y=+86.80+8.67A+7.02B+0.53C+12.73D-0.88AB-0.32AC-9.95AD+3.03BC+8.80BD-1.35CD-0.65A2-10.65B2-3.43 C2-9.45D2。
该模型的方差分析见表3。
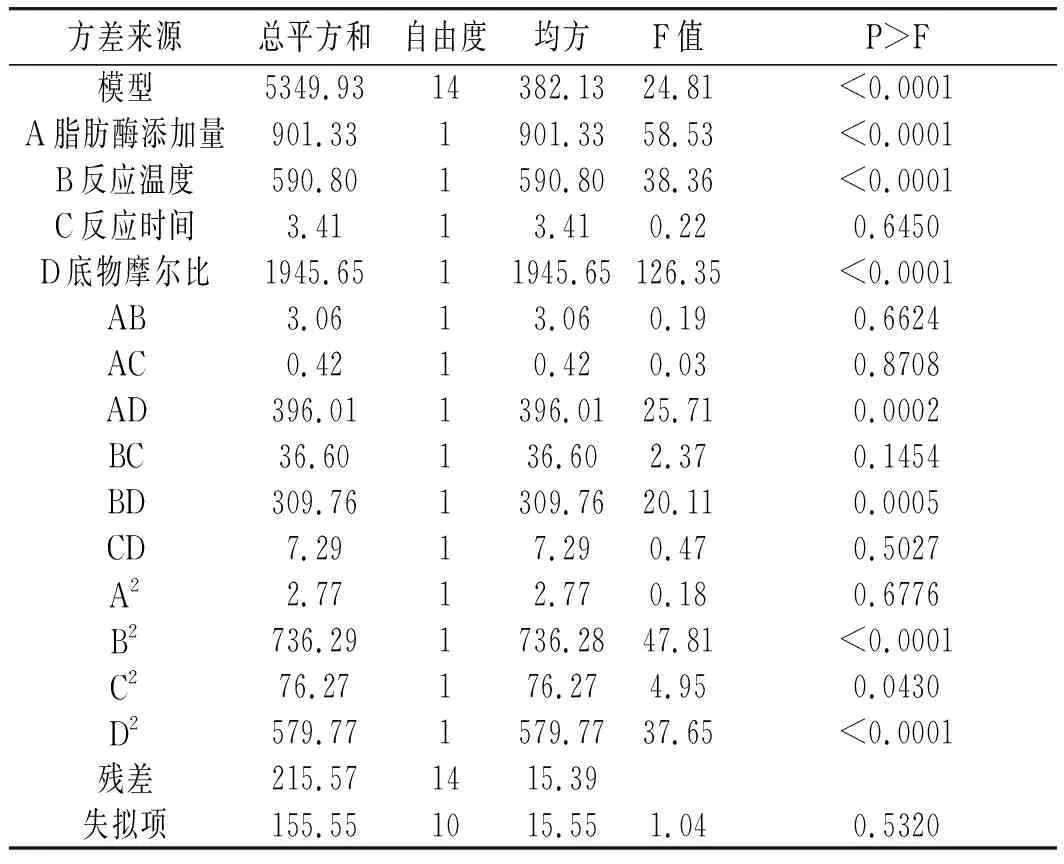
表3 转化率方差分析Table 3 Analysis of variance of conversion rate

续 表
由表3可知,该模型的P<0.01,差异显著。失拟项的P=0.5320>0.05,不显著,说明模型可以很好地预测酶法酯化反应的转化率,具有实际应用意义。脂肪酶添加量(A)、反应温度(B)、反应时间(C)、底物摩尔比(D)对转化率的影响均显著;影响反应转化率的顺序依次是A>B>C>D。
2.2.2 响应面试验优化最佳条件及模型的验证
利用Design Expert软件进行岭脊分析,得到模型最佳点为:脂肪酶添加量1.90%、反应温度53.90 ℃、底物摩尔比1∶2.03、反应时间11.36 h。在此条件下转化率预测值为92.60%。结合实际条件,选择脂肪酶添加量2.0%、反应温度50 ℃、底物摩尔比1∶2、反应时间12 h进行验证,得到反应转化率为91.55%。试验值与预测值相近,表示响应面试验优化得到的方案可靠。
2.3 游离脂肪酸与酶法酯化产物的脂肪酸组成分析
对游离脂肪酸和脂酚产物进行甲酯化处理,用GC-MS检测分析两者的脂肪酸组成成分,图谱见图6和图7,脂肪酸成分见表4。

图6 反应前脂肪酸GC-MS谱图Fig.6 GC-MS spectra of fatty acid before reaction
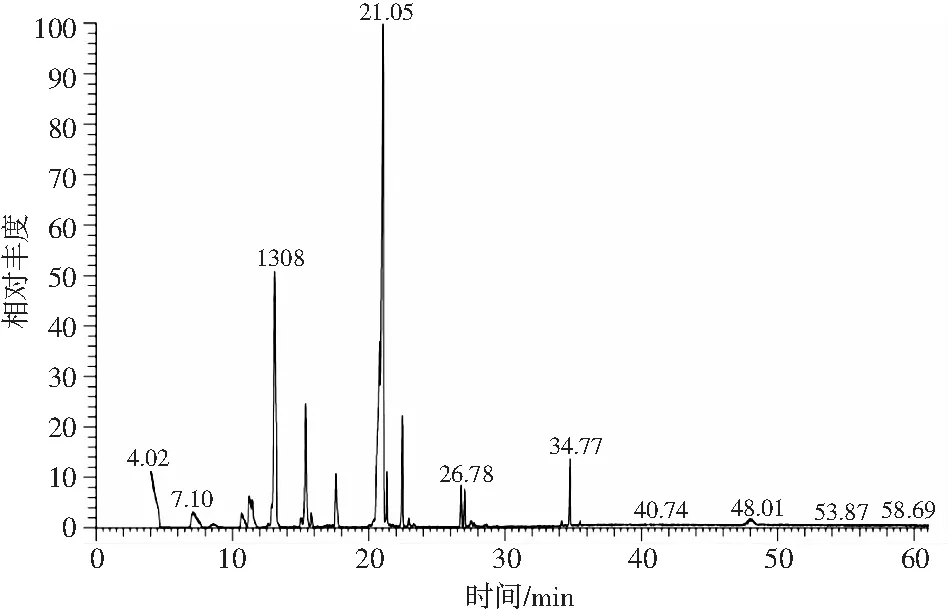
图7 反应后脂肪酸GC-MS谱图Fig.7 GC-MS spectra of fatty acid after reaction

表4 酯化反应前后脂肪酸含量变化(平均值±标准差)Table 4 Changes in fatty acid content before and after esterification %
由表4可知,反应前提取的游离脂肪含有1.12%的支链脂肪酸,酯化反应得到的产物支链脂肪酸含量增加了25.62%,是反应前的23倍。支链脂肪酸作为一种具有特殊结构的脂肪酸,与直链脂肪酸相比氧化稳定性更好,具有降脂、抗炎、抗癌等生理活性。饱和脂肪酸含量从 56.18%下降至27.64%。人体摄入过量的饱和脂肪酸会导致动脉粥样硬化等疾病,本试验中饱和脂肪酸含量的降低可能是因为部分脂肪酸在酶促作用下转化成了不饱和脂肪酸。多不饱和脂肪酸含量增加了4.38%,尤其是DHA增加了3.24%。本研究富集的脂肪酸主要是n-6多不饱和脂肪酸,其中亚油酸7.71%,DHA 3.24%,γ-亚麻酸的代谢物PGE1 33.55%。PGE1是γ-亚麻酸的环氧合酶代谢物,在体内可以转变成具有扩张血管作用的前列腺环素(PGI2),保持与血管收缩素的平衡,防止血栓的形成。
3 结论
将花色苷粉末与游离脂肪酸在脂肪酶CALB的催化下发生酯化反应合成脂酚产物,通过单因素试验和响应面法优化试验条件获得脂肪酸转化率最高的工艺条件为:脂肪酶添加量为2%,反应温度为50 ℃,反应时间为12 h,底物摩尔比为1∶2,该条件下酯化反应的转化率最高可达,91.55%。将经过甲酯化处理的游离脂肪酸和脂酚产物进行GC-MS检测,分析比较两者的脂肪酸组成成分。结果表明酯化产物脂酚衍生物功能性脂肪酸明显富集,支链脂肪酸和多不饱和脂肪酸都显著增加,饱和脂肪酸含量降低。
本研究为今后多酚与脂肪酸结合研究提供了思路与参考。将亲水性的多酚提高脂溶性的同时添加脂质基质,使功能性脂肪酸有所富集,不仅可以拓宽花色苷等多酚物质作为天然抗氧化物在食品中的应用,而且可凭借富集的功能性脂肪酸应用于功能性食品中。

