植物乳杆菌发酵对小米风味物质的影响
陈忠恕,王晓闻
(山西农业大学 食品科学与工程学院,山西 晋中 030801)
小米,又名粟米,具有生育期短、适应性强且不易腐败的特点。山西省素有“小杂粮王国”的美称,有数据显示,在2014年之后,山西省拥有全国最大的小米种植面积;在2017年达到311.8万亩,约占全国小米种植面积的1/7,总产量占全国的1/3(58.7万吨)[1]。小米是一种优质的药食同源杂粮,具有很高的营养价值和功能特性。《本草纲目》中这样描述小米:“治反胃热痢,补虚损,开肠胃”[2]。古书《灵柩经》则认为小米除“补气、养胃”这些功能外,还能预防和治疗某些妇科疾病[3]。现代中医研究发现,小米有清热解毒、健胃安眠的功效,能够成为孕妇和伤病患者在康复过程中以及婴幼儿在断乳食期的主要食物之一[4]。
植物乳杆菌(Lactobacillusplantarum)是一类革兰氏阳性、兼性异型发酵乳酸菌,呼吸方式为厌氧或兼性厌氧,是被广泛应用于食品中的益生菌之一且极耐酸[5-6]和胆盐[7-8],因此在运用搭配食品及加工中发挥了巨大的作用,如发酵酸奶、泡菜及肉类等。发酵食品拥有其独特的风味,同时也是让益生菌进入体内的良好方式。植物乳杆菌能够增强人体免疫力[9-10];调节人体肠道菌群[11];吸附有害物质,如铅[12]、镉[13]和铝[14]。
植物乳杆菌还能清除塑化剂[15]、展青霉素。
顶空气相色谱-离子迁移谱联用技术(gas chromatography-ion mobility spectroscopy,GC-IMS)是一项新兴检测手段,于大气压下就能开始检测。在气相色谱和离子迀移谱综合运用下,对得到的化学信息及测定特征对比能得到更好的结果[16]。目前,GC-IMS技术在食品中的应用主要是在食品的安全控制及过程分析等方面,如检测掺假油样[17]、绿茶品种[18]、茶叶质量[19]及区分白酒香型[20]等。但利用GC-IMS检测小米粉发酵过程中的风味物质变化的研究鲜有报道。
本研究以植物乳杆菌发酵制得发酵0,12,24,36,48,60,72 h的小米粉,利用GC-IMS技术测定不同时间其挥发性成分,利用与仪器配套的分析软件Vocal对物质进行定性分析;利用插件Reporter建立三维图谱、二维俯视图谱;利用Gallery Plot插件建立指纹图谱;通过HemI软件建立热图进行聚类分析;通过SIMCA 14.1对样品进行偏最小二乘法判别分析(PLS-DA);利用OriginPro 2019处理PLS-DA得到的样品VIP值。
1 材料与方法
1.1 试验材料
小米(晋谷21号):产自山西省晋中市太谷区;植物乳杆菌(CICC20265):由山西农业大学食品科学与工程学院提供。
1.2 试验试剂
高温α-淀粉酶(食品级)、糖化酶、MRS肉汤:均由北京索来宝科技有限公司提供。
1.3 试验仪器
BS210S电子天平 北京赛多利斯天平有限公司;HSJ-4恒温水浴搅拌器 江苏科析仪器有限公司;QJ-06磨粉机 上海东华高压均质机厂;YSQ-LS-S高压灭菌锅、BJ-ICD无菌操作台 上海博讯实业有限公司医疗设备厂;SCIENTZ-18N真空冷冻干燥机 宁波新芝生物科技股份有限公司;DHP-500恒温培养箱 北京永光明医疗仪器厂;Flavour Spec®风味分析仪 德国G.A.S公司;CTC-PAL自动顶空进样器 瑞士CTC Analytics公司;SE-54毛细管柱 德国CS-Chromatographie Service设备供应商。
1.4 试验方法
1.4.1 小米预处理
取洁净的小米籽粒于研磨机中充分研磨,过80目筛备用。
1.4.2 菌种活化
取配制好的MRS培养基10 mL于试管中,121 ℃灭菌15 min。在无菌操作台上用接菌环挑取少量乳酸菌菌粉置于培养基中振荡混合,37 ℃恒温培养24 h(活化好的乳酸菌菌液呈现浑浊状态)。
将试管中活化好的乳酸菌菌液接入装有100 mL培养基的锥形瓶中,37 ℃恒温培养24 h。以同样步骤再进行两次扩大培养试验,最后一次扩大培养的菌液放到4 ℃冰箱中储存。
1.4.3 小米粉的糊化、糖化、液化
糊化:取20 g小米粉,按1∶10料液比于紫外照射下浸泡12 h后加热50 min至80 ℃。
液化:在糊化后的料液中加入高温α-淀粉酶18 U/g,80 ℃加热60 min。
糖化:在液化后的料液中加入糖化酶180 U/g,50 ℃加热60 min。
1.4.4 发酵试验
按3%(W/W)添加发酵剂,设0(空白),12,24,36,48,60,72 h 7组样品,冻干成粉并在-18 ℃下保存待测。
1.4.5 风味分析仪测定
1.4.5.1 样品处理
取发酵完成的各小米粉样品各1 g,置于20 mL顶空瓶中,80 ℃孵育15 min后进样100 μL。
1.4.5.2 GC条件
设置气相色谱柱温度为 60 ℃,测定过程中的载气为高纯N2;载气流速为小米粉风味物质分离最适流速:初流速为2 mL/min,保持20 min,然后升至 100 mL/min,保持10 min,总分析时间为30 min。
1.4.5.3 IMS检测条件
设置IMS漂移管温度为45 ℃,测定过程中的漂移气为高纯N2,漂移气的流速保持在150 mL/min不变;漂移管内的电离源为氘放射,即β射线,离子化模式为正离子模式。
1.5 数据处理
利用与仪器配套的分析软件Vocal对物质进行定性分析;利用插件Reporter建立三维图谱、二维俯视图谱;利用Gallery Plot插件建立指纹图谱;通过HemI软件建立热图进行聚类分析;通过SIMCA 14.1对样品进行偏最小二乘法判别分析(PLS-DA);利用OriginPro 2019处理PLS-DA得到的样品VIP值。
2 结果与分析
2.1 不同发酵时间小米粉样品中VOCs的定性
样品经过气相色谱分离,然后基于保留时间和迁移时间通过离子迁移谱分析。检测出的小米发酵粉挥发性成分的定性分析以图1中的编号表示,纵坐标为保留时间,横坐标为迁移时间。GC-IMS共检测出50个信号峰,通过软件内置的NIST GC数据库及G.A.S的IMS数据库,确定了40种挥发性成分,一共包括12种醛类、10种醇类、6种酮类、11种酯类和1种呋喃类物质,鉴定出的组分见表1,包括化合物名称、CAS号、分子量、保留指数、保留时间、迁移时间。其他有信号峰但无法检测出的VOCs未列出。当穿过迁移区域时,由于分析的离子和中性分子之间形成聚合物(如二聚体和三聚体),因此某些VOCs[21]检测到多个信号峰。由于单体和二聚体的存在,戊醛、己醛、反式-2-戊烯醛反式-2-庚烯醛、丁醇、1-戊醇、正己醇、反式-2-己烯-1醇、乙酸乙酯、乙酸丁酯、丁酸丙酯、己酸乙酯均表出双峰。

图1 不同发酵时间的小米粉离子迁移谱图谱Fig.1 Ion migration spectra of millet flour at different fermentation time
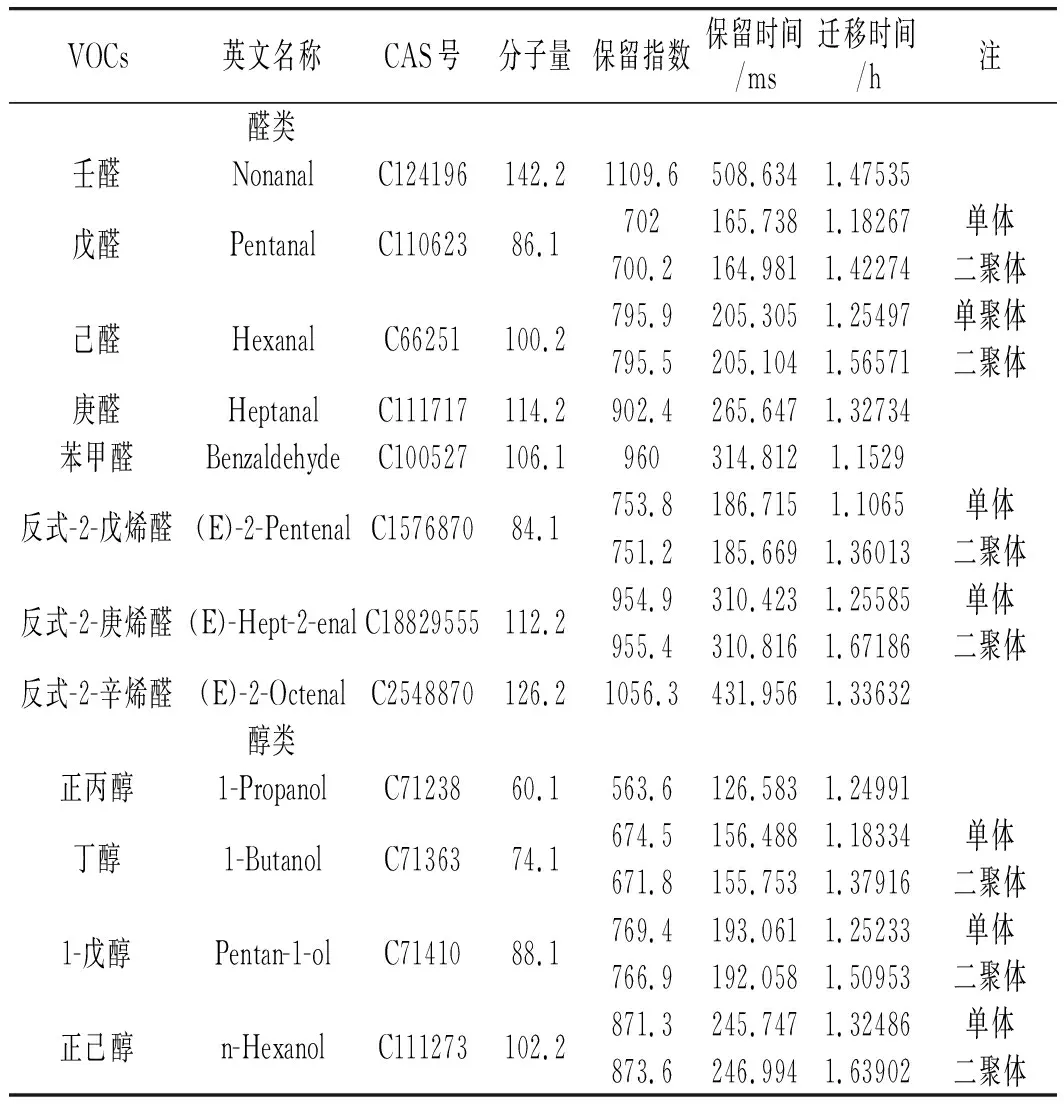
表1 小米粉中检测出的VOCs信息Table 1 The VOCs information detected in millet flour
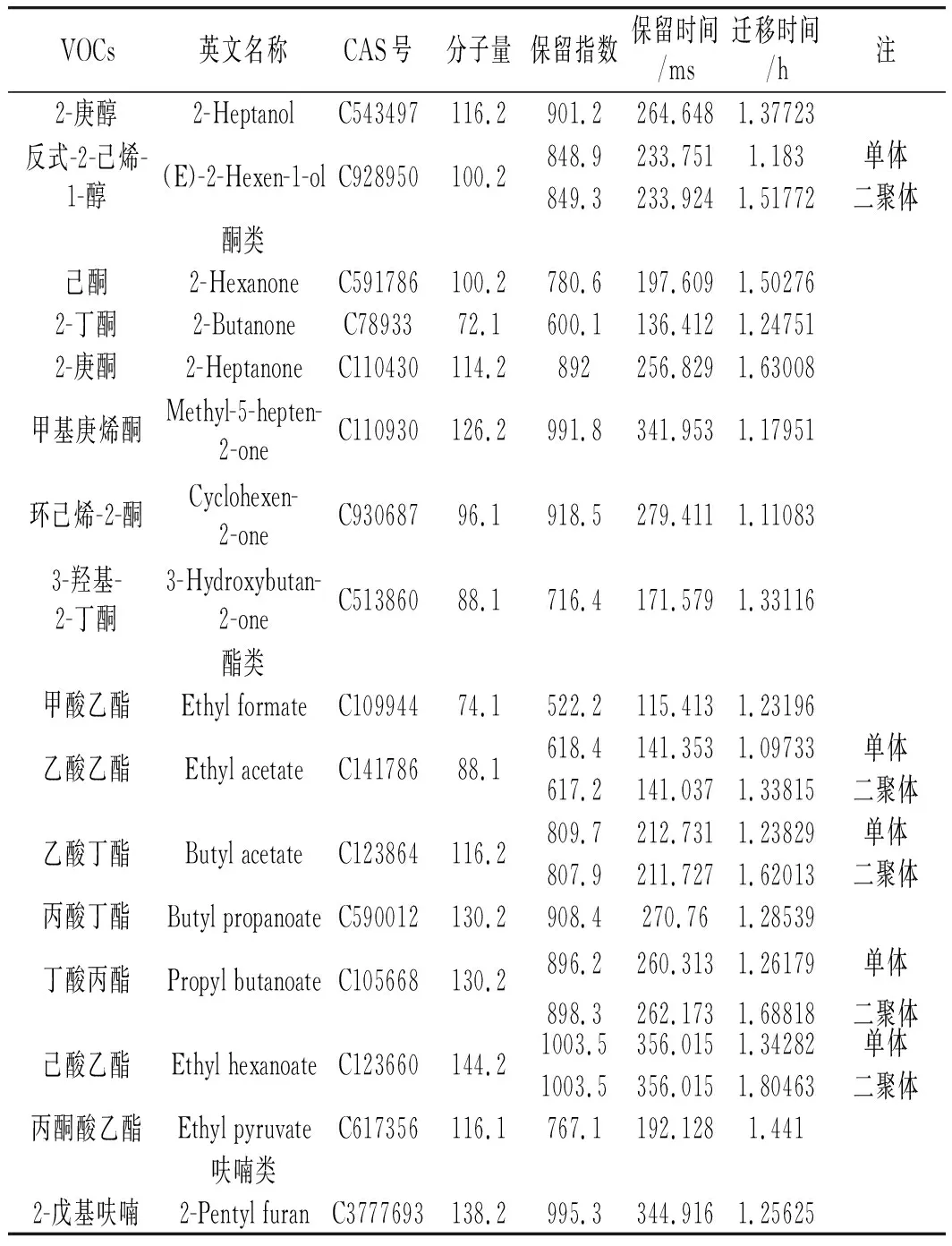
续 表
2.2 不同发酵时间小米粉挥发性成分三维谱图差异分析
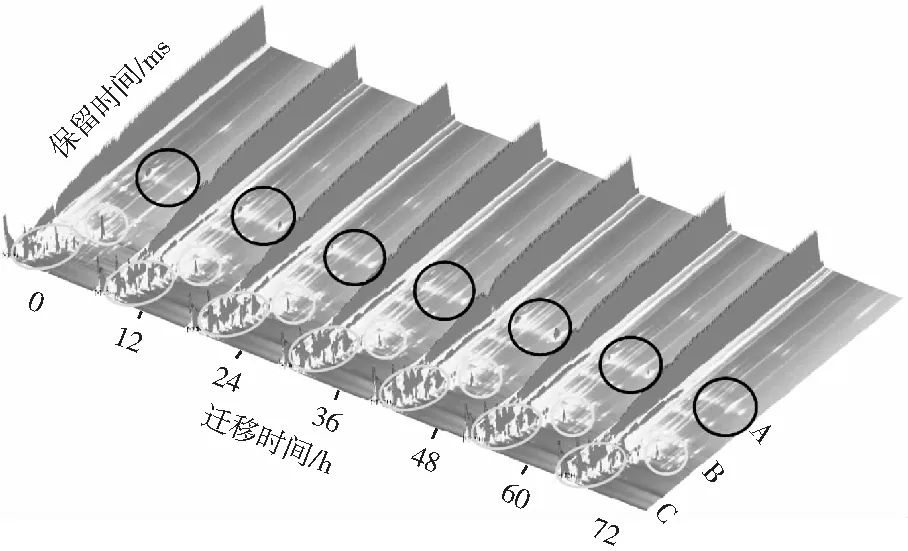
图2 不同发酵时间的小米粉中VOCs成分三维谱图Fig.2 Three-dimensional spectra of VOCs in millet flour at different fermentation time
为了便于直观地观察和比较,采用三维谱图对不同小米粉在不同发酵时间产生的VOCs进行了表征。由图2可明显看出,随着发酵时间的增大,一些VOCs的含量降低,形成新的物质。其中,A部分的峰高在0~36 h内持续降低,48 h出现新的峰高,然后又降低。B部分的峰高随着发酵时间的增加不断降低。而在C部分可以观察出小米粉发酵后比0 h的小米粉样品出现了很多新的峰值,由此断定小米粉在植物乳杆菌发酵的影响下产生了新的风味物质且可能主要集中在这个保留时间和迁移时间段,由于此处的信号峰较为密集,不易判断和分析,因此利用俯视图作不同发酵时间的差异对比(见图3)。
2.3 不同发酵时间小米粉挥发性成分二维俯视谱图差异分析
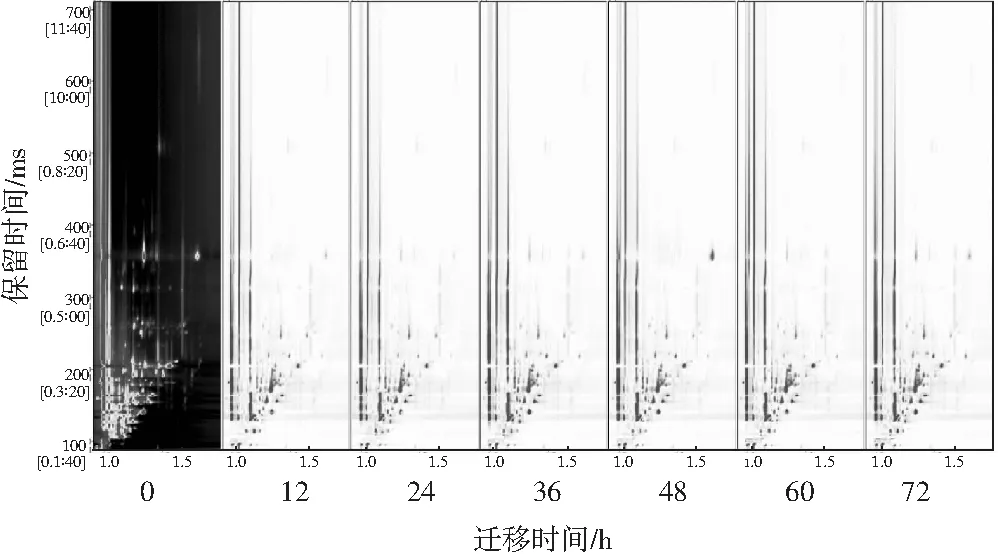
图3 小米粉不同发酵时间的二维谱图Fig.3 Two-dimensional spectra of millet flour at different fermentation time
由于三维谱图能观察到VOCs信号峰出现的位置,但如果出现信号峰分布比较密集的情况,不利于观察比较样品间的差异,且信号峰之间的峰高差异不显著,因此利用二维俯视图进行比较,见图3。横坐标1.0处的线是反应离子峰(reaction ion peak,RIP)。RIP峰两侧的每个点分别为一种挥发性有机物,颜色越深表示此化合物浓度越高[22]。以发酵0 h的小米粉为参照,对比其他样品中所有的挥发性物质的差异。可以观察小米粉所含的VOCs主要集中在迁移时间100~300 ms之间,且与发酵0 h的小米粉相比,在此保留时间范围内,VOCs有明显变化。这一发现表明,小米粉在乳酸菌发酵的作用下生成了小米粉自身不含的挥发性物质且本身含有的某些挥发性物质含量降低。
2.4 不同发酵时间小米粉挥发性有机化合物指纹图谱分析
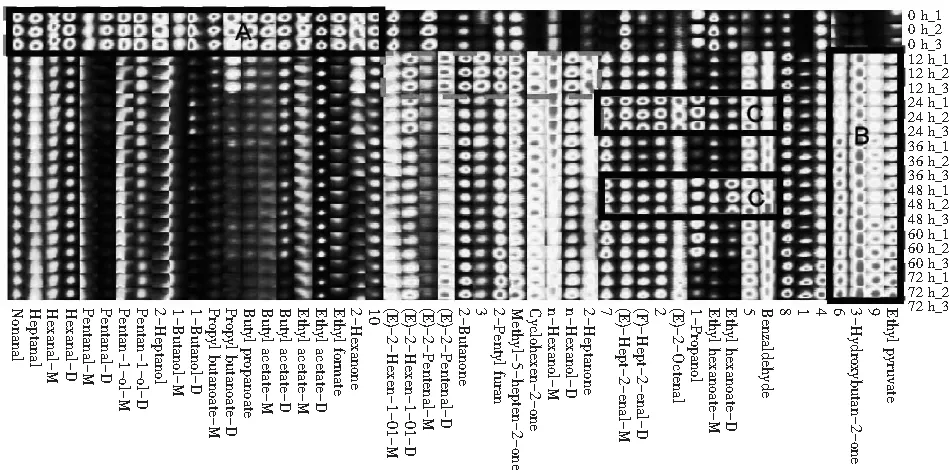
图4 小米粉样品挥发性化合物的指纹谱图Fig.4 Fingerprint spectra of volatile compounds in millet flour samples
虽然三维及二维谱图能体现出小米粉样品在发酵过程中的变化趋势,但很难对图中密集区域的VOCs作出准确的判断分析,而指纹谱图很好地解决了这个问题。以三维谱图的峰值信号,形成的小米粉样品挥发性化合物的指纹谱图(见图4),每一行代表一个样品的全部信号峰,每一列代表不同样品中的同一VOCs。指纹谱图上的每个点代表一种VOC的含量,点的颜色越亮,说明该VOC在此样品中的含量越高。指纹图谱中名称相同的两种化合物为单体及其二聚体。二聚体的质子亲和力强及含量的增多使它们的迁移时间增长。通过指纹谱图能够直观地比较不同样品之间的VOCs种类及含量的区别,揭示了小米粉在发酵过程中各VOCs的动态变化。指纹谱图上的数字代表了未定性挥发性物质。对比整个发酵过程,小米粉中的VOCs含量有明显的变化,这是基于植物乳杆菌生长代谢过程中利用小米粉中的营养物质产生的代谢物导致的,同时使小米粉具有了特殊的风味。
小米粉的VOCs在发酵过程中不断发生变化,通过比较VOCs在不同阶段的谱点强度,可以确定该物质在发酵过程中的变化(增加、减少、消失或波动)。图4中A区域内的VOCs在0 h时含量丰富,但在发酵之后含量急剧减少甚至消失,有壬醛、正庚醛、正己醛、正戊醛、正戊醇、庚醇、正丁醇、丁酸丙酯、乙酸丁酯、乙酸乙酯及甲酸乙酯,这些物质是小米粉自身的风味物质,可能在植物乳杆菌生长代谢过程中被降解或者转化成其他的VOC物质。B区域中的3-羟基-2-丁酮、丙酮酸乙酯及两种未检测出的VOCs含量在发酵过程中不断增大。C区域的VOCs含量在发酵24 h达到最高值且在36 h减少而48 h时有一定上升趋势,总体在发酵过程中含量呈波动趋势,如反式-2-庚烯醛、反式-2-辛烯醛、正丙醇、己酸乙酯及编号为2,5,7的未检测出的VOCs。而反式-2-己烯-1-醇、反式-2-戊烯醛、2-丁酮、2-戊基呋喃、甲基庚烯酮、环己烯-2-酮、正己醇、2-庚酮在12 h时含量最大,随着发酵时间的增长不断减少。综合已检测出的VOCs,通过指纹图谱初步判断,虽然小米粉中2-庚酮、己醇、环己烯-2-酮、甲基庚烯酮、2-戊基呋喃、2-丁酮、反式-2-戊烯醛、反式-2-己烯-1-醇的含量在12 h达到最高值,但在发酵24 h后仍有较高含量,而3-羟基-2-丁酮和丙酮酸乙酯在发酵24 h后也已有较高含量且3-羟基-2-丁酮具有令人愉快的奶油香味;丙酮酸乙酯具有新鲜甜润的花果香气,不难看出在发酵24 h时风味物质含量最高且种类最丰富,可能在发酵24 h时小米粉样品的感官最佳。
2.5 基于热图对不同发酵时期的小米粉样品聚类分析
为了进一步分析小米在发酵过程中VOCs的差异,将不同样品中的VOCs含量作热图进行聚类分析,见图5。
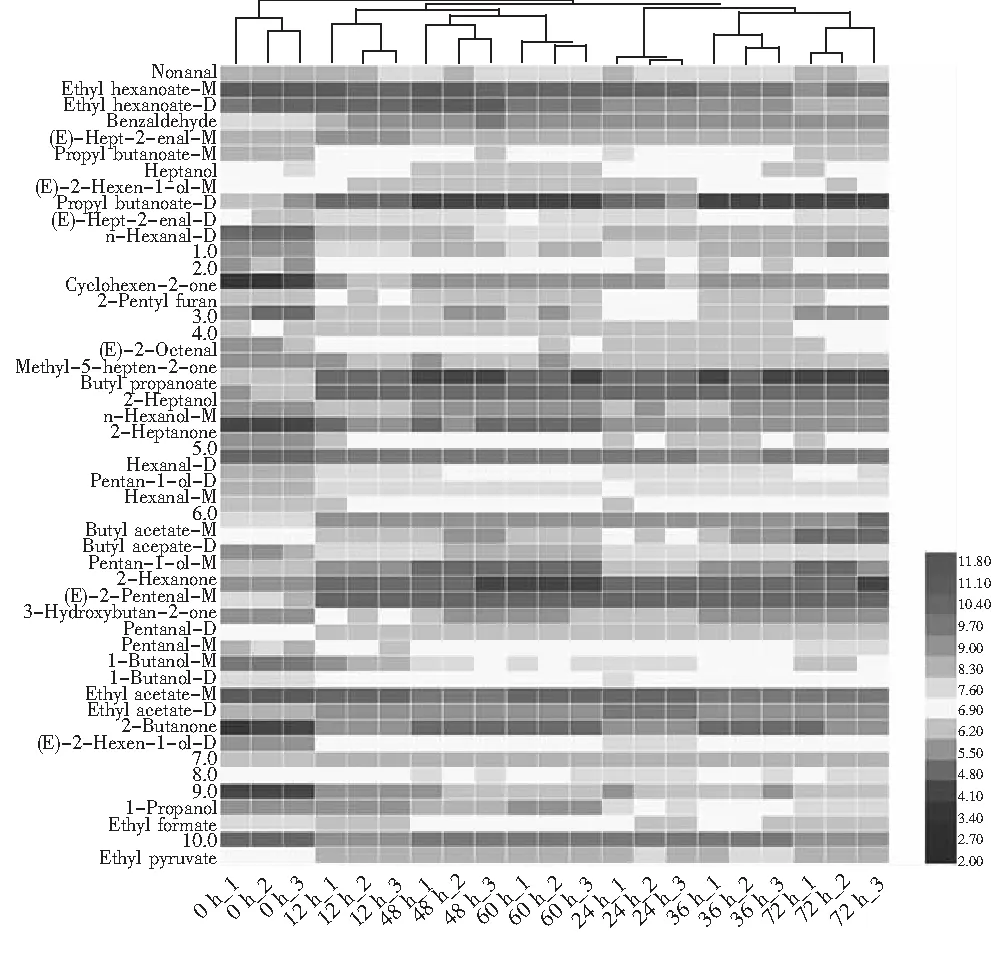
图5 不同发酵时间的小米粉热图及聚类分析Fig.5 Heat map and cluster analysis of millet flour at different fermentation time
由图5可知,所有样品可以分为发酵0 h的样品和其他发酵时间的样品两大类,因此可以说明植物乳杆菌发酵对小米粉的VOCs含量产生了巨大的影响。同时,发酵48 h和发酵60 h的样品、发酵36 h和发酵72 h的样品聚集到一起,说明它们之间的VOCs具有一定的相似度,发酵12 h的样品又和48 h及60 h的样品有一定的相似度,24,36,72 h的样品有一定的相似度,说明小米粉在发酵过程中VOCs含量的变化是不断波动的,此发现与指纹谱图结论一致。
2.6 小米发酵粉样品的PLS-DA分析
目前多数对GC-IMS结果的分析方法采用PCA主成分分析法[23-25],PCA可以清晰明了地展示数据组内的重复性和组间的差异性,评估数据的可重复性,发现可能存在的异常值,比如明显离群的样本点。但PCA是一种无监督的模式,属于探索性分析。由于样品间VOCs含量数据的复杂性,对于组间差异不够明显的样品,单纯的无监督分析不能很好地区分样本的组间差异,PLS-DA是有监督的模式,属于模型的方法,使用偏最小二乘回归建立VOCs表达量与样品之间的关系模型,对数据降维,这种监督模式通常可以更好地确立样本关系。
经PLS-DA分析,R2X=0.995,R2Y=0.978,Q2=0.919,R2X和R2Y分别表示模型所能解释X和Y矩阵信息的百分比,R2X-R2Y<0.3代表该模型较可靠。使用置换检验的方法对PLS-DA进行验证,次数为200次,得到检验统计量来评估模型拟合的质量。PLS-DA置换检验结果见图6,右侧是原始值,左侧是模拟值,所有左侧的R2值和Q2值均比右侧低,R2和Q2的回归线斜率大于1,且Q2的回归线截距为负值,说明该模型稳定性较好,未出现过拟合现象,具有较好的预测能力[26]。
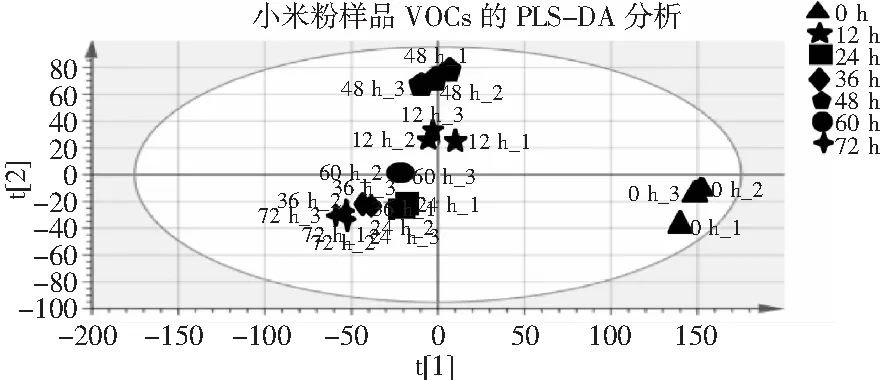
图6 小米粉样品PLS-DA得分图Fig.6 PLS-DA score scatter plot of millet flour samples
由图6可知,发酵不同时间段的小米粉样品通过PLS-DA得到了较好的区分,且发酵0 h的小米粉样品与其他样品表现出巨大差异,且发酵36 h的样品与发酵72 h的样品距离较近,24 h的样品与36 h及72 h的样品距离较近,表现出较高的相似度,与聚类分析结果一致。
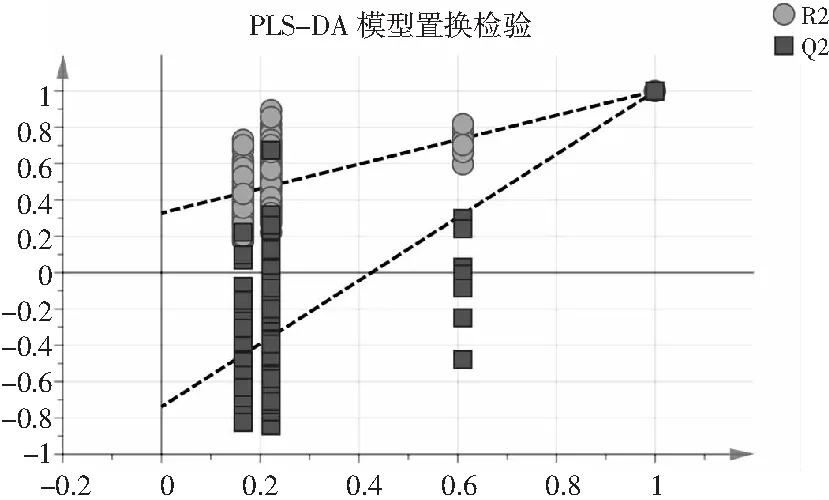
图7 模型置换检验图Fig.7 Model permutation test diagram

图8 小米粉样品中不同VOCs的VIP得分图Fig.8 VIP score plot of different VOCs in millet flour samples
变量投影重要度(variable importance for the projection, VIP)表征了分类过程中各个变量的重要性,通常VIP值大于1的变量在不同样本组(即不同发酵时间的小米粉样品)之间的区分中起着重要作用。通过VIP值筛选出15个差异标记物:己酸乙酯二聚体、乙酸乙酯二聚体、正丙醇、己酸乙酯、3-羟基丁烷-2-酮、2-庚酮、反式-2-庚烯醛、正己醛二聚体、反式-2-庚烯醛二聚体、苯甲醛、正己醇二聚体、反式-2-戊烯醛、正丁醇二聚体及编号为1和10的两种未鉴定的VOCs,这些VOCs的VIP值较高,说明这些物质在小米粉的发酵过程中含量变化显著。
3 结论
此研究首次采用GC-IMS技术研究小米粉在发酵过程中的风味变化情况,无需复杂的前处理及萃取过程,充分利用了GC高分离效率和IMS高灵敏度的特点,将数据以可视化的形式呈现在谱图中,不同发酵时间的样品呈现出的差异更加直观显著。以GC-IMS数据库为依据,通过离子迁移谱图和迁移时间及保留时间,建立了定性表格对分离出的VOCs进行定性,得知发酵小米粉样品中共分离出28种挥发性物质,包括醛类、醇类、酮类、酯类和呋喃类。通过对比小米发酵粉样品的三维及二维谱图,可以得知小米粉发酵前后的VOCs差异较大,且大部分集中在保留时间100~300 ms之间。为了更直观地分析小米粉样品中的VOCs,建立了指纹图谱,由指纹图谱可知,样品中含有的VOCs随着发酵时间的改变不断改变,其中壬醛、正庚醛、正己醛、正戊醛、正戊醇、庚醇、正丁醇、丁酸丙酯、乙酸丁酯、乙酸乙酯及甲酸乙酯在0 h时含量最高,发酵过后基本消失,3-羟基-2-丁酮、丙酮酸乙酯及两种未检测出的VOCs含量在发酵过程中不断增大,其他VOCs在发酵过程中的含量变化呈波动趋势。综合指纹谱图结果分析得到在24 h时,小米粉样品的风味物质含量最高且丰富,或拥有花果及奶油等香味,理论上达到对比其他样品的感官最佳值,与上前述结果一致。聚类分析结果显示,发酵48 h和发酵60 h的样品相似度高,且这两个样品与发酵12 h的样品有一定相似度,发酵36 h和发酵72 h的样品相似度高,且发酵24 h的样品和这两个样品有一定的相似度,此发现能以侧面反映发酵过程中某些VOCs含量处于不断变化的状态;所有的样品都与发酵0 h的样品有较大差异,说明植物乳杆菌发酵对小米粉的VOCs成分有巨大影响,与指纹谱图分析结果一致。由PLS-DA分析可得,R2X-R2Y=0.017<0.3说明模型可靠。置换分析结果说明模型未过拟合,通过PLS-DA得分图可知,0 h的小米粉样品与其他样品差异巨大,发酵36 h与发酵72 h的样品相似度较高,24 h与36 h及72 h的样品相似度较高,与聚类分析结果一致。通过VIP得分图筛选出15个差异标记物:己酸乙酯二聚体、乙酸乙酯二聚体、正丙醇、己酸乙酯、3-羟基丁烷-2-酮、2-庚酮、反式-2-庚烯醛、正己醛二聚体、反式-2-庚烯醛二聚体、苯甲醛、正己醇二聚体、反式-2-戊烯醛、正丁醇二聚体及编号为1和10的两种未鉴定的VOCs在小米粉整个发酵过程中的变化最为明显。但由于GC-IMS技术起步较晚,手段较新,IMS数据库不够完善,部分VOCs无法进行定性,无法定性的VOCs之后可以利用其他分析技术进行验证,完善小米发酵领域的VOCs数据库。
本研究通过探究小米粉在发酵过程中风味物质的变化,以期在小米产品加工上提供新的思路,开发出拥有优质风味和良好营养的小米发酵制品,同时证明了GC-IMS检测技术能够高效准确地鉴别出不同发酵时间段的发酵小米粉样品,为鉴别不同工艺条件发酵的小米粉提供新的思路,有望成为新的谷物发酵工艺优化检测的新技术。

