乙肝肝纤维化患者血液miR⁃122、miR⁃181a水平与病情严重程度的关系
崔红梅 卢坤玲 付丽坤 张利利
在我国,乙肝病毒感染是肝病的主要病因,流行病学报道,在全世界范围内,30%的肝硬化及45%的肝癌患者是由慢性乙型肝炎(Chronic hepa⁃titis B,CHB)发展而来[1]。目前认为,肝纤维化的诊断、分期对评估慢性肝病程度及乙肝抗病毒治疗具有重要指导意义,对于延缓肝硬化、肝癌的进展均有积极作用[2]。当前肝脏病理学检查仍是肝纤维化诊断的金标准,但肝脏病理学诊断为创伤性检查,有较大的并发症发生风险[3]。microRNA 是一种广泛存在的非编码小RNA,对蛋白表达具有调节作用,参与细胞生长、分化、代谢等多种生理学功能。miR⁃122 位于18q21.31 位点,是肝脏组织中表达量最丰富的的RNA,研究表明其在肝细胞生长、脂质代谢、病毒感染等多种生物学过程中均发挥调控作用[4]。miR⁃181a 是miR⁃181 家族成员,位于9号染色体正链上,研究表明miR⁃181 可直接靶向肝分化转录调节因子,调节肝细胞的生长及增殖[5]。本研究初步探讨miR⁃122、miR⁃181a 对肝纤维化程度评估的价值,以期为肝纤维化病情的评估及治疗提供一定参考。现报道如下。
1 资料与方法
1.1 一般资料
选取2018年3月至2020年5月本院收治的186 例CHB 患者作为CHB 组。纳入标准:①符合《慢性乙型肝炎防治指南》[6],乙型肝炎表面抗原阳性6 个月及以上;②行肝脏组织病理检查;③对本研究知情并签署知情同意书。排除标准:①其他类型病毒性肝炎者、酒精性肝炎者;②接受抗病毒或抗纤维化治疗者;③存在药物性肝损伤者;④合并恶性肿瘤者。CHB 组患者中男性120 例,女性66 例,平均(44.88±8.52)岁。另选取本院100 例同期健康体检者作为对照组。对照组受试者中男性66 例,女性34 例,平均(45.27±8.96)岁,两组性别组成及年龄比较差异无统计学意义(P>0.05)。本研究经医院医学伦理委员会批准通过。
1.2 方法
血清生化检测:对照组于体检当日、CHB 患者于行肝组织病理学检查当日采集5 mL 空腹静脉血,抗凝后提取血清,采用全自动生化分析仪检测天冬氨酸氨基转移酶(aspartate aminotransferase,AST)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、总胆红素(total bilirubin,TBIL)等肝生化指标。
肝脏组织病理学检查:CHB 组患者行超声引导下肝脏穿刺及组织病理学检查,标本长度>1.0 cm,至少包括6 个汇管区,参考国际Scheuer 系统规定的标准[7]进行肝纤维化分期,其中S0(25 例)、S1(44 例)、S2(35 例)、S3(52 例)、S4(30 例)。
miR⁃122、miR⁃181a 表达水平:采集患者外周空腹静脉血,抗凝处理,采用血液RNA 提取试剂盒提取标本中总RNA,采用反转录试剂盒将总RNA 转换成cDNA,采用实时荧光定量聚合酶链式反应技术检测miR⁃122、miR⁃181a 表达,内参为U6,引物序列如下:miR⁃122(正向引物:5′⁃TGC⁃GCTGGAGTGTGACAATGGT⁃3′,反向引物:通用引物);miR⁃181a(正向引物:5′⁃AACATTCAAC⁃GCTGTCGGTGAGT⁃ 3′,反向引物:通用引物);U6(正向引物:5′⁃GCTTCGGCAGCACATATACTA⁃AAAT⁃3′,反向引物:5′⁃CGCTTCACGAATTTGC⁃GTGTCAT⁃3′)。采用相对定量法计算表达水平,ΔCt=目的扩增Ct 值⁃U6 Ct 值,以2⁃ΔΔCt表示为目的产物的表达水平。
1.3 统计学分析
采用SPSS 19.0 统计软件进行数据处理与统计分析,计数资料以n(%)表示,行χ2检验;计量资料以(±s)表示,组间比较行独立样本t检验、多组间比较采用F 检验;采用Pearson及Spearman相关性分析指标间的相关性;绘制受试者特征工作曲线(ROC)分析指标诊断价值,以P<0.05 表示差异有统计学意义。
2 结果
2.1 两组受试者临床资料及miR⁃122、miR⁃181a表达水平比较
CHB 组ALT、AST、TBIL 等生化指标及miR⁃122、miR⁃181a 表达水平均高于对照组,差异均有统计学意义(P<0.05)。见表1。
表1 两组受试者临床资料及miR⁃122、miR⁃181a 表达水平比较(±s)Table 1 Comparison on clinical data and expression levels of miR⁃122 and miR⁃181a between 2 groups(±s)
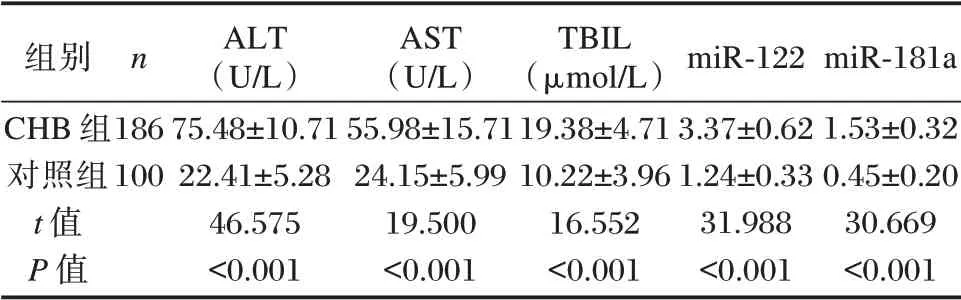
表1 两组受试者临床资料及miR⁃122、miR⁃181a 表达水平比较(±s)Table 1 Comparison on clinical data and expression levels of miR⁃122 and miR⁃181a between 2 groups(±s)
组别CHB 组对照组t 值P 值n 186 100 ALT(U/L)75.48±10.71 22.41±5.28 46.575<0.001 AST(U/L)55.98±15.71 24.15±5.99 19.500<0.001 TBIL(μmol/L)19.38±4.71 10.22±3.96 16.552<0.001 miR⁃122 3.37±0.62 1.24±0.33 31.988<0.001 miR⁃181a 1.53±0.32 0.45±0.20 30.669<0.001
2.2 不同肝纤维化分期患者临床资料及miR⁃122、miR⁃181a 表达水平比较
随着肝纤维化分期的升高,CHB 患者ALT、AST、TBIL 等肝生化指标及miR⁃181a 表达升高,miR⁃122 表达水平降低(P<0.05)。见表2。
表2 不同肝纤维化分期患者临床资料及miR⁃122、miR⁃181a 表达水平比较(±s)Table 2 Comparison on clinical data and expression levels of miR⁃122 and miR⁃181a among patients with different stages of liver fibrosis(±s)
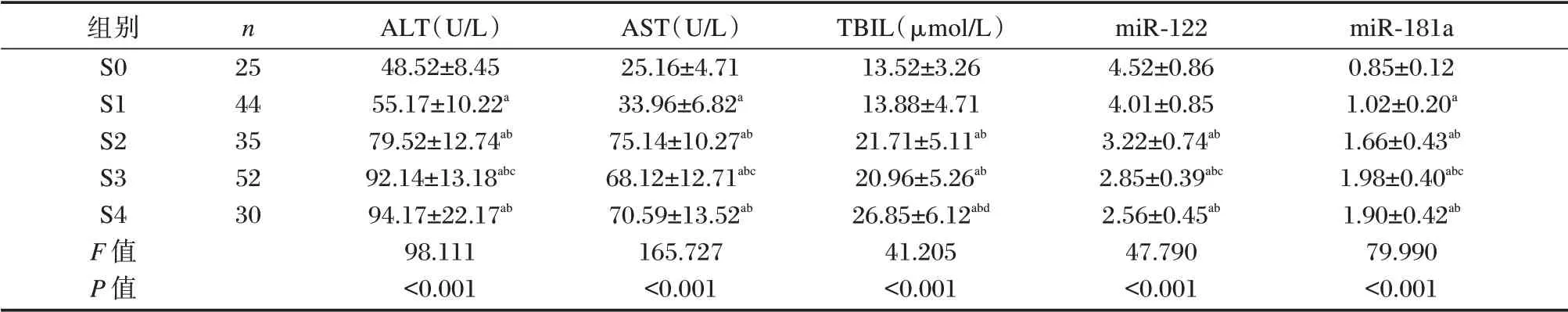
表2 不同肝纤维化分期患者临床资料及miR⁃122、miR⁃181a 表达水平比较(±s)Table 2 Comparison on clinical data and expression levels of miR⁃122 and miR⁃181a among patients with different stages of liver fibrosis(±s)
注:与S0 期比较,aP<0.05;与S1 期比较,bP<0.05;与S2 期比较,cP<0.05;与S3 期比较,dP<0.05。
组别S0 S1 S2 S3 S4 F 值P 值n 25 44 35 52 30 ALT(U/L)48.52±8.45 55.17±10.22a 79.52±12.74ab 92.14±13.18abc 94.17±22.17ab 98.111<0.001 AST(U/L)25.16±4.71 33.96±6.82a 75.14±10.27ab 68.12±12.71abc 70.59±13.52ab 165.727<0.001 TBIL(μmol/L)13.52±3.26 13.88±4.71 21.71±5.11ab 20.96±5.26ab 26.85±6.12abd 41.205<0.001 miR⁃122 4.52±0.86 4.01±0.85 3.22±0.74ab 2.85±0.39abc 2.56±0.45ab 47.790<0.001 miR⁃181a 0.85±0.12 1.02±0.20a 1.66±0.43ab 1.98±0.40abc 1.90±0.42ab 79.990<0.001
2.3 miR⁃122、miR⁃181a 表达水平与临床资料、肝纤维化分期的相关性
Pearson相关性分析示,miR⁃122 与CHB 患者ALT、AST、TBIL、肝纤维化程度等呈负相关(P<0.05),miR⁃181a 与肝生化指标呈正相关(r1=0.501,r2=0.444,r3=0.370,r4=0.396,P均<0.05)。Spearman相关性分析示,miR⁃122与肝纤维化程度呈负相关(P<0.05),miR⁃181a与肝纤维化程度呈正相关(P<0.05)。
2.4 miR⁃122、miR⁃181a 表达水平对肝纤维化程度的评估价值分析
ROC 曲线示,miR⁃122、miR⁃181a 表达水平诊断严重肝纤维化(S3~S4)的曲线下面积分别为0.851、0.783,当截点值为3.26、1.42 时,约登指数最大(0.566、0.516)。见表3、图1。
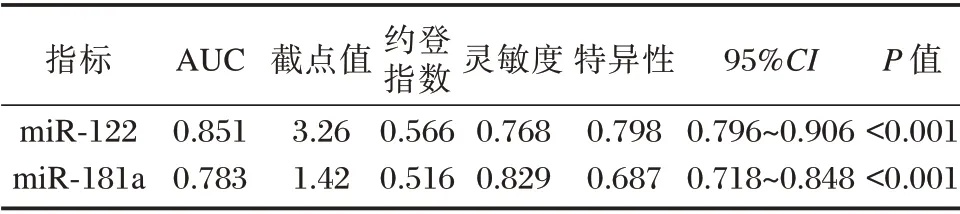
表3 miR⁃122、miR⁃181a 表达水平诊断严重肝纤维化(S3~S4)的价值分析Table 3 Value of miR⁃122 and miR⁃181a in the diagnosis of severe liver fibrosis(S3⁃S4)

图1 miR⁃122、miR⁃181a 表达水平诊断严重肝纤维化(S3~S4)的价值分析Figure 1 Value of miR⁃122 and miR⁃181a in the diagnosis of severe liver fibrosis(S3⁃S4)
3 讨论
miR⁃122 在肝脏组织中高度表达,约占全部miRNA 的70%。miR⁃122 主要由肝脏细胞释放,研究表明,肝细胞过表达miR⁃122 可抑制HBV DNA 的复制,降低病毒对肝细胞的损伤[8]。miR⁃122可抑制肝星状细胞增殖,减少肝脏胶原的产生从而抑制纤维化的产生[9]。本研究结果显示,与健康对照组比较,CHB 组miR⁃122 的表达明显升高,这一结果与Liu 等人[10]研究结果类似。miR⁃181a 是一种广泛存在于细胞中的miRNA,研究表明其在细胞分化、生长及程序性死亡方面发挥重要作用[11]。目前miR⁃181a 与肝纤维化之间的关系尚未完全阐释清楚,推测可能与其介导肝脏炎症从而影响肝纤维化进程有关。既往有研究表明miR⁃181a 与巨噬细胞活化后白细胞介素⁃1β、肿瘤坏死因子⁃α、转化生长因子⁃β1 等炎症因子水平呈相关关系[12];而肝纤维化过程本质上是胞外基质合成及降解失衡的过程,miR⁃181a 可激活炎症因子亢进导致肝脏炎症损伤,同时也可调节肝星状细胞活性,促进基质胶原降解合成的失衡,促进肝纤维化进程。
本研究结果显示,不同肝纤维化水平CHB 患者中,随着肝纤维化程度的升高,miR⁃122 的表达降低,且其水平与肝纤维化程度呈负相关。分析其原因可能为miR⁃122 主要由肝脏细胞释放,肝脏纤维化程度越高,肝细胞损伤范围越大,肝细胞合成miR⁃122 能力降低,其抑制肝纤维化的作用减弱,肝纤维化进展更快,两者形成恶性循环。既往国外开展的一项研究表明,与CHB 患者相比,肝硬化患者miR⁃122 表达量明显降低,其表达水平与肝功能指标呈负相关[13]。国内开展的一项研究表明,随着肝纤维化程度的升高,miR⁃122 表达量降低,其与HBV⁃DNA 载量、ALT、AST 等肝功能指标呈正相关,而与肝纤维化程度呈负相关[14]。本研究与上述研究结果类似。本研究中CHB 患者miR⁃181a 表达升高,且随着肝纤维化程度的升高,其表达呈现升高趋势,推测miR⁃181a 可能与HBV 感染后炎症因子产生的肝脏损伤及肝纤维化进程有关,其高表达或可促使炎症亢进、肝脏损伤及肝纤维化进程。既往陈婧等人[15]开展的一项研究证实CHB 患者miR⁃181a 表达升高,且随着肝硬化分期的加重,整体呈现升高趋势。但徐艺丹等人[16]开展的一项动物研究证实,肝脏纤维化小鼠miR⁃181 表达降低,且随着分期程度升高呈下降趋势。本研究与前者研究结果类似,两者研究存在差异的原因可能为研究对象差异所致。
目前肝硬化前期的肝纤维化评估是逆转肝脏病变的关键,组织病理学检查是金标准,但鉴于其风险,其临床应用有较大的限制。本研究结果显示提示两者对肝硬化严重程度有一定参考价值。
综上,慢性乙肝肝纤维化患者伴有miR⁃122、miR⁃181a 水平的变化,且与肝纤维化程度相关,临床可将其作为评估纤维化程度的参考指标。本研究局限性在于样本量较少,未来仍有待进一步扩大样本进行研究。

