高通量测序法微卫星不稳定性检测评价
贾铮 徐任 张文新 黄杰★ 曲守方★
微卫星(Microsatellite)是指人类基因组中的短串联重复序列,有单核苷酸、双核苷酸或高位核苷酸的重复。微卫星不稳定性是细胞内的微卫星由于重复单位的插入或缺失而导致微卫星长度的改变,包括微卫星高度不稳定(Microsatellite insta⁃bility⁃high,MSI⁃H)、微卫星低度不稳定(Microsat⁃ellite instability ⁃low,MSI⁃L)及微卫星稳定(micro⁃satellite stability,MSS)等状态,是由错配修复(Mismatch repair,MMR)基因MSH2、MSH6、MLH1、PMS1和PMS2发生缺陷引起的,与肿瘤的发生密切相关[1⁃2]。临床上已将MSI 作为结直肠癌及其他实体瘤预后和制定辅助治疗方案的重要分子标志物,并用于林奇综合症(Lynch syndrome)筛查[3⁃4]。美国食品药品监督管理局(FDA)批准PD⁃L1 抑制剂帕博利珠单抗注射液(Keytruda 或Pembrolizum⁃ab),用于治疗微卫星高度不稳定(MSI⁃H)或错配修复基因缺陷(deficient mismatch repair,dMMR)的实体瘤患者[5],这是首款依照分子标记物进行区分的抗肿瘤疗法。
目前临床检测MSI,主要是使用免疫组织化学方法检测肿瘤组织中错配修复基因MLH1、MSH2、MSH6及PMS2的表达[6⁃7],和国际公认的金标准⁃多重荧光PCR 结合毛细管电泳方法检测特异的微卫星重复序列扩增判定MSI 状态[8⁃9]。随着高通量测序技术(High throughput sequencing)发展,该技术已经成为MSI 检测的新发展方向[10⁃12]。国内已经有多家公司开发基于高通量测序平台的MSI 检测试剂盒。本研究使用微卫星不稳定性检测国家参考品作为统一的标准,评价MSI 检测试剂盒(高通量测序法)的性能。
1 材料与方法
1.1 参考品
MSI 检测国家参考品,批号:360028⁃201901,中国食品药品检定研究院提供。
1.2 试剂与仪器
人类多基因突变联合检测试剂盒(可逆末端终止测序法),购自江苏先声医疗器械有限公司。Genom⁃ic DNA Reagents、D1000 Reagents 和D1000 Screen⁃Tape,购自美国Agilent Technologies 公司。NextSeq 500/550 High Output Reagent Cartridge v2(300 cy⁃cles)、NextSeq 500/550 Buffer Cartridge v2、NextSeq Accessory Box v2、NextSeq 500/550 High Output Flow Cell Cartridge v2.5购自美国illumina公司。
ME220 超声打断仪,购自美国Covaris 公司。4 200 TapeStation 片段分析系统,购自美国Agilent Technologies 公司。NextSeq550Dx 基因测序仪,购自美国illumina 公司。
1.3 方法
1.3.1 文库构建
取不少于100 ng 国家参考品DNA,转移到Covaris 超声打断管中,设置超声打断仪各参数后进行DNA 片段化处理。然后将片段化DNA 进行末端修复和接头连接,然后进行PCR 扩增,制备文库。
1.3.2 杂交捕获
采用试剂盒具有特定DNA 序列的捕获探针与文库进行杂交,从而特异性捕获目标区域,通过磁珠法富集被探针捕获的目标区域DNA 片段。将捕获文库进行PCR 扩增。纯化后的文库使用Agilent 4200 TapeStation 进行检测,要求主要片段的峰值为220 bp~350 bp 左右,无明显小片段和大片段杂峰,主要片段的浓度应>3 ng/μL。然后获得合格的文库。
1.3.3 上机测序
将已定量合格的文库加入到试剂盒的标准化文库试剂和磁珠悬浮缓冲液,经过洗脱缓冲液的洗脱,获得标准化文库。标准化文库加入到NextSeq 500/550 High Output Reagent Cartridge v2(300 cy⁃cles)中,配合NextSeq 500/550 Buffer Cartridge v2、NextSeq Accessory Box v2、NextSeq 500/550 High Output Flow Cell Cartridge v2.5,使用NextSeq550Dx基因测序仪进行测序。使用“人类多基因突变联合检测试剂盒分析软件”对下机数据进行分析,获得样本的MSI 结果。
1.4 结果判定
根据阴性样本构建的MSI 基线(Baseline),从下机数据的bam 文件中分析样本的微卫星不稳定状态。对每个样本给出微卫星不稳定的位点数目(如果位点的Distance>0.08 且P<0.01,则该位点是MSI 不稳定位点)和可用的MSI 位点数,计算MSI值,其公式为:MSI 值=MSI 不稳定位点数/可用的MSI 位点数×100%。当样本的MSI 值大于等于15%时结果为MSI⁃H,MSI 值小于15%时结果为MSS。
1.5 统计学分析
使用python 3.7 中math、np 和scipy 包进行数据统计分析,计算待测样本与MSI 基线样本间以及MSI 基线样本间的Jensen⁃Shannon(JS)距离(Dis⁃tance),2 组Distance 数据间比较采用单边t检验进行分析(P),以P<0.01 表示差异有统计学意义。
2 结果
2.1 阳性参考品结果
国家参考品中的16 对阳性参考品共32 例样本检测结果显示均为微卫星高度不稳定,见表1。以国家阳性参考品MSI⁃3 及其配对参考品MSI⁃3⁃对照(MSI⁃3⁃DZ)的chr2:16083525 位点的结果为例,见图1。在MSI⁃3⁃DZ 和基线样本中碱基重复数(Repeat⁃Length)集中分布在15 个串联重复T上,在MSI⁃3 中12 个串联重复T 上也有一个较高的峰值,表明该位点发生了微卫星不稳定,计算该位点的重复单元长度与基线样本的Distance 为0.2083 且P为0.0000(Distance>0.08 且P<0.01),结果为该位点是微卫星不稳定位点。MSI⁃3⁃DZ 的该位点的Distance 为0.0551 且P为0.0004,结果为该位点是微卫星稳定位点。软件分析国家阳性参考品MSI⁃3 的MSI 值为72.38%(76/105),结果为MSI⁃H;MSI⁃3⁃DZ 的MSI 值为1.87%(2/107),结果为MSS。
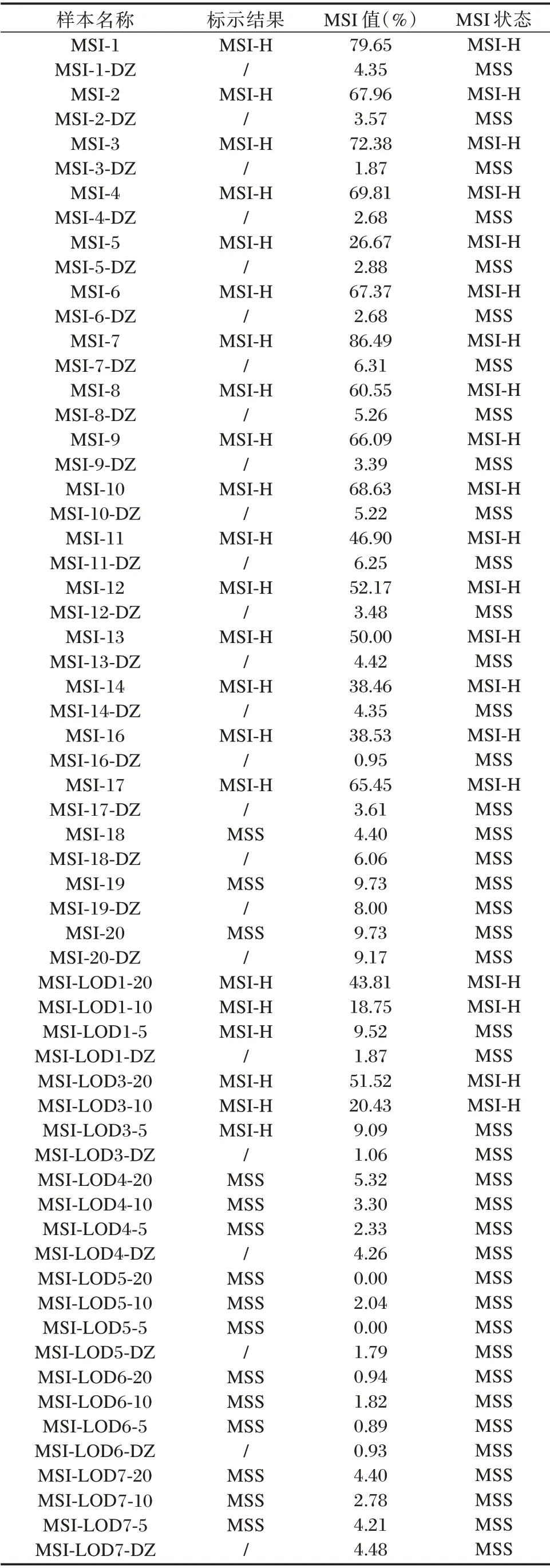
表1 MSI 国家参考品的结果Table 1 The results of national reference MSI

图1 国家阳性参考品MSI⁃3 及其配对参考品MSI⁃3⁃对照的结果(chr2:16083525)Figure 1 The results of national positive reference MSI⁃3 and its matched reference MSI⁃3⁃control(chr2:16083525)
2.2 阴性参考品结果
国家参考品中的3 对阴性参考品共6 例样本检测结果显示均为微卫星稳定,见表1。以国家阴性参考品MSI⁃19 及其配对参考品MSI⁃19⁃对照(MSI⁃19⁃DZ)的chr2:16083525 位点的结果为例,见图2。MSI⁃19 和MSI⁃19⁃DZ 与基线样本的分布情况相近,碱基重复数均集中分布在15 个串联重复T 上,计算该位点的Distance 和P,结果为该位点是微卫星稳定位点。软件分析国家阴性参考品MSI⁃19 的MSI 值为9.73%,MSI⁃19⁃DZ 的MSI 值为8.00%,结果均为MSS。

图2 国家阴性参考品MSI⁃19 及其配对参考品MSI⁃19⁃对照的结果(chr2:16083525)Figure 2 The results of national negative reference MSI⁃19 and its matched reference MSI⁃19⁃control(chr2:16083525)
2.3 检测限参考品结果
国家参考品中的6 组检测限参考品共24 例样本检测结果显示,对20%和10%肿瘤DNA 含量的检测限参考品均能正确检出相应的微卫星不稳定性状态,而对5%肿瘤DNA 含量的微卫星高度不稳定性状态的LOD1 及LOD3 检测限参考品未能正确检出相应的微卫星不稳定性状态,见表1。以国家检测限参考品MSI⁃LOD3⁃20%、MSI⁃LOD3⁃10%、MSI⁃LOD3⁃5%及其配对参考品MSI⁃LOD3⁃对照(MSI⁃LOD3⁃DZ)的chr22:29682881 位点的结果为例,见图3。MSI⁃LOD3⁃5%和MSI⁃LOD3⁃DZ 的MSI 值分别为9.09%和1.06%,结果为MSS。
3 讨论
与传统PCR 方法相比,高通量测序技术具有通量高、灵敏度强和特异性强等特点,可以实现对样本中多个微卫星位点和多个疾病相关基因同时检测,能够辅助肿瘤诊断、预后评估或选择治疗方案。2017年11月16日,美国FDA 批准纪念斯隆·凯特琳癌症研究中心(Memorial Sloan Kettering Cancer Center,简称MSK)基于高通量测序技术的癌症基因检测分析平台MSK⁃IMPACTTM,能够一次对病人肿瘤468个基因的突变进行检测,并且可以检测MSI基因组特征,但仅限于在MSK 中进行使用,其检测结果不与任何药物联用[13]。2017年11月30日,美国FDA 批准了Foundation Medicine 公司针对多种实体瘤的二代测序的体外检测产品—FoundationOne CDx(F1CDx),仅允许在Foundation Medicine 公司进行检测。该产品可以检测5 种肿瘤中的324 个基因的突变,也可以检测MSI和肿瘤突变负荷(TMB)两个基因组特征,是FDA 批准的首款获得突破性认定的癌症高通量测序体外诊断检测产品[14⁃15]。国内已有多个公司在基于高通量测序平台的肿瘤大Panel 检测中加入MSI 检测流程,进行试剂盒的开发和应用。国家药品监督管理局(NMPA)在2021年1月批准常州桐树生物科技有限公司的微卫星不稳定(MSI)检测试剂盒(多重荧光PCR⁃毛细管电泳法),可以体外定性检测结直肠癌患者肿瘤组织FFPE 样本的“2B3D”(BAT⁃25、BAT⁃26、D5S346、D2S123、D17S250)微卫星位点状态,但是尚未批准基于高通量测序法的MSI检测试剂盒。
为了更好评价上市前的微卫星不稳定性检测试剂盒(高通量测序法)的性能,建立标准化的国家参考品是非常有必要的。本院建立的微卫星不稳定性检测国家参考品,是肿瘤组织或者细胞系和相应的配对样本,包括MSI⁃H、MSI⁃L 及MSS 三种状态,其中微卫星高度不稳定的阳性参考品涵盖了不同的微卫星不稳定位点,检测限参考品设置20%、10%、5%三种不同肿瘤DNA 含量[16]。MSI 国家参考品采用国际公认的MSI 金标准方法:多重荧光PCR⁃毛细管电泳法进行标定,给出相应的MSI 状态,要求高通量测序法的结果与金标准方法的结果进行比对,因此也适用于高通量测序法。对国家参考品62 例样本的结果显示,阳性参考品的结果均为微卫星高度不稳定,阴性参考品的结果均为微卫星稳定,20%和10%肿瘤DNA 含量检测限参考品的结果均符合相应的标示结果,而对5%肿瘤DNA含量的微卫星高度不稳定状态的检测限参考品LOD1 及LOD3 未能检出正确结果。在临床应用中MSI 检测限一般规定为20%肿瘤DNA 含量,国家参考品要求试剂盒对20%和10%肿瘤DNA 含量的检测限参考品必须检出相应的微卫星不稳定性状态;对5%肿瘤DNA 含量的检测限参考品不作要求。建立的MSI 国家参考品,能够适用于MSI 检测试剂盒(高通量测序法)的性能评价。

