AFP、AFP⁃L3%、DCP与GP73联合检测辅助诊断肝炎、肝癌临床价值
潘俊均 黄仙圣 岑伟明 黄丽霞 杜华 邓沛汶 隋洪
慢性乙型肝炎(Chronic hepatitis B,CHB)为临床最常见慢性疾病之一,报道显示,被确诊的CHB患者中有10%~20%可进一步发展为肝硬化、甚至原发性肝癌(Primary carcinoma of the liver,PHC)[1⁃2]。PHC 具有恶性程度高、进展速度快、侵袭性强、预后较差的特征,我国PHC 病死率约为50%,早期诊断、治疗一直被认为是改善PHC 患者预后的关键[3]。目前临床公认诊断PHC 的血清学标志物为甲胎蛋白(Alpha feto protein,AFP),但其在CHB 及其他慢性肝脏疾病患者血清中也存在不同程度升高。近年来临床一直致力于PHC 诊断标志物的研究,AFP⁃L3 异质体比率(ratio of AFP⁃L3 isoform,AFP⁃L3%)、异常凝血酶原(Des⁃gamma⁃carboxyprothrombin,DCP)、高尔基体蛋白73(Gol⁃gi protein 73,GP73)等相继被报道,但各指标单独诊断的效能均不尽理想[4⁃5]。本研究尝试探究AFP、AFP⁃L3%、DCP 与GP73 联合检测辅助诊断肝炎、肝癌临床价值。报告如下。
1 资料与方法
1.1 一般资料
选取2020年1月至2020年12月东莞康华医院84 例CHB 患者作为CHB 组,纳入标准:①符合CHB诊断标准[6];②首次确诊;③自主行为能力良好,无沟通交流障碍;④患者知晓本研究,已签署同意书。选取与CHB 组相近年龄段的84 例PHC 患者作为PHC组,纳入标准:①符合PHC[7]诊断标准;②首次确诊;③自主行为能力良好,无沟通交流障碍;④患者知晓本研究,已签署同意书。另选与CHB 组相近年龄段的40 例健康志愿者作为对照组,纳入标准:①均于本院进行全身体检,未发现明显异常;②自主行为能力良好,无沟通交流障碍;③知晓本研究,已签署同意书;排除标准:①有肝脏手术史、其他肝脏疾病患者;②合并其他原发恶性肿瘤者;③严重心脑血管疾病、肺肾功能障碍者;④血液系统疾病患者;⑤肺部感染、泌尿系感染等疾病患者;⑥长期服用免疫抑制剂、激素类药物者;⑦入组前已接受相关治疗的CHB、PHC 患者。3 组性别、年龄、体质量指数(Body mass index,BMI)比较,差异无统计学意义(P>0.05)。见表1。
表1 3 组一般资料比较[(±s),n(%)]Table 1 Comparison of general information in the three groups[(±s),n(%)]
注:“-”表示无相关数据。
项目性别(男/女)年龄(岁)BMI(kg/m2)合并症高血压冠心病高脂血症糖尿病PHC 组(n=84)58/26 57.63±9.81 24.38±2.29 25(29.76)16(19.05)31(36.90)8(9.52)CHB 组(n=84)53/31 55.86±8.45 23.91±2.36 20(23.81)10(11.90)25(29.76)12(14.29)对照组26/14 53.64±8.16 23.63±2.05 χ2/F 值0.678 2.735 1.756 0.759 1.638 0.964 0.908 P 值0.712 0.067 0.175 0.384 0.201 0.326 0.341
1.2 方法
指标检测方法:采集所有研究对象入组当天外周静脉血5 mL,离心处理后取血清,采用磁微粒化学发光免疫分析法测定血清AFP、AFP⁃L3%、DCP 水平,试剂盒购自北京百奥莱博科技有限公司。采用电化学发光法检测GP73 水平,试剂盒购自美国R&D 公司。采用美国应用生物系统公司生产的7300 型实时荧光定量PCR 系统进行基因扩增,测定HBV⁃DNA 载量。入组当天采用法国Echosens 公司生产的肝脏瞬时弹性扫描检测仪测定肝脏硬度值(Liver stiffness measure,LSM)。
治疗方法:CHB 组患者入院后参照《慢性乙型肝炎防治指南(2019年版)》[6]进行治疗,PHC 组患者入院后参照《原发性肝癌诊疗规范(2017年版)》[7]进行治疗,均于治疗3 个月后再次测定血清各指标水平。
1.3 统计学方法
数据处理采用SPSS 22.0 软件;计数资料以n(%)描述,采用χ2检验;计量资料以(±s)描述,多组间比较采用单因素方差分析,进一步两两组间比较采用SNK⁃q检验,两组间比较采用独立样本t检验;相关性分析采用Pearson 相关系数模型,诊断效能分析采用受试者工作特征(ROC)曲线,获取曲线下面积(AUC),不同诊断方案间曲线下面积比较采用DeLong 检验,联合诊断实施Logistic 二元回归拟合,获得返回诊断概率logit(p),将其作为独立检验变量进行ROC 分析;P<0.05 为差异有统计学意义。
2 结果
2.1 3 组血清指标比较
3 组血清AFP、AFP⁃L3%、DCP、GP73 水平比较:PHC 组>CHB 组>对照组,差异有统计学意义(P<0.05)。见表2。
表2 3 组血清指标水平对比[(±s),n(%)]Table 2 Comparison of serum levels in the 3 groups[(±s),n(%)]
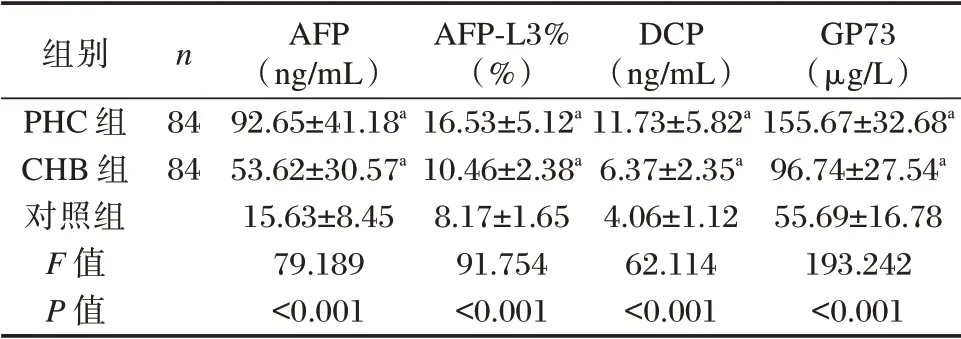
表2 3 组血清指标水平对比[(±s),n(%)]Table 2 Comparison of serum levels in the 3 groups[(±s),n(%)]
注:与对照组对比,aP<0.05。
组别PHC 组CHB 组对照组F 值P 值n 84 84 AFP(ng/mL)92.65±41.18a 53.62±30.57a 15.63±8.45 79.189<0.001 AFP⁃L3%(%)16.53±5.12a 10.46±2.38a 8.17±1.65 91.754<0.001 DCP(ng/mL)11.73±5.82a 6.37±2.35a 4.06±1.12 62.114<0.001 GP73(μg/L)155.67±32.68a 96.74±27.54a 55.69±16.78 193.242<0.001
2.2 CHB 组、PHC 组HBV⁃DNA、LSM 比较
与CHB 组比较,PHC 组HBV⁃DNA、LSM 均较高,差异有统计学意义(P<0.05)。见表3。
表3 CHB 组、PHC 组HBV⁃DNA、LSM 对比(±s)Table 3 Comparison of HBV⁃DNA and LSM between CHB group and PHC group(±s)

表3 CHB 组、PHC 组HBV⁃DNA、LSM 对比(±s)Table 3 Comparison of HBV⁃DNA and LSM between CHB group and PHC group(±s)
组别PHC 组CHB 组t 值P 值n 84 84 HBV⁃DNA(lgIU/mL)5.09±0.73 3.85±0.61 11.946<0.001 LSM(kPa)11.32±1.26 7.64±1.13 19.928<0.001
2.3 血清AFP、AFP⁃L3%、DCP、GP73与HBV⁃DNA、LSM 的关系
CHB、PHC患者血清AFP、AFP⁃L3%、DCP、GP73与HBV⁃DNA、LSM 间呈正相关(P<0.05)。见表4。
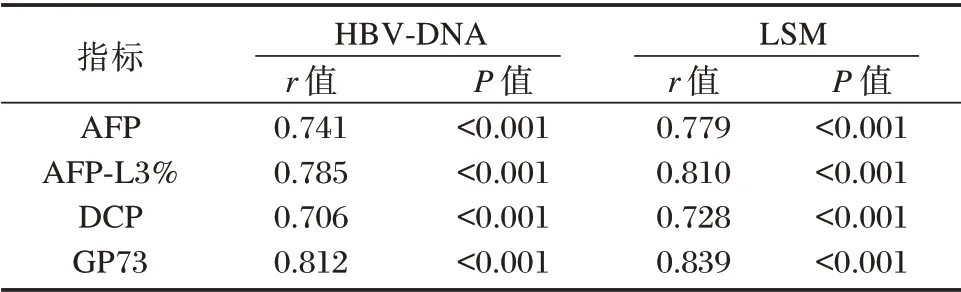
表4 血清AFP、AFP⁃L3%、DCP、GP73 与HBV⁃DNA、LSM的关系Table 4 The relationship between serum AFP,AFP⁃L3%,DCP,GP73 and HBV⁃DNA,LSM
2.4 血清AFP、AFP⁃L3%、DCP、GP73 诊断CHB、PHC 的价值
绘制血清AFP、AFP⁃L3%、DCP、GP73诊断CHB、PHC 的ROC 曲线,结果显示各指标诊断CHB、PHC 的AUC 均>0.7,各指标联合诊断CHB、PHC 的AUC 分别为0.912、0.938(P<0.05)。见表5、图1。
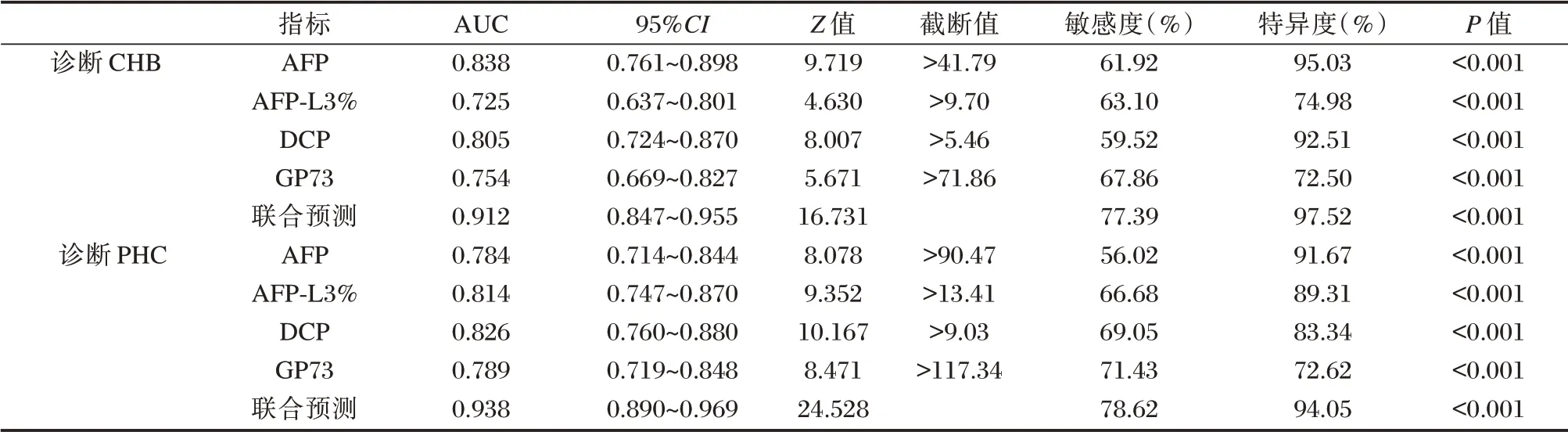
表5 各指标诊断CHB、PHC 的价值分析Table 5 Analysis of the value of each index in the diagnosis of CHB and PHC
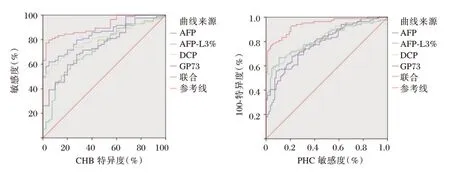
图1 各指标诊断CHB、PHC 的ROCFigure 1 ROC of CHB and PHC diagnosed by various indicators
2.5 CHB 组、PHC 组治疗前后血清AFP、AFP⁃L3%、DCP、GP73 水平变化情况
PHC 组治疗后与治疗前血清AFP、AFP⁃L3%、DCP、GP73 水平差值(绝对值)均大于CHB 组,差异有统计学意义(P<0.05)。见表6。
表6 CHB 组、PHC 组治疗后血清AFP、AFP⁃L3%、DCP、GP73 水平与治疗前差值比较(±s)Table 6 Comparison of serum AFP,AFP⁃L3%,DCP,and GP73 levels after treatment in CHB group and PHC group with the difference before treatment(±s)
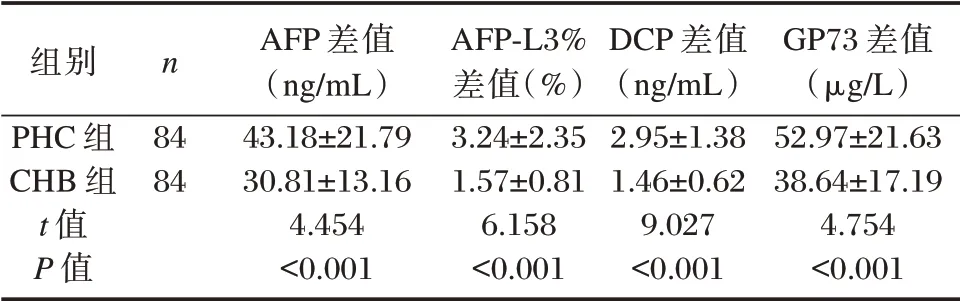
表6 CHB 组、PHC 组治疗后血清AFP、AFP⁃L3%、DCP、GP73 水平与治疗前差值比较(±s)Table 6 Comparison of serum AFP,AFP⁃L3%,DCP,and GP73 levels after treatment in CHB group and PHC group with the difference before treatment(±s)
组别PHC 组CHB 组t 值P 值n 84 84 AFP 差值(ng/mL)43.18±21.79 30.81±13.16 4.454<0.001 AFP⁃L3%差值(%)3.24±2.35 1.57±0.81 6.158<0.001 DCP 差值(ng/mL)2.95±1.38 1.46±0.62 9.027<0.001 GP73 差值(μg/L)52.97±21.63 38.64±17.19 4.754<0.001
3 讨论
特异性血清分子诊断标记物是当前PHC 筛查的重要手段,已广泛应用于临床工作中,且随着临床对PHC发生机制认识的不断深入,越来越多的PHC相关分子被认识并有望成为诊断和预后判断的标志物[8]。
本研究发现,PHC 患者血清AFP 明显高于CHB 患者,且均高于健康人群,与国内相关研究[9⁃10]结果一致,进一步证实AFP 与CHB、PHC 的发生发展密切相关。AFP 为传统血清肿瘤标志物,正常人体内几乎呈无表达状态,而在诊断CHB 等其他良性肝病时表达却呈上升趋势,且在80%左右的肝癌患者血清中明显升高,但其诊断敏感度较低,常与其他方法联合应用[11]。AFP⁃L3%也是近年来发现的肝脏肿瘤相关标志物,既往报道[12]显示,肝细胞肝癌患者血清AFP⁃L3%水平明显高于慢性肝炎患者,其与AFP 联合可提高对肝细胞肝癌的诊断价值。本研究发现,PHC 患者、CHB 患者的血清AFP⁃L3%血清水平均处于明显高表达状态,且前者更高,与上述研究结果一致,进一步证实AFP⁃L3%水平变化参与CHB、PHC的患病机制。此外,本研究还显示PHC 患者血清DCP、GP73水平明显高于CHB 患者,CHB 患者明显高于健康人群。其中DCP 是肝脏产生的无凝血活性的异常凝血酶原,有学者指出,肝癌细胞内相应酶羧化异常,引起维生素K摄取障碍,导致DCP 形成,其水平升高可刺激肝癌细胞浸润、转移等[13]。GP73 为高尔基体Ⅱ型跨膜蛋白,其表达水平受炎症因子调控,在健康人肝细胞中GP73 表达量很少,但当肝细胞受炎症刺激发生损伤时可促进GP73的合成、分泌增加,并进入血液[14]。本研究通过相关性分析,发现CHB、PHC 患者的血清AFP、AFP⁃L3%、DCP、GP73 与HBV⁃DNA、LSM 间均存在明显正相关关系,其中HBV⁃DNA 水平越高,提示肝脏内HBV 活跃性越高,引起的免疫应答反应越剧烈,损伤肝细胞越严重[15];LSM 是反映肝纤维化程度的指标,且值越大表明肝纤维化程度越高,肝细胞损伤越严重[16]。由此可见血清AFP、AFP⁃L3%、DCP、GP73 与肝细胞损伤程度密切相关,进一步证实各指标参与CHB、PHC的患病机制。
基于上述研究,研究尝试采用ROC 曲线发现各指标联合具有较高诊断效能,可为临床诊断CHB、PHC 提供更准确辅助参考,且血清AFP、AFP⁃L3%、DCP、GP73 不仅能应用于CHB、PHC 的诊断,且在评估CHB、PHC 治疗情况方面具有一定潜力,或可能成为评估疗效的指标。
综上可知,血清AFP、AFP⁃L3%、DCP、GP73 可作为辅助诊断CHB、PHC 的标志物,各指标联合在CHB、PHC 的诊断方面具有较高应用价值,且在评估CHB、PHC 治疗情况方面具有一定潜力。但本研究仍存在一定不足,如为探究血清AFP、AFP⁃L3%、DCP、GP73 联合鉴别诊断CHB 和PHC 时的应用效能,未来工作中仍需进一步探讨。

