血清尿酸水平与急性脑出血患者神经功能缺损程度的相关性研究
孙彦杰,刘 娜,李 欣,段瑞生
(1.河北医科大学第二医院,河北 石家庄 050000;2.石家庄医学高等专科学校,河北 石家庄 050000;3.石家庄长城中西医结合医院,河北 石家庄 050000;4.河北省人民医院,河北 石家庄 050000)
近年流行病学调查显示,高尿酸血症的发病率在逐年递增,且呈年轻化趋势[1]。高尿酸血症与脑梗死、脑出血等很多疾病相关。脑出血作为一种发病机制十分复杂、发病急、病情重、致残致死率高的疾病,严重威胁我国人民生命健康安全,因此脑出血的病因防治显得尤为重要[2-3]。目前关于血尿酸(SUA)水平与脑血管病等各个方面的研究越来越多,但结论尚存争议,因此探讨SUA水平与脑出血的关系对指导该病的治疗非常有意义。本课题组分析了SUA水平及血脂等脑血管病危险因素与急性脑出血患者神经功能缺损程度的相关性,旨在评估SUA水平在脑出血发病中的意义,指导脑出血的预防与治疗。
1 资料与方法
1.1纳入标准 脑出血诊断符合《中国脑出血诊治指南(2019)》[4],临床症状和体征与CT或MRI证实的责任病灶相符;入院时发病时间不超过48 h。
1.2排除标准 缺血性脑卒中患者;蛛网膜下腔出血者;脑梗死伴脑出血、外伤性所致脑出血、溶栓后继发的脑出血、静脉窦血栓伴出血、脑血管畸形导致的脑出血、血液病导致的继发性脑出血、颅内占位导致脑出血者;合并急慢性感染及严重基础病者;合并肿瘤、免疫系统及内分泌系统疾病、结核病、结缔组织病、病理性骨折、先天畸形及血液系统患者;哺乳与妊娠期妇女;目前或近期应用降尿酸药物治疗者;近期行高嘌呤饮食者等。
1.3一般资料 本研究符合《赫尔辛基宣言》等伦理学要求,根据纳入及排除标准连续入选河北医科大学第二医院2013年12月—2017年12月收治的急性脑出血患者47例为脑出血组,均于发病48 h内进行GEOptima CT660螺旋CT及Achieva 3.0T核磁检测明确诊断。其中男28例,女19例;年龄25~78(56.7±9.0)岁。选取同期来体检中心进行健康体检的健康者81例为健康组,其中男48例,女33例;年龄23~69(57.6±8.4)岁;目前或近期未服用利尿药、未进食高嘌呤食物且无脑血管病史。2组性别、年龄比较差异无统计学意义(P均>0.05)。
1.4研究方法 入组脑出血患者均采用美国国立卫生研究院卒中量表(NIHSS)评估神经功能缺损程度,将NIHSS评分0~3分者作为轻度组,NIHSS评分4~15分者作为中度组,NIHSS评分15分以上者作为重度组。脑出血组入院当天、健康组于当日体检时测量血压3次,取收缩压(SBP)、舒张压(DBP)的平均值;抽取所有受检者晨起空腹6 h以上静脉血,测定SUA、血糖(FPG)、总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、载脂蛋白A1(Apo A1)、载脂蛋白B(Apo B)、血浆纤维蛋白原(FIB)水平并进行组间比较,同时比较各亚组脑出血患者的SUA水平,分析SUA水平与NIHSS评分的关系,对各检测指标与脑出血的关系进行回归分析。

2 结 果
2.1脑出血组与健康组血压及各检测指标比较脑出血组患者SBP、DBP及FPG、TC、TG、ApoB、SUA水平均明显高于健康组(P均<0.05),Apo A1水平明显低于健康组(P<0.05),LDL-C、HDL-C、FIB水平与健康组比较差异均无统计学意义(P均>0.05)。见表1。
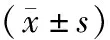
表1 脑出血组与健康组血压及各实验室检测指标比较
2.2脑出血组各亚组间SUA水平比较 轻度组SUA水平为(260.84±32.34)μmol/L,中度组为(331.72±38.59)μmol/L,重度组为(360.10±29.80)μmol/L,重度组最高,不同分度组两两比较差异均有统计学意义(P均<0.05)。
2.3SUA水平与NIHSS评分的关系 Pearson相关分析显示SUA水平与NIHSS评分呈正相关(r=0.556,P<0.05)。见图1。
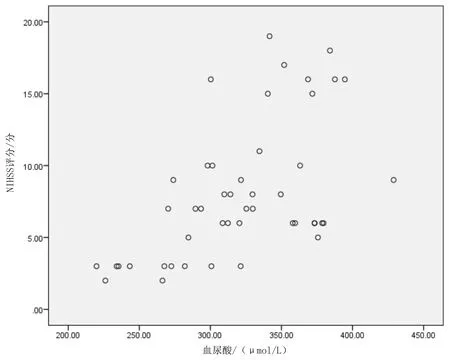
图1 脑出血患者血尿酸水平与NIHSS评分的Pearson相关分析散点图
2.4多因素Logistic回归分析 以有无脑出血为应变量,以SBP、DBP、SUA、FPG、TG、TC、HDL-C、LDL-C、Apo A1、Apo B和FIB为自变量,进行多因素Logistic回归分析,去除其他危险因素后,显示SUA是急性脑出血的独立影响因素[OR=3.106,95% CI(1 408,5.382),P<0.05]。
3 讨 论
目前脑出血发病率约占脑卒中的15%,1个月内病死率约为50%,致残率高达90%左右[5]。有关学者认为脑出血的发生与发展和多种生化标记物有关,其中高尿酸血症已成为脑出血的危险因素之一[6-7]。很多年前国外学者研究发现,SUA是高血压发病的独立危险因素,而高血压同脑出血的发生密切相关[8],所以SUA与脑出血的发生、发展关系密切;另外脑出血时,病灶局部血管挛缩,周围脑组织受到血肿压迫而造成缺血缺氧,为保证脑组织血供,调节血管舒张,机体释放腺苷增加,腺苷代谢成为尿酸,最终可导致机体SUA水平升高[9]。国内部分学者研究证实,脑出血后引起局部脑血管挛缩,并导致脑组织水肿,机体进一步释放大量的腺苷导致血管扩张[10],腺苷与血管内皮细胞接触后经过一系列化学反应最终形成尿酸,尿酸进入血液循环系统后导致SUA水平升高,SUA水平可作为参考性指标来反映脑出血的严重程度[11]。随着研究的深入,发现SUA水平与急性脑出血患者的临床分型、意识状态及预后存在线性关系,病情较严重的脑出血急性期患者SUA水平较高,SUA水平的高低可作为预后不良的评价指标[12-13]。此外,脑出血患者的脑水肿会进一步加剧脑缺血缺氧程度,进一步引发更多的氧自由基产生,而有关研究表明尿酸能清除自身氧自由基和其他活性自由基,同时对神经纤维细胞产生保护作用,机体反应性升高的SUA对抗自由基,高SUA可能预示着预后不佳[14-16]。但也有研究发现急性期、水肿期的脑出血患者SUA水平都比正常人明显降低[17],SUA水平与脑出血患者的预后没有相关性[18]。这些研究结论不一致,所以进一步明确SUA与脑出血的关系有一定的研究意义。
本研究结果显示,脑出血组患者SUA水平显著高于健康组,且依据NIHSS评分所分亚组的SUA水平随NIHSS评分增加而逐渐升高,SUA水平与神经功能损伤程度呈正相关,且SUA是急性脑出血的独立危险因素。本研究进一步证实SUA水平与脑出血密切相关,对于急性脑出血患者应重视SUA 水平的检测及干预,对脑出血患者的治疗、转归及预后具有指导意义。
利益冲突:所有作者均声明不存在利益冲突。

