不同程度肝肾损伤的高尿酸血症大鼠模型研究
朱丽华,蒋翠花,张 健,张现涛,殷志琦
(1.中国药科大学中药学院中药制剂系,南京 211198;2.江苏省中医药研究院转化医学实验室,南京 210028;3.南京海鲸药业有限公司,南京 210031)
高尿酸血症是由于嘌呤代谢紊乱或尿酸排泄不足所导致体内尿酸升高的代谢紊乱疾病,已成为继高血压、高血糖、高血脂之后的第四大健康风险因素,即常说的“第四高”[1]。 随着生活水平的提高和饮食结构的改变、人口老龄化及肥胖的流行,高尿酸血症在世界各地的发病率和患病率均呈逐渐上升趋势[2]。 近年,中国沿海地区和发达城市高尿酸血症发病率已高达25%,且呈年轻化趋势[3-4]。持续高尿酸可引发肾衰或痛风,也会促进肥胖、代谢综合征、脂肪肝和糖尿病等代谢疾病的发生发展[5],危害人类健康。
高效、稳定的高尿酸血症动物模型是防治高尿酸血症药物研究的重要基础。 目前主要是通过增加体内尿酸来源(如腺嘌呤、酵母)、减少肾对尿酸排泄(如乙胺丁醇)、抑制尿酸氧化酶活性(如氧嗪酸钾)、基因改造(如敲除ABCG2)等方式进行药物单独或联合造模来构建高尿酸血症模型[6]。 但这些造模方法评价标准不统一,稳定性差,并伴随不同程度肾损伤[7]。 此外,同一造模方法在不同实验环境、实验条件等因素影响下,效果也会有所不同,因此至今国内外尚无公认、统一的高尿酸血症模型。
因此,本研究将氧嗪酸钾、果糖、次黄嘌呤3 种造模剂单用或联合造模,在不同的造模时间、造模方式下建立大鼠高尿酸血症模型,通过观测大鼠的血尿酸、肌酐、尿素氮水平、AST、ALT 和 XO 活力、肝肾病理切片、肾ABCG2 蛋白表达的变化情况,评价各种造模的优劣势,以期为高尿酸血症模型的合理建立和应用提供实验依据。
1 材料和方法
1.1 实验动物
雄性 SPF 级 Sprague-Dawley 大鼠 85 只,体重220~240 g,购于上海斯莱克实验动物有限责任公司[SCXK(沪)2017-0005]。 大鼠饲养于江苏省中医药研究院SPF 级实验动物中心[SYXK(苏)2016-0018],饲养温度为(24±2)℃,相对湿度(60±10)%,采用12 h:14 h 昼夜间断照明,动物自由进食和饮水。 动物实验方案通过江苏省中医药研究院的实验动物使用与管理委员会审批(AEWC-20180724-40),并按实验动物使用的3R 原则给予人道的关怀。
1.2 主要试剂与仪器
氧嗪酸钾(YQ34L-LA)购于东京化成工业株式会社;果糖(J01J10R89818)购于上海源叶生物科技有限公司;次黄嘌呤(G1725018)购于上海阿拉丁生化科技股份有限公司;尿酸试剂盒(20190812)、肌酐试剂盒(20191104)、尿素氮试剂盒(20191104)、XO 试剂盒(20190902)、ALT 试剂盒(20200928)、AST 试剂盒(20200927)均购于南京建成生物工程研究所;羧甲基纤维素钠(C1814029)购于阿拉丁公司;BCA 蛋白定量检测试剂盒(120219200601)、PMSF(ST506)、RIPA 裂解液(P0013B)、HRP 标记山羊抗兔 IgG(AO208)、ECL 化学发光试剂盒( 071119200611 )、 Buffering 上 样 缓 冲 液(042220200929)均购于上海碧云天生物技术有限公司;兔抗 ABCG2 抗体(L10123192)、兔抗 β-actin抗体(I11181372)均购于沈阳万类生物科技有限公司;苏木素-伊红染液(KGA224)购于江苏凯基生物技术股份有限公司。
MS205DU 电子分析天平(瑞士Mettler Tolerdo公司);Allera64R 低温高速离心机(美国贝克曼库尔特有限公司);SynergyH1 酶联免疫检测仪(美国伯腾仪器有限公司);Axlo VertA1 倒置显微镜(德国Carl Zeiss 公司);164-5052 Western 电泳仪(美国Bio-Rad 公司);Milli-Q 超纯水系统(美国Millipore Corporation 公司);SPE10-0111 apphire 双模式多光谱激光成像系统(美国AZURE 公司);Sceint2-48高通量组织研磨器(宁波新芝生物科技股份有限公司);690BR028786 转膜仪(美国 Bio-Rad 公司)。
1.3 实验方法
1.3.1 试剂的配制
称量羧甲基纤维素钠(CMC-Na)样品5.000 g,加入 1000 mL 蒸馏水,配制 0.5% CMC-Na 溶液。 以CMC-Na 溶液做溶媒,分别配制10 mg/mL、30 mg/mL 的氧嗪酸钾混悬液,10 mg/mL 的次黄嘌呤混悬液。 采用蒸馏水配制5%的果糖无色透明溶液。 将配置好的溶液置于4℃冰箱储存。
1.3.2 动物分组与造模方式
SD 大鼠适应性喂养一周后,大鼠随机分为方法1~方法7 各组,包括正常组和模型组,每组6 只大鼠,为排除其他因素的影响,在同等条件下,正常组给予0.5% CMC-Na 来替代造模剂,各种高尿酸大鼠模型组具体制备方法见表1。 实验期间,实验大鼠自由饮水和摄食。
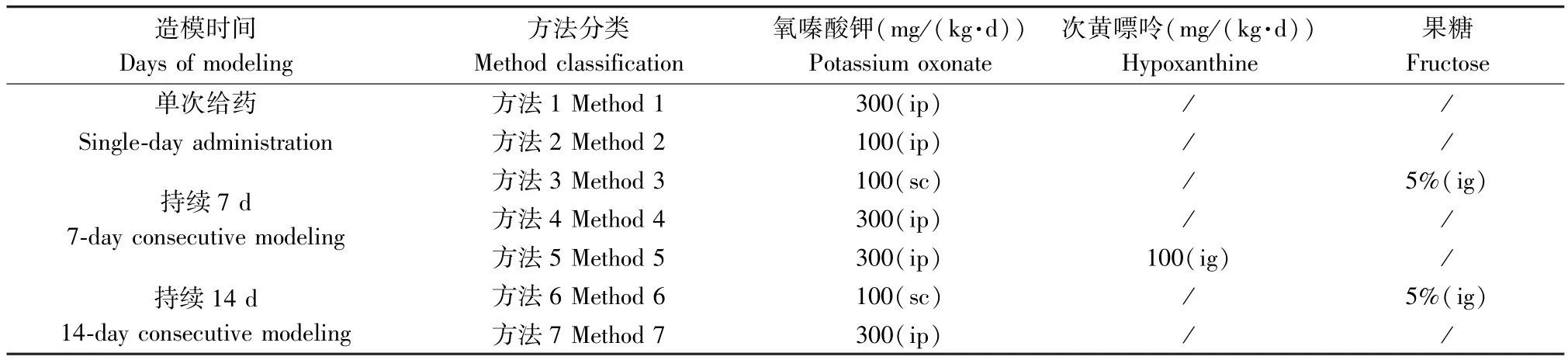
表1 高尿酸血症大鼠模型方法制备Table 1 Preparation of rat model of hyperuricemia
1.3.3 样品的收集和处理
取血前禁食不禁水12 h,氧嗪酸钾末次造模后1 h 时取血。 血样室温下静置 1 h 后,3500 r/min 离心15 min,收集上清液,置于-80℃条件下保存。
1.3.4 生化指标的测定
按试剂盒说明书测定大鼠血清的尿酸、肌酐、尿素氮含量、AST、ALT 和 XO 活性。
1.3.5 肝肾组织病理学观察
实验结束后安乐处死大鼠,快速剥离肝肾组织,生理盐水冲洗干净,置于10%福尔马林液48 h。然后进行脱水、石蜡包埋、切片、HE 染色等操作,光学显微镜下观察并拍照。
1.3.6 蛋白印迹分析
准确称取100 mg 肾皮质组织,加入含蛋白酶抑制剂 PMSF 的 RIPA 裂解液1 mL 进行组织匀浆,4℃,12000 r/min 离心 10 min,收集上清液,采用BCA 蛋白分析试剂盒检测蛋白浓度。 将蛋白质样品和上样缓冲液以4 ∶1的比例混合并煮沸5 min 后,将混合物在10% SDS-PAGE 电泳凝胶中分离,并转移至PVDF 膜,将膜置于5%脱脂牛奶室温下封闭1 h,然后用ABCG2 抗体4℃孵育过夜。 第2 天将膜取出,用TBS-Tween 洗涤3 次,每次5 min,加入二抗室温孵育 1 h,TBS-Tween 洗涤 3 次,每次5 min。 蛋白印迹成像系统对膜成像,Image J 软件进行光密度分析。
1.4 统计学方法
采用GraphPade7 统计学软件进行统计分析,实验数据用平均数±标准差()表示,两组试验组间比较采用T检验法分析,多个试验组间比较采用单因素方差ANOVA 法分析,P<0.05 视为统计学上有差异显著。
2 结果
2.1 血清尿酸、肌酐、尿素氮的变化情况
如表2 所示,单次使用氧嗪酸钾造模,方法1 和方法2 均可使血尿酸含量显著性升高(P<0.01),且方法1 效果更优。 但两个方法中模型大鼠的血肌酐和血尿素氮水平相较于正常组无显著变化(P>0.05)。
表2 各组大鼠血清尿酸、肌酐、尿素氮的变化情况()Table 2 Changes of serum uric acid, creatinine, urea nitrogen in each group of rats

表2 各组大鼠血清尿酸、肌酐、尿素氮的变化情况()Table 2 Changes of serum uric acid, creatinine, urea nitrogen in each group of rats
注:各方法的模型组与正常组比较,#P<0.05,##P<0.01。Note. Comparison of model group with normal group for each method, #P<0.05, ##P<0.01.
方法分类Method classification组别Groups血清尿酸(μmol/L)Serum uric acid肌酐(μmol/L)Creatinine尿素氮(mmol/L)Urea nitrogen方法1 Method 1方法2 Method 2方法3 Method 3方法4 Method 4方法5 Method 5方法6 Method 6方法7 Method 7正常组 Normal group 100.8±30.1 45.4±8.1 4.4±0.2模型组 Model group 201.7±12.1## 46.8±8.0 4.5±0.2正常组 Normal group 85.5±25.5 45.4±11.8 4.6±0.3模型组 Model group 206.0±54.8## 46.8±13.8 4.5±0.4正常组 Normal group 144.5±28.0 12.2±5.6 4.7±1.4模型组 Model group 211.5±23.1## 14.2±8.1 3.7±1.4正常组 Normal group 84.8±11.5 69.2±10.6 4.3±0.2模型组 Model group 268.4±36.6## 65.3±7.8 5.5±0.8#正常组 Normal group 195.8±11.1 130.9±13.9 4.4±0.3模型组 Model group 678.7±30.5## 162.8±27.8# 7.8±1.2##正常组 Normal group 121.2±31.5 14.9±3.1 3.8±0.9模型组 Model group 208.2±64.0## 11.2±1.9 5.4±0.7#正常组 Normal group 191.4±19.3 45.2±8.5 3.7±0.8模型组 Model group 267.5±30.1## 40.9±8.2 5.5±1.5#
连续7 d 用氧嗪酸钾单独造模或联合造模后,与各方法中正常组相比,方法3 中模型组大鼠的血清尿酸显著升高(P<0.05),而肌酐和尿素氮无显著性差异(P>0.05)。 方法4 中模型组大鼠血清尿酸(P<0.01)和尿素氮含量显著增高(P<0.05),而肌酐无显著性差异(P>0.05)。 方法5 模型组大鼠血清尿酸(P<0.01)、肌酐和尿素氮水平均显著性上升(P<0.05)。
连续14 d 用氧嗪酸钾单独造模或联合造模后,与各方法中正常组相比,方法6 模型组大鼠的血清尿酸和尿素氮水平显著性升高(P<0.05),而肌酐无显著性差异(P>0.05)。 方法7 模型组大鼠的血清尿酸(P<0.01)和尿素氮水平显著性上升(P<0.05),而肌酐无显著性差异(P>0.05)。
2.2 血清谷草转氨酶(AST)、谷丙转氨酶(ALT)、黄嘌呤氧化酶(XO)活性的变化情况
AST 和ALT 是临床上常用于反应肝损伤情况的指标。 如表3 所示,单次使用氧嗪酸钾造模,方法1 和方法2 模型组大鼠的血清 AST 和ALT 活性相较于正常组无显著性变化(P>0.05)。 连续7 d 用氧嗪酸钾单独造模或联合造模后,与各方法中正常组相比,方法3 模型组大鼠的血清AST 和ALT 活性均无显著性差异(P>0.05),方法4 模型组大鼠血清AST 活性显著性上升(P<0.05),ALT 活性无明显变化(P>0.05);方法5 模型组大鼠 AST 和 ALT 活性均显著性增高(P<0.05)。 连续14 d 用氧嗪酸钾单独造模或联合造模后,与各方法中正常组相比,方法6 模型组大鼠的血清AST 和ALT 活性无显著性变化(P>0.05),方法7 模型组大鼠的血清AST 活性显著升高(P< 0.05), ALT 活性无明显变化(P>0.05)。
表3 各组大鼠血清AST、ALT 活性的变化情况()Table 3 Changes of serum AST, ALT activity in each group of rats
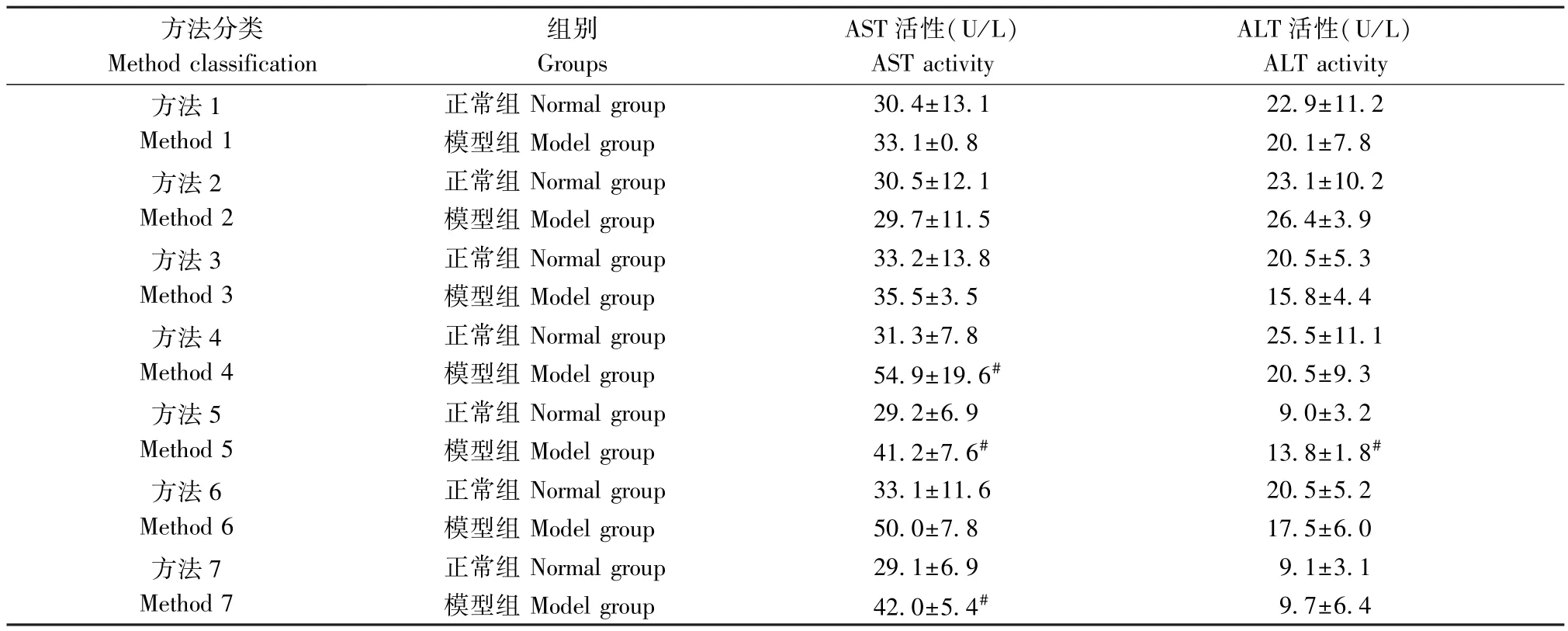
表3 各组大鼠血清AST、ALT 活性的变化情况()Table 3 Changes of serum AST, ALT activity in each group of rats
注:各方法的模型组与正常组比较,#P<0.05。Note. Comparison of model group with normal group for each method, #P<0.05.
方法分类Method classification组别Groups AST 活性(U/L)AST activity ALT 活性(U/L)ALT activity方法1 Method 1方法2 Method 2方法3 Method 3方法4 Method 4方法5 Method 5方法6 Method 6方法7 Method 7正常组 Normal group 30.4±13.1 22.9±11.2模型组 Model group 33.1±0.8 20.1±7.8正常组 Normal group 30.5±12.1 23.1±10.2模型组 Model group 29.7±11.5 26.4±3.9正常组 Normal group 33.2±13.8 20.5±5.3模型组 Model group 35.5±3.5 15.8±4.4正常组 Normal group 31.3±7.8 25.5±11.1模型组 Model group 54.9±19.6# 20.5±9.3正常组 Normal group 29.2±6.9 9.0±3.2模型组 Model group 41.2±7.6# 13.8±1.8#正常组 Normal group 33.1±11.6 20.5±5.2模型组 Model group 50.0±7.8 17.5±6.0正常组 Normal group 29.1±6.9 9.1±3.1模型组 Model group 42.0±5.4# 9.7±6.4
XO 是生成尿酸的关键酶,XO 活性增加可造成体内尿酸生成过多。 如表4 所示,在连续7 d 用氧嗪酸钾单独造模或联合造模后,与各方法中的正常组相比,方法3 模型组大鼠的血清XO 活力无显著性差异(P>0.05),方法4 和方法5 模型组大鼠的血清XO 活力均显著性增高(P<0.01)。 在连续14 d用氧嗪酸钾单独造模或联合造模后,与各方法中正常组相比,方法6 模型组大鼠的血清XO 活力显著性升高(P<0.05),方法7 模型组大鼠的血清XO 活力无明显变化(P>0.05)。
表4 各组大鼠的XO 活力变化情况(U/L,)Table 4 Changes of XO activity of rats in each group

表4 各组大鼠的XO 活力变化情况(U/L,)Table 4 Changes of XO activity of rats in each group
注:各方法的模型组与正常组比较,##P<0.01。Note. Comparison of model group with normal group for each method,##P<0.01.
方法分类Method classification正常组Normal group模型组Model group方法 3 Method 3 34.16±23.14 35.00±8.69方法 4 Method 4 15.27±1.21 19.54±2.50##方法 5 Method 5 16.55±1.95 25.02±2.87##方法 6 Method 6 16.18±2.13 39.34±3.9##方法 7 Method 7 15.44±1.61 15.33±2.44
2.3 肝肾组织的病理切片
如图1A~1G 所示,7 种造模方法中正常组大鼠肝小叶结构均清晰、完整,肝细胞大小形态均正常,界限清晰,肝索以中央静脉为中心呈放射状规则排列,结构正常。 如图 1H~1J、1N 所示,造模方法1、2、3、6 的模型组大鼠肝病理切片均未见明显病变,肝小叶完整,中央静脉清晰可见,肝细胞界限分明,大小正常,肝索排列规则。 如图1K 所示,方法4 模型组大鼠肝板结构被破坏,炎性细胞浸润,肝细胞出现轻微水变性。 如图1L 所示,方法5模型组大鼠肝小叶被破坏,肝细胞水肿,肝细胞核大小不一。 如图1M 所示,方法7 模型组大鼠肝小叶结构不完整,肝细胞出现水变性,脂肪病变,肝索排列不规则。

图1 各组大鼠肝组织病理染色示意图(HE 染色)Note. A, Method 1 normal group. B, Method 2 normal group. C, Method 3 normal group. D, Method 4 normal group. E, Method 5 normal group. F,Method 6 normal group. G, Method 7 normal group. H, Method 1 model group. I, Method 2 model group. J, Method 3 model group. K, Method 4 model group. L, Method 5 model group. N, Method 6 model group. M, Method 7 model group.Figure 1 Schematic diagram of pathological staining of rat liver tissue in each group(HE staining)
如图2A~2G 所示,7 种造模方法中正常组大鼠肾小球大小、形态均正常,边界清晰,鲍曼氏囊腔明显,肾小管结构正常清晰,上皮细胞排列整齐。 如图 2H~2J 示,方法 1、2、3 模型组大鼠肾病理切片未发现明显病变,肾小球和肾小管结构、大小均正常,肾间质无炎性浸润。 如图2K 所示,方法4 模型组大鼠肾小球萎缩,微量炎性细胞外漏,肾小管管腔扩张。 如图2L 所示,方法5 模型组大鼠肾小管和上皮细胞病变严重,肾小管细胞空泡变性和上皮细胞肿胀,部分上皮细胞脱落,出现肾小管管型,肾间质有炎性细胞的浸润且伴有水肿。 如图2N 所示,方法6 模型组大鼠肾小管和上皮细胞结构被破坏,部分肾小管上皮细胞脱落,胞浆淡然。 如图2M 所示,方法7 模型组大鼠肾小球出现严重萎缩现象,大小和形态均被破坏,上皮细胞排列不整齐,部分上皮细胞脱落。

图2 各组大鼠肾组织病理染色示意图(HE 染色)Note. A, Method 1 normal group. B, Method 2 normal group. C, Method 3 normal group. D, Method 4 normal group. E, Method 5 normal group. F,Method 6 normal group. G, Method 7 normal group. H, Method 1 model group. I, Method 2 model group. J, Method 3 model group. K, Method 4 model group. L, Method 5 model group. N, Method 6 model group. M, Method 7 model group.Figure 2 Schematic diagram of pathological staining of rat kidney tissue in each group(HE staining)
2.4 肾ABCG2 蛋白的表达
ABCG2 编码分泌性尿酸转运蛋白,其主要在肠道和肾近端小管刷状缘中调节尿酸排泄,若ABCG2缺乏,尿酸排泄减少[8]。 本研究采用蛋白质印迹分析单用氧嗪酸钾造模、氧嗪酸钾联合果糖造模、氧嗪酸钾联合次黄嘌呤造模这三种造模方法对于肾尿酸转运体ABCG2 蛋白表达的影响。 实验结果如图3A~3B 所示,与各方法中正常组相比,方法3 模型组大鼠 ABCG2 蛋白表达无显著性差异(P>0.05),方法4 和方法5 模型组大鼠肾ABCG2 蛋白表达显著性下降(P<0.05)。

图3 肾ABCG2 蛋白的表达情况Note. A, Data were analyzed using Western blot. B, Ratio of ABCG2/β-action. 3-N, 4-N, 5-N are the normal groups of methods 3, 4, 5 respectively. 3-M, 4-M, 5-M are the model groups of methods 3, 4,5 respectively. Comparison of model group with normal group for each method, *P<0.05, **P<0.01.Figure 3 Expression of kidney ABCG2 protein
3 讨论
尿酸是人类体内嘌呤物质经过一系列酶反应的最终产物,其中,XO 是尿酸生成的关键酶,可催化黄嘌呤氧化成尿酸[9]。 人体内尿酸大部分由肾排泄出体外,小部分由肠道负责排泄出体外。 嘌呤摄入过多或嘌呤代谢酶功能异常所造成的尿酸分泌过多和肾尿酸排泄不足是高尿酸血症的主要病因[10]。
根据高尿酸血症的发病机制,现有的实验研究中多采用增加尿酸前体物质(如酵母、腺嘌呤)、减少尿酸排泄(如氧嗪酸钾、乙胺丁醇))、基因改造(敲除GLUT9)等方法进行单一或联合建造高尿酸血症模型。 Chen 等[11]采用10%酵母提取物糊剂按照7.5 g/(kg·d)饲养大鼠5 周成功建立的高尿酸血症大鼠模型,但酵母粉灌胃体积大,易造成实验动物损害或死亡。 沈桂芹等[12]用300 mg/kg 氧嗪酸钾与250 mg/kg 乙胺丁醇联合造模,大鼠血尿酸出现先升高后降低的现象。 Diwan 等[13]发现喂4周含0.75%腺嘌呤饲料大鼠的血清尿素氮和肌酐、蛋白尿水平升高,出现肾纤维化、高脂血症和血管钙化等特征,这是因为腺嘌呤会形成极难溶于水的2,8-二羟基腺嘌呤,沉积于肾小管及其肾间质,引起以肾间质小管损伤为主的肾衰竭[14],这种造模方式不符合临床上高尿酸血症的发病机制。 Lu 等[15]在纯C57BL/6J 小鼠上通过敲除尿酸酶基因,小鼠尿酸水平超过420 mmol/L,但小鼠肾损伤严重且存活率低。 因此,本研究综合前人研究,结合高尿酸临床发病机制和大鼠尿酸代谢特点,采用了尿酸前体物质和尿酸排泄抑制剂进行造模,希望更好地建立高尿酸血症模型。
本研究选择氧嗪酸钾、果糖、次黄嘌呤三种造模剂单用或联用建造高尿酸血症模型,其主要原理如下所述。 人类在进化中编码尿酸酶的基因沉默失活,但啮齿类动物编码尿酸氧化酶的基因并未沉默,尿酸氧化酶可将尿酸分解为尿囊素从而排除体外[16],故啮齿类动物体内不易造成高尿酸血症。 为了减少大鼠与人类体内对于尿酸代谢的差距,需抑制大鼠体内的尿酸氧化酶活性。 氧嗪酸钾为三氮杂苯类化合物,其结构与尿酸的嘌呤环类似,可竞争性地与尿酸酶结合,抑制尿酸分解为尿囊素排出体外,从而易造成大鼠体内尿酸升高[17]。 因此,本研究主要选择氧嗪酸钾单用或与其他药物联用构建高尿酸血症模型。 本研究单用氧嗪酸钾单次造模、连续7 d 造模和连续14 d 造模均发现模型组相对于正常组血尿酸显著性升高。 单用氧嗪酸钾连续造模14 d 相较于连续造模7 d 模型组尿酸值上升不多,这可能是当尿酸浓度升高,对尿酸氧化酶具有反馈性调节,尿酸氧化酶的表达或活性增加,导致尿酸浓度有所降低。 本研究同时还采用了果糖进行造模,是由于果糖在果糖激酶的催化下磷酸化为果糖1-磷酸,降低胞内磷酸盐和ATP 的水平。细胞内磷酸盐快速减少会刺激AMP 降解为次黄嘌呤,次黄嘌呤在XO 的作用下最终产生尿酸[18],使体内尿酸升高。 本研究大鼠用果糖联合氧嗪酸钾连续造模7 d 和14 d 均能使尿酸显著性上升,相较于单用氧嗪酸钾造模,该造模方式尿酸值稳定。 与正常组相比,果糖联合氧嗪酸钾连续造模7 d 模型组XO 活性无显著性差异,连续造模14 d 模型组XO 活性具有显著性差异,这可能说明果糖联合氧嗪酸钾造模适合建立长期、稳定的高尿酸血症模型。 本研究采用次黄嘌呤,是因为次黄嘌呤为尿酸的前体物质,其在一系列酶的作用下最终可转换成尿酸,从而使体内尿酸升高[19]。 本研究大鼠用次黄嘌呤联合氧嗪酸钾造模尿酸值是单用氧嗪酸钾造模的3 倍,这说明次黄嘌呤能使尿酸含量非常显著上升。
肾是尿酸主要的排泄器官,高尿酸血症往往会导致尿酸及其结晶沉积在肾中,从而造成不同程度的肾功能损伤。 研究表明,可溶性尿酸具有氧化和促炎作用[20],可诱导肾足细胞损伤[21]。 尿酸水平的升高会导致肾内皮功能紊乱,从而增加慢性肾病的风险[22]。 尿酸溶解度下降和过饱和会造成尿酸钠晶体的形成,尿酸钠晶体在肾中的直接沉积会引起肾小管间质的损伤,从而可引起慢性尿酸性肾病、急性尿酸性肾病和尿酸性肾石症[23]。 本研究单用氧嗪酸钾造模发现,模型组大鼠尿素氮水平显著升高,肌酐无显著性差异,出现轻微肾损伤,与Chen等[24]研究结果一致,说明单用氧嗪酸钾造模只适合建立急性高尿酸血症伴随轻微肾损伤模型。 本研究氧嗪酸钾联合次黄嘌呤造模,肌酐和尿素氮显著上升,肾损伤严重,这可能是由于次黄嘌呤自身能增强大鼠肾皮质和髓质的过氧化氢酶、超氧化物歧化酶的活性所导致的[25],说明氧嗪酸钾联合次黄嘌呤适合建立急性高尿酸血症伴随严重肾损伤模型。本研究氧嗪酸钾联合果糖连续造模7 d 时未出现肾损伤,连续造模14 d 出现轻微肾损伤,说明氧嗪酸钾联合果糖适合建立慢性高尿酸血症逐渐伴随肾损伤的模型。
研究表明,高尿酸血症与脂肪肝的患病率成独立正相关关系[26]。 高尿酸可以直接刺激肝细胞的脂肪合成,导致肝细胞脂质代谢紊乱、氧化应激损伤和胰岛素敏感性下降相关[27]。 本研究单用氧嗪酸钾造模7 d 或14 d 的模型组大鼠血清AST 活性显著上升,但ALT 活性无显著变化,肝病理切片中肝细胞出现了轻微的脂肪变性,说明单用氧嗪酸钾连续造模7 d 或14 d 会造成轻微肝损伤。 氧嗪酸钾联合次黄嘌呤造模的大鼠血清AST 和ALT 活性均显著升高,且肝病理切片中肝细胞出现了轻微的脂肪变性,说明氧嗪酸钾联合次黄嘌呤造模会造成较严重肝损伤,这可能是由于体内尿酸的升高从而引起肝脂肪合成增加所导致的。 有研究报道,果糖可诱导肝脂肪堆积[28],但本研究果糖联合氧嗪酸钾造模的大鼠血清AST 和ALT 活性均无变化,且肝病理切片并未发现明显肝病变,可能是由于造模时间短尚未引起上述病变,这与李琴等[29]用5%果糖联合氧嗪酸钾造模两周,但未发现肝有损伤的结果一致,这说明果糖联合氧嗪酸钾造模短期内不会造成肝损伤。
综上所述,本实验成功构建了几种不同程度肝肾损伤的高尿酸血症大鼠模型。 分析模型结果可知,单用氧嗪酸钾连续造模7 d 适合短期内建立急性高尿酸血症伴随轻微肝肾损伤模型。 用5%果糖联合氧嗪酸钾造模更贴近人类因为高糖饮食可诱导的高尿酸血症,该造模方式适合建立肝肾损伤小的慢性高尿酸血症动物模型。 次黄嘌呤联合氧嗪酸钾适合建立肝肾损伤严重的高尿酸血症模型。但这些模型的具体机制和应用还需进一步探索,以便为高尿酸血症模型建立提供更全面科学的依据。

