HIV 广谱中和抗体研究进展
李 哲,王 卫
(北京协和医学院比较医学中心,中国医学科学院医学实验动物研究所,新发再发传染病动物模型研究北京市重点实验室,卫健委人类疾病比较医学重点实验室,北京 100021)
人类免疫缺陷病毒(human immunodeficiency virus, HIV)感染导致细胞免疫功能缺陷,继发严重感染或肿瘤并致命,被称之为艾滋病(acquired imunodeficiency syndrome, AIDS)。 根据 2020 年联合国艾滋病规划署公布数据,截止2019 年底,全球HIV 感染者 3800 万人,新感染 HIV 170 万人,因AIDS 死亡69 万人[1]。 在过去一段时间,科研人员从HIV“精英控制者”体内分离出能中和多种遗传差异 HIV 病毒株的广谱中和抗体( broadly neutralizing antibodies, bNAbs)。 基于动物实验和临床研究数据,bNAbs 不仅可阻断HIV 病毒复制,还有助于清除感染细胞及增强机体免疫反应,成为HIV 疫苗研究一个关键而重要的方向。
1 bNAbs 的分离及鉴定
1.1 bNAbs 的分离
根据中和活性和分离时间,可将bNAbs 大致分为两代。 第一代bNAbs 在20 世纪90 年代分离,具有有限的中和能力;自2009 年以来,科研人员分离出中和活性更高的广谱中和抗体,被称为第二代广谱中和抗体。
1.1.1 第一代广谱中和抗体
1994 年,Burton 等[2]使用噬菌体展示技术,从HIV-1 B 亚型患者体内分离识别gp120 CD4bs 的广谱中和抗体 b12。 1994 年,Buchacher 等[3]将 HIV感染者PBMC 与杂交瘤细胞CB-F7 电融合后获得识 别 gp120 聚 糖 (2G12)、 gp41 MPER (2F5、4E10)[4-5]的 bNAbs。 尽管第一代 bNAbs 在动物模型上取得不错的结果,但临床试验显示这些bNAbs并不能有效抑制人体内的HIV-1 病毒[6]。
1.1.2 第二代广谱中和抗体
利用特异性单个B 细胞分选技术、B 细胞受体测序技术、及高通量中和抗体检测等新技术,新一代高效广谱bNAbs 陆续被分离,且有更显著的中和宽度[7]。 科研人员利用B 细胞分选、高通量筛选以及微量中和实验从A 亚型HIV 病毒感染者PBMC中获得针对V1/V2 区且中和广度不同的两个抗体PG9 和 PG16[8]。 其 他 bNAbs 如 CH01-CH04[9]、PGT141-PGT145[10]、CAP256-VRC26.01-12[11]也用类似的方法获得。 后来Sok 等[12]使用重组HIV包膜三聚体BG505 SOSIP.664 gp140 作为钓饵蛋白分离慢性感染者PBMC,发现新的广谱中和抗体PGDM1400-1412。
1.2 bNAbs 的中和作用
bNAbs 直接与Env 三聚体结合,阻断Env-CD4受体结合或病毒与宿主细胞融合。 根据抗原-抗体复合物的序列定位和结构分析,已确定bNAbs 7 个中和位点:(1)针对包膜蛋白Env 三聚体的第一及第二可变区(V1/V2 variable domain)(如抗体PG9,PGT145);(2)针对第三可变区(V3 variable domain)(如抗体PGT121,10-1074);(3)针对CD4bs(如抗体VRC01,N6,3BNC117);(4)针对 gp120/gp41 的交界区域(如抗体35O22,8ANC195);(5)针对融合肽(如抗体VRC34.01,ACS202);(6)针对 gp120 的“沉默”面(如抗体VRC-PG05,SF12);(7)针对gp41上近膜侧外部区(MPER)(如抗体10E8)。
1.2.1 针对V1/V2 的bNAbs
Env 蛋白V1/V2 区被聚糖和可变环所掩盖[13],结构分析显示针对 V1/V2 区的特异性抗体,如PG9、PG16、CH01-04、PGT141-145,PGDM1400-1412,和 CAP256 - VRC26.01 - 33, 利用 CDRH3(complementarity-determining region 3 loops of heavy chain, CDRH3)穿透聚糖屏障,与 V1/V2、N156/N160 聚糖形成的四元表位相互作用[8-12]。 对类似于PGT141-145 的重轻链序列进行富集,克隆获得13 个 PGT145 抗体变异体,命名为 PGDM1400-1412,其中 PGDM1400 中和宽度为 83%,IC50为0.003 μg/mL[12]。
1.2.2 针对V3 的bNAbs
针对 V3 区的 bNAbs,如 PGT121、PGT128 抗体,通过不同角度突出环与V3 区聚糖作用[10,14]。 10-1074 对B 亚型病毒的中和宽度为67%,IC50为0.1 μg/mL[14]。
1.2.3 针对CD4bs 的bNAbs
细胞表面CD4 受体是Env gp120 的主要结合靶点,gp120 上与CD4 结合的区域被称为CD4 结合部位(CD4-binding site, CD4bs)。 在 HIV-1 感染中,CD4bs 在序列和结构上表现出良好的异质性,已诱导出数量最多的 bNAbs[15]。 CD4bs 抗体包括VRC01、VRC07、N6、3BNC117、N49P 可中和 90%以上的HIV-1 毒株[16-19]。 但很多毒株已对这类抗体产生抗性,必须克服这种耐药性才能获得最佳的临床效果[20]。
1.2.4 针对MPER 的bNAbs
2012 年,Huang 等[21]分离出 MPER 特异性抗体10E8,识别 MPER 区 C 端螺旋结构,中和宽度为98%,IC50值为 0.352 mg/mL。 有研 究证明 针对MPER 的免疫原刺激幼稚B 细胞可产生4E10、10E8样抗体[22]。 因此,该抗体及相关的疫苗接种策略一直是研究热点。
1.2.5 针对gp120/gp41 交界区的bNAbs
针对 gp120/gp41 交界区的 35O22 是 Huang等[23]人于2014 年分离得到,中和宽度为62%,IC50值为0.033 mg/mL,是迄今为止针对gp120/gp41 交界区最有效力的bNAbs。
1.2.6 针对融合肽的bNAbs
gp41 亚基 N 端有15~20 个疏水残基,称为融合肽,是bNAbs 特异性识别的表位,融合肽序列具有高度保守性和特异性[24]。 VRC34.01、PGT151、ACS202 可以从不同的角度结合融合肽,并在融合肽多种构象中发挥作用。 ACS202 的CDRH3 与融合肽形成的“β 链”相互作用,并识别gp120 N88 位保守的N-连接聚糖,中和宽度为45%[25]。
1.2.7 针对gp120 的“沉默”面的bNAbs
“沉默面”不受聚糖改变的影响,可保持对抗体识别和中和的敏感性。 VRC-PG05 是迄今为止唯一从患者体内分离的与gp120 结合的抗体,中和宽度27%,IC50值为 0.8 μg/mL。 此外由 VRC-PG05 与gp120 复合物结合片段的共晶体结构可看出,沉默面中心表位主要由N262、N295 和N448 位聚糖组成[26]。
1.3 bNAbs 的分子特点
bNAbs 具有许多共同的分子特征,首先,bNAbs要获得中和广度,需要发生多次体细胞高频突变(somatic hypermutation, SHM);其次,bNAbs 通常有较长的CDR3Hs[10,27],拥有更长的CDR3Hs 通常被认为与穿透Env 蛋白糖链屏障的能力有关[28-29];最后,HIV bNAbs 通常具有多反应性/自身反应性,多反应性抗体一个结合位点能够与HIV-gp140 高亲和力结合,此外还存在其他结合位点与病毒表面其他配体低亲和力结合。 能够结合不同种类的抗原,即为多反应性。 多反应性抗体通过异源配体结合或杂合作用增加其对病毒的整体表观亲和力[30]。
但bNAbs 也有各自的特点。 针对V1/V2 区的bNAbs 有24~32 个氨基酸组成的CDR3Hs[31],这与穿透V1/V2 区糖基屏障有关[32]。 这类抗体 VH突变频率为 11% ~ 18%,VK/VL突变频率为 9% ~16%[9]。 针对 V3 区的 bNAbs 有 18~24 个氨基酸组成的中等长度CDRH3,VH突变频率为15%~23%,VK/VL突变频率为9%~24%,突变通常涉及碱基的插入或删除[10]。 CD4bs 抗体表现出高亲和力成熟,VH和VK基因突变频率分别为32%和20%[33]。 针对MPER 区的bNAbs 有17~22 个氨基酸组成的中等长度CDRH3s,具有中高度的亲和力,VH突变频率为13%~21%,VK/VL突变频率为6%~14%[33]。针对gp120/gp41 交界区的抗体种系基因为IGHV-1-18*02-和IGLV-2-14*02,VH、VL突变频率分别为35%、24%,35O22 具有 14 个氨基酸长度的CDRH3[23],这类抗体的诱导需用与Env 结构相似的免疫原。 针对融合肽的ACS202 具有22 个氨基酸长度的 CDRH3, 尽管 VRC34.01 与 ACS202 和PGT151 有相同的IgHJ 种系基因J6*02,有由13 个氨基酸组成的相对较短的CDRH3[25]。 VRC-PG05重链和轻链种系基因为IGHV3-7*01和IGKV4-1*01,其体细胞超突变的频率分别为9%、6%[26],SF12 的 VH、VK突变频率分别为 17%~25%、15%~21%[34]。 其他第二代广谱中和抗体性质信息见表1。
2 bNAbs 产生机制
深入探讨促进或抑制bNAbs 进化的机制,可对HIV 疫苗的设计开发带来启示。 在自然感染期间,bNAbs 有两种不同的进化机制。
2.1 病毒进化驱动机制
HIV-1 毒株多样性的产生,已被证实是诱导bNAbs 进化的重要因素。 例如,bNAbs VRC26,针对于V1/V2 区N160 糖基表位的中和抗体,研究发现VRC26 抗体的谱系是由带有N160 聚糖的SI 病毒(superinfecting virus, SI) 所 诱 导[11], T/F 病 毒(transmitted-Founder virus, T/F)因无 N160 聚糖而无诱导抗体产生的能力。 而后SI 病毒和T/F 病毒重组促进env多样性增高,刺激该类抗体继续发生体细胞高频突变,产生广谱中和抗体。
2.2 谱系协同进化机制
T/F Env 与B 细胞未突变共同前体(unmutated common ancestor, UCA)结合诱导自体中和抗体。受抗体中和作用影响,病毒变异发生免疫逃逸,协同谱系选择对bNAbs 谱系更为敏感的逃逸突变体,从而为bNAbs B 细胞前体和亲和力成熟提供持续刺激[40]。 因此,通过分析病毒-抗体协同进化过程,利用不同Env 三聚体免疫bNAbs 中间体促进抗体亲和力成熟,就可能产生广谱中和抗体。
2.3 其他影响因素的作用
除上述两种机制外,还有其他因素影响bNAbs进化。 宿主因素(种族、HLA 亚型、性别、年龄、传输),抗原特异性因素(病毒载量、抗原暴露时间、env多样性),免疫环境(免疫细胞、抗体效应功能、免疫球蛋白亚型)等因素都可能会影响bNAbs 的产生[41]。
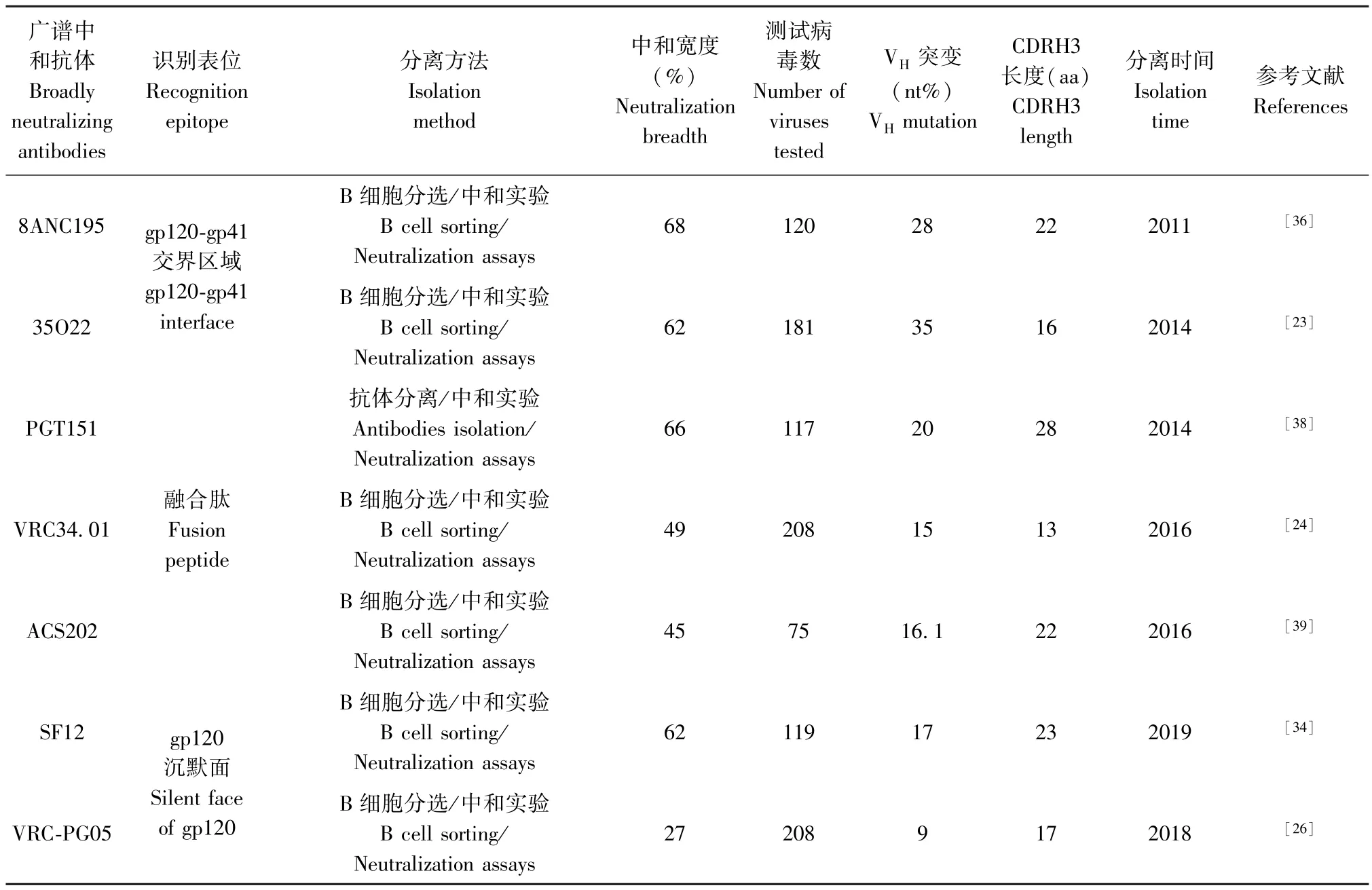
续表1
3 基于bNAbs 的HIV 疫苗设计策略
3.1 聚焦保守表位的设计策略
由于部分中和抗体(antibodies that neutralize only a narrow range of viruses, nNAbs)和 bNAbs 靶向病毒包膜糖蛋白Env 相同区域,nNAbs 表位暴露可能会阻碍抗原与具有广谱中和潜力B 细胞的结合[42],阻碍bNAb 的诱导。 因此驱动抗体识别Env保守表位的一种方法是阻碍nNAbs 表位的暴露。另一种方法是将抗体应答集中在Env 保守表位,例如CD4bs,需要优化的免疫原方案包括选择性去除聚糖,筛选单克隆抗体,然后再逐步恢复去除的聚糖,从而诱导抗体的宽度[43]。
3.2 序贯免疫设计策略
为了克服HIV-1 病毒多样性的问题,可能需要不同的Env 抗原来引导体液反应朝着高中和广度方向发展。 基于HIV A、B 和C 进化支序列设计的SOSIP 三聚体分别以单独、组合鸡尾酒疗法以及依次顺序形式给予家兔[44],结果表明,不同Env 三聚体依次顺序诱导的情况下,中和抗体反应得到促进。 克服HIV-1 多样性的另一种方法是使用镶嵌抗原[43],通过设计针对Env 三聚体多个靶点的嵌合免疫原,引发机体免疫反应,以解决HIV 病毒遗传多样性的问题。
3.3 模仿自然感染的设计策略
HIV-1 T/F 病毒与HIV-1 bNAb 共进化的研究表明,中和宽度的发展依赖于病毒env多样性的增加[11]。 极少数慢性HIV-1 感染者会产生针对大多数病毒亚型广谱和强效的中和抗体,这证明人类B细胞谱系可以克服HIV-1 病毒极端多样性的问题。通过研究“精英中和者”体内病毒抗体共进化、bNAb的产生机制,寻找诱导产生bNAbs 的免疫原,可促进HIV 疫苗的研发进展。 由此概括出B 细胞谱系疫苗设计策略为:利用特异性B 细胞分选技术将bNAbs 和 bNAbs 前体分离,根据 bNAbs 和 bNAbs 前体序列推断 bNAbs 中间体序列(intermediate antibodies, IA)、UCA 序列,并设计出 IA、UCA 免疫原。
3.4 靶向bNAb B 细胞前体的设计策略
HIV-1 Env 和基于Env 设计的免疫原通常不会与bNAbs 的推断种系前体相互作用,这可能是Env和基于Env 设计的免疫原无法有效诱导bNAbs 原因[45]。 “种系靶向”策略旨在激活表达未突变前体B 细胞,然后进一步免疫引导bNAb 成熟[43]。 由于CD4bs 在HIV-1 毒株中相对保守,成为种系靶向疫苗研究的热点。 此外,也开发出胚系免疫原,以诱导bNAbs 靶向Env 不同表位[43]。
4 总结
近来,抗体分离技术的进步促使大量bNAbs 被发现,随后科研人员对于bNAbs 的功能特性进行了诸多研究,但控制bNAbs 进化产生的关键因素仍然未知,无法通过疫苗接种获得bNAbs,限制了HIV疫苗研发。 目前无用于HIV bNAbs 研究的小动物模型,SHIV 感染恒河猴是HIV 相关研究的理想模型。 但此模型在研究bNAbs 反应生成机制存在一些缺陷:实验周期长,体液免疫反应不确定等。 因此,为深入研究bNAbs 进化生成机制,探索影响bNAbs 发生发展过程的关键因素,必须建立 HIV bNAbs 发生发展研究平台,特别是动物模型平台。因此,继续开发和完善动物疾病模型对于开发预防HIV 感染的有效疫苗同样至关重要。

