黄芪多糖调控Sirt1/FoxO1 通路抑制多囊卵巢综合征大鼠颗粒细胞自噬的研究
阳 丽,吴 湘,李 昂,何薇薇
(湖南省妇幼保健院,长沙 410008)
多囊卵巢综合征(polycystic ovarian syndrome,PCOS)是临床常见妇科内分泌疾病,会导致内分泌系统紊乱,而PCOS 中出现卵巢颗粒细胞明显凋亡情况,而凋亡与自噬之间存在较多交叉位点,且自噬参与许多生理病理过程[1-2]。 卵巢颗粒细胞自噬可影响卵泡发育和卵泡闭锁,从而影响生育功能[3]。 黄芪多糖(astragalus polysaccharides,APS)在黄嘌呤氧化酶诱导的肺癌中可以抑制自噬从而发挥抗肿瘤作用[4],但在PCOS 中尚未发现相关研究。沉默信息调节因子1/叉头状转录因子O1(silent mating type information regulation 2 homolog 1/forkhead box transcription factor O1,Sirt1/FoxO1)作为自噬相关通路在PCOS 卵巢组织中处于激活状态,可以通过对颗粒细胞、卵泡细胞的调控从而抑制卵泡正常发育过程[5],且本研究预实验结果显示PCOS 中颗粒细胞自噬现象明显。 APS 是否影响PCOS 大鼠颗粒细胞自噬尚不清楚。 因此,建立PCOS 大鼠颗粒细胞自噬模型,探究APS 对其影响,为临床提供一定依据。
1 材料和方法
1.1 实验动物
3 只 SPF 级雌性 SD 大鼠,6 周龄、体重 190~210 g,购自北京维通利华实验动物有限公司[SCXK(京)2016-0011],饲养在中南大学湘雅二医院[SYXK(湘)2017-0002]。 在温度 24℃ ~25℃、湿度50%~60%、自然光照、自由摄食饮水,定时通风环境中饲养。 本实验动物使用3R 原则给予人道关怀,经湖南省妇幼保健院伦理委员会审核批准(2020-S061)。
1.2 主要试剂与仪器
孕马血清促性腺激素(pregnant mare serum gonadotropin,PMSG)(上海生物化学制药厂,批号:820120);CCK8 试剂盒、一抗促卵泡刺激素受体(follicle stimulating hormone receptor,FSHR)、Sirt1、FoxO1、哺乳动物同族物微管相关蛋白1 轻链 3(microtubule-associated protein 1 light chain 3,LC3)、β-actin(美国 abcam 公司,货号分别为:ab228554、ab150557、 ab189494、 ab58518、 ab229327、ab179467);丙酸睾丸酮(中国 aladdin 科技公司,CAS 号:57-85-2);自噬诱导剂C2-神经酰胺(美国Sigma 公司,批号:A7191);APS(纯度90%)(中国上海源叶生物科技公司,批号:20170316)。 酶标仪(中国BioBase 公司,型号:inark);透射电镜(日立高新科技有限公司,型号:ChromAssist Data Station);蛋白凝胶系统(上海Bio-Rad 公司,型号:7500)。
1.3 实验方法
1.3.1 大鼠卵巢颗粒细胞的分离与培养
无菌环境中大鼠皮下注射50 IU PMSG,48 h 后大鼠处死,无菌条件下摘取卵巢,去除周围脂肪组织,低倍镜下用25 号针头刺破卵泡,轻轻挤压,逸出卵母细胞和颗粒细胞,吹打使细胞分离,200 目网筛过滤,800 r/min 离心10 min,弃上清,收集细胞。 取部分细胞台盼蓝染色计数,未见蓝染的为死细胞。将颗粒细胞稀释密度为每毫升1×105个,添加10%胎牛血清DMEM/F12 培养液在37℃、5% CO2培养箱中培养。
1.3.2 免疫荧光鉴定离体的大鼠卵巢颗粒细胞
细胞贴壁生长48 h 后经胰蛋白酶消化,直至消化成单个圆形细胞,添加DMEM/F12 终止消化,收集细胞置于含载玻片的24 孔培养板中,细胞爬片,待密度约70%时,多聚甲醛固定,细胞免疫荧光染色。 滴加一抗 FSHR(1 ∶200)4℃封闭过夜,滴加二抗,室温孵育1 h,荧光显微镜卤素2 灯光源激发绿色荧光,进行观察拍照。
1.3.3 CCK8 检测 APS 对卵巢颗粒细胞增殖的影响
每毫升1×105个正常卵巢颗粒细胞接种至96孔板中,待细胞贴壁后加含 0、100、200、400 μg/mL APS 的10%胎牛血清DMEM/F12 培养液在37℃、5% CO2培养箱中培养贴壁,分别在贴壁0 h、24 h加CCK8 试剂继续培养1~4 h,酶标仪检测450 nm下各孔细胞光密度(optic density,OD)。 6 个重复,3个平行。 验证APS 对正常卵巢颗粒细胞的影响。
1.3.4 PCOS 卵巢颗粒细胞的自噬模型建立
参考文献[6]结合本实验确定诱导自噬的剂量。在前期研究发现,10-5mol/L 丙酸睾丸酮作用卵巢颗粒细胞 24 h 可以建立 PCOS 细胞模型,1、2、5、10、20 μmol/L C2-神经酰胺作用大鼠卵巢颗粒细胞24、48 h,细胞自噬染色检测试剂盒(MDC 荧光染色)检测细胞自噬情况。
1.3.5 细胞分组及给药处理
正常大鼠分离的颗粒细胞为正常组,模型组、100、200、400 μg/mL APS 组。 正常组为鉴定过的卵巢颗粒细胞,其余各组添加丙酸睾丸酮+C2-神经酰胺作用 24 h。 24 h 后更换培养液,100、200、400 μg/mL APS 组分别用含 100、200、400 μg/mL APS 10%胎牛血清DMEM/F12 培养液培养,模型组、正常组用正常10%胎牛血清DMEM 培养液培养24 h 进行实验。
1.3.6 CCK8 检测细胞增殖情况
将1.3.5 各组细胞处理24 h 后,参考1.3.3中CCK8 试剂处理方法,检测细胞增殖情况。
1.3.7 透射电镜观察自噬体情况
将1.3.5 各组细胞处理24 h 后细胞消化后爬片,乙醇及丙酮脱水,环氧树脂浸透、包埋,超薄切片机切片(厚度:60 nm),醋酸双氧轴-柠檬酸铅双重染色,透射电镜观察并拍照。
1.3.8 免疫印迹法检测细胞中Sirt1、FoxO1、LC3蛋白表达情况
将1.3.5 各组细胞处理24 h 后添加蛋白裂解液,冰上裂解10 min,4℃ 13000 r/min 离心10 min收集总蛋白,上样20 μg,PVDF 膜转膜后封闭;加入一抗 Sirt1、FoxO1、LC3、β-actin,4℃ 孵育过夜;加入对应二抗,蛋白凝胶系统定量分析,待测蛋白相对表达水平=待测蛋白灰度值/β-actin 灰度值。
1.4 统计学方法
本研究数据采用GraphPad 8.0 软件进行分析。计量资料以平均数±标准差()描述,多组间比较行单因素方差分析,进一步两两比较采用SNK-q检验。P<0.05,差异显著,具有统计学意义。
2 结果
2.1 大鼠卵巢颗粒细胞的鉴定结果
FSHR 蛋白在大鼠卵巢颗粒细胞的平均阳性表达量93.18%>90%,见图1。 可进行接下来实验。

图1 大鼠颗粒细胞的鉴定Figure 1 Identification of rat granulosa cells
2.2 APS 对卵巢颗粒细胞增殖的影响
0、100、200、400 μg/mL APS 处理正常卵巢颗粒细胞,分别在贴壁0、24 h 比较,细胞OD450差异均无统计学意义(P>0.05)。 见表1。
表1 不同浓度APS 处理下卵巢颗粒细胞OD450水平比较(,n=6)Table 1 Comparison of OD450 levels in ovarian granulosa cells treated with different concentrations of APS

表1 不同浓度APS 处理下卵巢颗粒细胞OD450水平比较(,n=6)Table 1 Comparison of OD450 levels in ovarian granulosa cells treated with different concentrations of APS
组别Groups OD450 0 h 24 h 0 μg/mL APS 2.16±0.34 3.41±0.35 100 μg/mL APS 2.41±0.27 3.68±0.42 200 μg/mL APS 2.37±0.25 3.78±0.35 400 μg/mL APS 2.29±0.19 3.95±0.69 F 1.016 1.366 P 0.406 0.282
2.3 PCOS 卵巢颗粒细胞的自噬模型建立情况
1、2、5、10、20 μmol/L C2-神经酰胺作用大鼠卵巢颗粒细胞24、48 h,结果发现C2-神经酰胺在10、20 μmol/L 处理细胞 24 h、5、10、20 μmol/L 处理细胞48 h 均可诱导自噬抑制细胞增殖,结合文献及自噬效果,确定10-5mol/L 丙酸睾丸酮、10 μmol/L C2-神经酰胺作用大鼠卵巢颗粒细胞24 h 构建PCOS大鼠卵巢颗粒细胞自噬模型。
2.4 APS 对PCOS 卵巢颗粒自噬细胞增殖的影响
正常组、模型组、100、200、400 μg/mL APS 组在细胞贴壁 0 h 时,OD450差异无统计学意义(P>0.05)。 细胞贴壁24 h,与正常组相比,模型组细胞OD450降低(P<0.05);与模型组相比,100、200、400 μg/mL APS 组细胞 OD450升高(P<0.05)。 见表 2。
表2 5 组细胞中OD450水平比较(,n=6)Table 2 Comparison of OD450 levels in 5 groups

表2 5 组细胞中OD450水平比较(,n=6)Table 2 Comparison of OD450 levels in 5 groups
注:与正常组相比,#P<0.05;与模型组相比,*P<0.05。Note. Compared with the normal group, #P<0.05. Compared with the model group, *P<0.05.
组别Groups OD450 0 h 24 h正常组Normal group 2.33±0.34 4.06±0.36模型组Model group 2.43±0.26 2.96±0.30#100 μg/mL APS 组100 μg/mL APS group 2.39±0.37 3.51±0.35*200 μg/mL APS 组200 μg/mL APS group 2.43±0.25 3.58±0.29*400 μg/mL APS 组400 μg/mL APS group 2.44±0.36 4.67±0.35*F 0.122 22.593 P 0.973 0.000
2.5 APS 对PCOS 卵巢颗粒自噬细胞自噬的影响
与正常组相比,模型组细胞核附近出现大量自噬小体,双层、单层膜包裹胞质形成封闭、圆形结构,部分自噬小体内膜溶解,自噬小体周围可见单层膜结构包裹着一些被降解的胞浆、类似自噬小体结构;100 μg/mL APS 组与模型组结构类似,随着APS 剂量的升高,自噬小体数量减少,在400 μg/mL APS 组时正常。 见图 2。

图2 5 组细胞中细胞自噬情况Note. A, Normal group. B,Model group. C,100 μg/mL APS group. D,200 μg/mL APS group. E,400 μg/mL APS group.Figure 2 Autophagy in group 5 cells
2.6 APS 对 PCOS 卵巢颗粒自噬细胞中 Sirt1、FoxO1、LC3 蛋白的影响
与正常组相比,模型组细胞中Sirt1、FoxO1、LC3Ⅱ/LC3Ⅰ蛋白水平升高(P<0.05);与模型组相比,100、200、400 μg/mL APS 组细胞中 Sirt1、FoxO1、LC3Ⅱ/LC3 Ⅰ蛋白水平降低(P<0.05)。 见图 3、表3。
表3 5 组细胞中 Sirt1、FoxO1、LC3Ⅱ/LC3Ⅰ蛋白水平比较(,n=6)Table 3 Comparison of Sirt1, FoxO1 and LC3Ⅱ/LC3Ⅰ protein levels in cells of groups 5
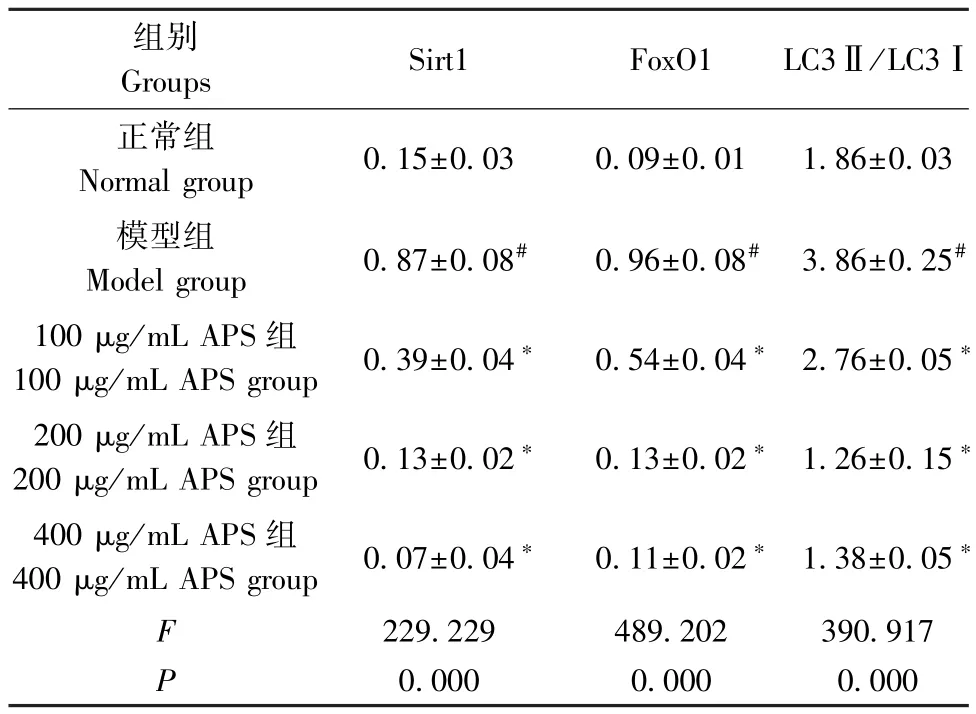
表3 5 组细胞中 Sirt1、FoxO1、LC3Ⅱ/LC3Ⅰ蛋白水平比较(,n=6)Table 3 Comparison of Sirt1, FoxO1 and LC3Ⅱ/LC3Ⅰ protein levels in cells of groups 5
注:与正常组相比,#P<0.05;与模型组相比,*P<0.05。Note. Compared with the normal group, #P<0.05. Compared with the model group, *P<0.05.
组别Groups Sirt1 FoxO1 LC3Ⅱ/LC3Ⅰ正常组Normal group 0.15±0.03 0.09±0.01 1.86±0.03模型组Model group 0.87±0.08# 0.96±0.08# 3.86±0.25#100 μg/mL APS 组100 μg/mL APS group 0.39±0.04* 0.54±0.04* 2.76±0.05*200 μg/mL APS 组200 μg/mL APS group 0.13±0.02* 0.13±0.02* 1.26±0.15*400 μg/mL APS 组400 μg/mL APS group 0.07±0.04* 0.11±0.02* 1.38±0.05*F 229.229 489.202 390.917 P 0.000 0.000 0.000

图3 5 组细胞中 Sirt1、FoxO1、LC3 蛋白表达情况Note. A, Normal group. B, Model group. C, 100 μg/mL APS group. D, 200 μg/mL APS group. E, 400 μg/mL APS group.Figure 3 Expression of Sirt1, FoxO1 and LC3 protein in 5 groups
3 讨论
颗粒细胞是卵泡主要功能细胞,与卵细胞成熟和排卵关系密切,而PCOS 中颗粒细胞减少,导致患者无卵[7];在本研究中以大鼠中分离卵巢颗粒细胞作为研究对象,FSHR 在卵巢颗粒细胞上表达,细胞膜上免疫荧光阳性定位,可用FSHR 阳性率反映分离的细胞纯度,当纯度>90%时说明所分离颗粒细胞可进行实验。 本研究中FSHR 蛋白在大鼠卵巢颗粒细胞中的平均阳性表达量93.18%>90%,可用于研究。 颗粒细胞减少这一现象与细胞凋亡有关,而凋亡与自噬存在多重交叉,二者具有多种共同调控因子,且自噬是凋亡的必要条件,相互促进共同影响疾病[8]。 在本研究中发现,10-5mol/L 丙酸睾丸酮、10 μmol/L C2-神经酰胺作用大鼠卵巢颗粒细胞24 h 构建PCOS 大鼠卵巢颗粒细胞自噬模型,模型组细胞增殖下降,细胞核附近出现大量自噬小体,部分自噬小体内膜溶解,自噬小体周围可见单层膜结构包裹着一些被降解的胞浆、类似自噬小体结构,提示卵巢颗粒细胞自噬现象明显,模型建立成功。 APS 是黄芪干燥根主要的活性成分之一,具有介导宿主免疫反应,降低机体伤害等功能[9];在T淋巴细胞经顺铂处理后自噬过多中具有抑制自噬功能,从而缓解顺铂对机体的伤害[10]。 为改善机体功能,APS 在PCOS 卵巢颗粒细胞过度自噬中是否发挥作用尚不情况。 不同剂量APS 处理正常卵巢颗粒细胞,各组细胞OD450差异无统计学意义,提示APS 对正常卵巢颗粒细胞增殖影响不明显。 但经诱导PCOS 颗粒细胞自噬后不同剂量APS 处理,各组细胞OD450升高、自噬现象也得到缓解,提示APS可以抑制PCOS 卵巢颗粒细胞自噬现象,从而缓解自噬过度对机体的影响。
FoxO 转录因子是一类关键调控自噬因子,激活FoxO 可加强自噬,从而影响细胞增殖、凋亡、存活、周期等过程[11]。 FoxO 中以 FoxO1、FoxO3 广泛存在,2007 年采用Northern 杂交和实时荧光PCR 技术检测 FoxO1 存在于心脏、肝、头脑、骨骼、卵巢、睾丸、脾、胰腺等处,存在广泛[12]。 FoxO1 能够激活细胞参与自噬活动,同时在分子水平上参与细胞增殖、分化等过程[13]。 FoxO1 转录活性受Sirt1 等上游转录调控因子的调节,而Sirt1 作为沉默信息调节因子Sir2 家族主要成员,可以通过直接作用影响自噬,或通过调节FoxO1 影响自噬[14-16]。 在自噬过程中特征蛋白LC3 分Ⅰ型和Ⅱ型,其中LC3 Ⅰ存在细胞质中,LC3Ⅱ存在于自噬体膜上[17],自噬发生时LC3 Ⅰ被ATG7 活化后转运至ATG3,并在ATG3 作用修饰为LC3 Ⅱ,LC3Ⅱ/LC3Ⅰ反映自噬情况[18];在PCOS 卵巢颗粒细胞自噬中LC3Ⅱ/LC3Ⅰ比例升高反映自噬状况[19]。 FoxO1 可以通过调节LC3 Ⅱ/LC3Ⅰ影响自噬[20]。 本研究发现,与正常组相比,模型组细胞中 Sirt1、FoxO1、LC3Ⅱ/LC3Ⅰ蛋白水平升高,提示在PCOS 大鼠卵巢颗粒细胞自噬中激活Sirt1 调控FoxO1,从而LC3Ⅰ向LC3Ⅱ转化,促进自噬。 与模型组相比,100、200、400 μg/mL APS 组细胞中 Sirt1、FoxO1、LC3Ⅱ/LC3Ⅰ蛋白水平降低,提示APS 可能是通过抑制Sirt1/FoxO1 通路发挥对PCOS大鼠卵巢颗粒细胞自噬的缓解,从而降低细胞损伤。
综上所述,APS 可能通过抑制Sirt1/FoxO1 通路发挥抑制PCOS 大鼠卵巢颗粒细胞自噬作用,本文首次证明APS 可减轻PCOS 大鼠卵巢颗粒细胞自噬。 但影响自噬通路较多,亦可能通过别的通路发挥作用,探究更多信号通路是接下来研究的内容。

