黄芪甲苷对缺氧/复氧诱导大鼠心肌细胞能量代谢重编程的影响及机制
张蒙 ,王新东 ,2
1 南京中医药大学第三临床学院,南京210028;2 南京中医药大学附属中西医结合医院心血管科
冠状动脉介入技术提高了冠心病患者急慢性心肌缺血事件的生存率,但缺血导致的心肌不良重构进而进展为心力衰竭仍是目前尚未攻克的临床难题,其中缺血再灌注损伤是关键机制之一。心脏是高能耗器官,心肌细胞正常的能量代谢是维持细胞活力和心脏泵功能的重要基础。能量代谢障碍引起的心肌能量重构能够促进心肌细胞凋亡而进展为心肌结构重构,进而影响心肌的舒缩功能。调节能量代谢可改善心功能的异常及结构的重塑,是临床重要的治疗靶点。缺血再灌注损伤不仅诱导心肌细胞凋亡等损伤,还伴有心肌细胞能量代谢重编程[1-2],在继发的结构重构中发挥重要作用。黄芪在缺血性心血管疾病中有广泛的应用,其多糖等成分可调节心肌能量代谢而减轻心肌重构[3],机制与AMPK 等信号通路相关[4]。黄芪甲苷(AS-Ⅳ)是中药黄芪中的一种皂苷成分[5],对缺血再灌注心肌具有保护作用[6]。2021 年 2 月—5 月,本研究观察黄芪甲苷对缺氧/复氧(H/R)诱导的大鼠心肌细胞能量代谢重编程的影响,并探讨其机制。
1 材料与方法
1.1 细胞、试剂及仪器 大鼠心肌细胞(H9c2 细胞)购自凯基生物。黄芪甲苷、腺苷酸活化蛋白激酶(AMPK)抑制剂Compound C 购自美国Selleck 公司,DMEM培养基、FBS购自美国GIBCO公司,CCK-8试剂盒购自美国MedChemExpress公司,Annexin V-FITC细胞凋亡检测试剂盒购自中国碧云天生物技术有限公司,二磷酸腺苷(ADP)检测试剂盒购自美国Sigma公司,三磷酸腺苷(ATP)试剂盒购自中国南京建成生物工程研究所,乙酰辅酶A(Acetyl-CoA)检测试剂盒购自中国北京索莱宝科技有限公司,TRIzol 购自美国 Thermofisher 公司,RT Master Mix for qPCR 逆转录试剂盒购自美国MedChemExpress 公司,BCA 蛋白浓度测定试剂盒购自美国GLPBIO公司,腺苷酸活化蛋白激酶α(AMPKα)、磷酸化AMPKα(p-AMPKα)、β-actin抗体购自美国Cell Signaling Technology公司。
1.2 细胞培养、分组及处理 细胞基础培养条件为DMEM 培养基+10% FBS,37 ℃,5% CO2,饱和湿度。将生长状态良好的H9c2 细胞用胰酶消化,制备5×104/mL 的单细胞悬液,接种至 96 孔板中,37 ℃、5%CO2培养24 h,细胞贴壁后随机分组。空白对照组置于以上培养箱中正常培养。H/R 组放至95% N2+5%CO2培养箱缺氧3 h、95%O2+5%CO2培养箱复氧3 h。H/R+黄芪甲苷低剂量组(H/R+AS-ⅣL 组)、H/R+黄芪甲苷高剂量组(H/R+AS-ⅣH 组)分别加入 800、1 600 μmol/L 干预 6 h 后再 H/R 处理;H/R+黄芪甲苷高剂量+AMPK 抑制剂组(H/R+AS-ⅣH+AMPKI 组)加 入 AS-Ⅳ 1 600 μmol/L 干 预 6 h+10 μmol/L Compound C干预2 h后再行H/R处理。
1.3 细胞能量代谢检测 ①取各组细胞,洗涤、消化细胞,加入裂解液裂解细胞。裂解后于4 ℃离心,取上清液,按试剂盒说明书用紫外分光度法检测细胞 ADP、ATP、Acetyl-CoA。②采用 Seahorse 细胞能量代谢分析法检测细胞外酸化率(ECAR)和氧气消耗速率(OCR)。OCR:取各组细胞,用2 mmol/L 谷氨酰胺和Seahorse XF 基础培养基室温孵育1 h,用Seahorse XF 能量代谢分析仪按操作说明获取基础呼吸和最大呼吸条件下的OCR。ECAR:取各组细胞,用含10 mmol/L 葡萄糖、1 mmol/L 丙酮酸盐、2 mmol/L 谷氨酰胺的Seahorse XF 基础培养基室温孵育1 h,应用Seahorse XF 能量代谢分析仪按操作说明获取糖酵解和最大糖酵解条件下的ECAR。
1.4 细胞内AMPK mRNA 表达检测 采用qRTPCR。取各组细胞,以12 000 r/min 离心10 min,离心半径10 cm,收集细胞沉淀,加入TRIzol,参照试剂盒说明提取总RNA,用1%琼脂糖凝胶电泳检测其完整性,并用Nanodrop ND-1000 进行浓度与完整性检测,OD260nm/OD280nm=1.9~2.0 可用于后续试验。DNA 酶处理总 RNA,取 1 μg 反转录为 cDNA,并行qRT-PCR分析。反应体系:2×SYBR Premix EX TaqTMⅡ 5 μL,模板 0.5 μL,PCR Primer 各 0.5 μL,添加dd H2O至10 μL。反应条件:95 ℃预变性30s;95 ℃变性5 s、60 ℃退火30 s、72℃延伸30 s,循环40次,最后72 ℃延伸10 min。用2-ΔΔCt法计算目的基因相对表达量。AMPK 上游引物序列5'-ACCCGCTTGAAGTGGTGGTGAA-3'、下游引物序列5'-CAGTGCACCTA ATGGACATC-3'。以 GADPH 为内参,GADPH 上游引物序列5'-GACGGTGAAGGTAGGAGTCA-3'、下游引物序列5'-GCTCTTGGAAGACGGTGATG-3'。
1.5 细胞内AMPKα、p-AMPKα 蛋白表达检测 采用Western blotting 法。取各组细胞,弃培养液并用PBS 洗涤,加入 100 μL 预冷裂解液裂解细胞,4 ℃,12 000 r/min 离心15 min,离心半径10 cm,取上清液加入等体积的2倍上样缓冲液。蛋白经SDS-PAGE分离后转膜于硝基纤维素膜(NC膜),用5%脱脂奶粉封闭1 h,加入一抗(AMPKα 1∶1 000、p-AMPKα 1∶1 000),4 ℃过夜。NC膜经PBST洗膜3次后,加入荧光二抗(1∶10 000),室温孵育60 min,化学发光法显影,用扫描系统进行分析。β-actin作为内参,目的蛋白的相对表达量=目的蛋白灰度值/β-actin蛋白灰度值。
1.6 统计学方法 采用Graphpad Prism8.0 软件。计量资料用表示,多组比较用单因素方差分析,进一步两两比较用Duncan 法。P<0.05 为差异有统计学意义。
2 结果
2.1 各组ADP、ATP及Acetyl-CoA比较 见表1。
表1 各组ADP、ATP及Acetyl-CoA比较()

表1 各组ADP、ATP及Acetyl-CoA比较()
注:与空白对照组比较,*P<0.05;与H/R组比较,#P<0.05;与H/R+AS-IVH组比较,△P<0.05。
组别空白对照组H/R组H/R+AS-ⅣL组H/R+AS-ⅣH组H/R+AS-ⅣH+AMPKI组ADP(ng/μL)42.135±3.837 19.447±2.090*28.419±3.440#△36.021±3.872#20.327±2.004△ATP(μmol/g prot)382.183±9.447 94.054±14.732*272.337±17.700#290.218±11.793#158.947±18.336△Acetyl-CoA(nmol/mg prot)1.639±0.117 4.377±0.429*1.998±0.102#1.843±0.214#2.354±0.311△
2.2 各组ECAR、OCR比较 见表2。
表2 各组ECAR、OCR比较()
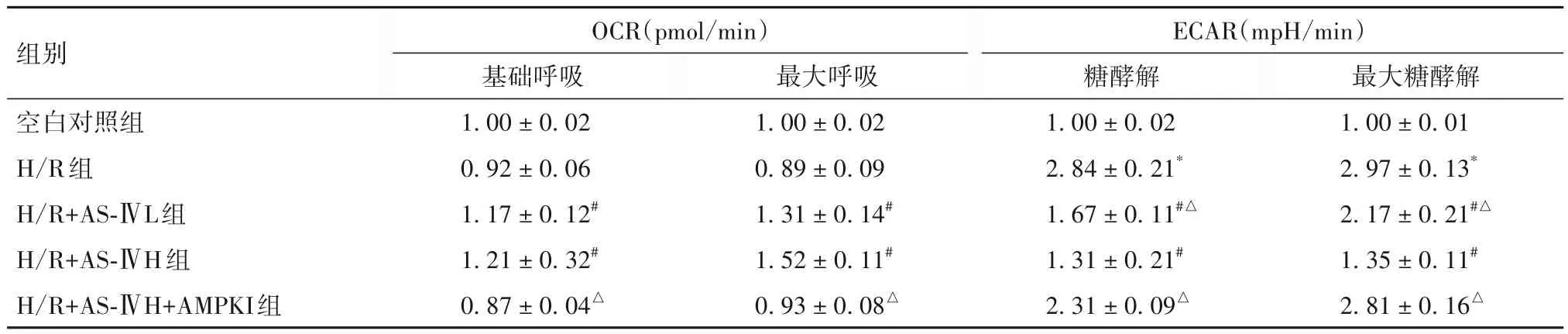
表2 各组ECAR、OCR比较()
注:与相同条件空白对照组比较,*P<0.05;与相同条件H/R组比较,#P<0.05;与相同条件H/R+AS-IVH组比较,△P<0.05。
组别空白对照组H/R组H/R+AS-ⅣL组H/R+AS-ⅣH组H/R+AS-ⅣH+AMPKI组最大糖酵解1.00±0.01 2.97±0.13*2.17±0.21#△1.35±0.11#2.81±0.16△OCR(pmol/min)基础呼吸1.00±0.02 0.92±0.06 1.17±0.12#1.21±0.32#0.87±0.04△最大呼吸1.00±0.02 0.89±0.09 1.31±0.14#1.52±0.11#0.93±0.08△ECAR(mpH/min)糖酵解1.00±0.02 2.84±0.21*1.67±0.11#△1.31±0.21#2.31±0.09△
2.3 各组AMPK mRNA 表达比较 空白对照组、H/R 组、H/R+AS-ⅣL 组、H/R+AS-ⅣH 组、H/R+AS-ⅣH+AMPKI 组AMPK mRNA 相对表达量分别为1.002 ± 0.057、0.927 ± 0.092、1.872 ± 0.692、1.984 ± 0.370、0.172 ± 0.049。与空白对照组比较,H/R 组AMPK mRNA 相对表达量低(P<0.05);与 H/R 组比较,H/R+AS-ⅣL 组、H/R+AS-ⅣH 组AMPK mRNA 相对表达量高(P均<0.05);与H/R+AS- Ⅳ H 组 比 较 ,H/R+AS- Ⅳ H+AMPKI 组AMPK mRNA相对表达量低(P<0.05)。
2.4 各组AMPKα、p-AMPKα蛋白表达比较 见表3。
表3 各组AMPKα、p-AMPKα蛋白表达比较()
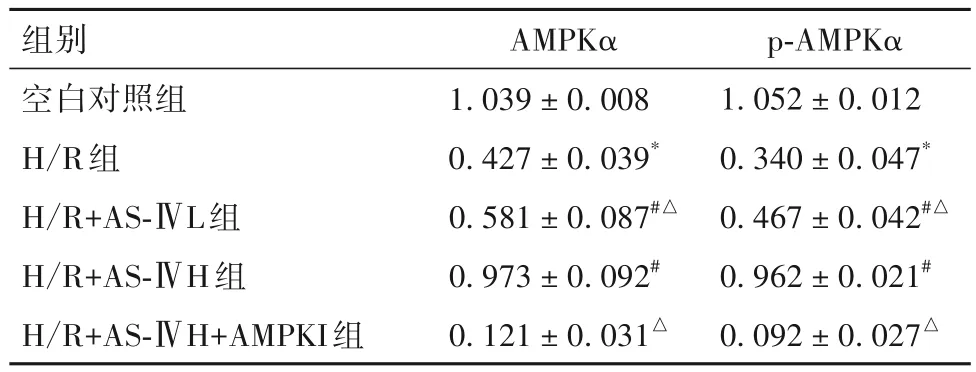
表3 各组AMPKα、p-AMPKα蛋白表达比较()
注:与空白对照组比较,*P<0.05;与H/R 组比较,#P<0.05;与H/R+AS-IVH组比较,△P<0.05。
p-AMPKα 1.052±0.012 0.340±0.047*0.467±0.042#△0.962±0.021#0.092±0.027△组别空白对照组H/R组H/R+AS-ⅣL组H/R+AS-ⅣH组H/R+AS-ⅣH+AMPKI组AMPKα 1.039±0.008 0.427±0.039*0.581±0.087#△0.973±0.092#0.121±0.031△
3 讨论
心肌细胞能量代谢重编程是缺血缺氧心肌的基本特征之一。心肌细胞在面临缺氧或者低氧微环境状态时,通过代谢重编程来适应低氧等微环境,进而维持其基本功能。以线粒体氧化代谢和能量消耗相关的代谢重编程为药理学靶点的治疗方法,已成为临床提高心脏效率、减少能量缺乏和改善衰竭心脏功能的一种非常有潜力的新型治疗方法[7-8]。
线粒体在某种意义上反映了中医“气”的作用,气的物质属性可能与线粒体相关[9]。补气中药黄芪作为治疗气虚证的代表药物在临床治疗缺血性心力衰竭等心血管疾病中有广泛的应用,临床疗效肯定,但其药效靶点机制仍需进一步阐明。对心肌能量代谢的调控可能是其药效靶点机制之一,研究显示AS-Ⅳ可保护心肌缺血,改善能量代谢,抑制心肌肥厚和纤维化,减少心肌细胞凋亡等[10]。
ATP 是心肌的直接供能物质,ADP 与无机磷酸盐在细胞器的作用下可重新转化为ATP 供能。ATP作为能量转换分子与心肌收缩做功、离子转运及生物合成等密切相关。正常心肌细胞中能量产生的底物主要是脂肪酸,通过脂肪β 氧化产生ATP 供心肌细胞利用。在心肌细胞线粒体功能障碍和冠脉出现部分或完全阻塞后血流量减少导致缺血缺氧的情况下,心肌能量代谢产生重编程,通过糖酵解和酮体氧化的供能较脂肪酸氧化减少而导致供能不足,同时这种能量代谢的重编程将降低烟酰胺腺嘌呤二核苷酸/还原型烟酰胺腺嘌呤二核苷酸而对心肌功能产生影响。因此本研究首先观察了AS-Ⅳ对H/R 诱导的心肌细胞ADP 和ATP 的影响,从而评估AS-Ⅳ对心肌产能的影响。结果显示,H/R 诱导心肌细胞中的ADP、ATP 显著降低,这与底物利用、氧化磷酸化和代谢过程紊乱相关,而AS-Ⅳ可显著逆转H/R 诱导 ADP、ATP 降低,表明 AS-Ⅳ可改善 H/R 诱导的心肌细胞底物利用和能量代谢障碍。Acetyl-CoA 作为中间代谢产物其水平升高可反映线粒体在缺氧状态下氧化代谢能力的下降,其原因与葡萄糖氧化增加有关,间接反映糖酵解表型的转换。从本研究结果可见,H/R诱导心肌细胞中Acetyl-CoA 水平升高,体现了心肌糖酵解表型的转变;而AS-Ⅳ可显著降低Acetyl-CoA,反映出AS-Ⅳ可逆转H/R 诱导心肌细胞糖酵解增加的能量代谢重编程。
Seahorse XF 技术作为目前细胞能量代谢检测的金标准,可在不破坏样本的前提下,实时反映活细胞能量代谢的变化。OCR 可反映细胞底物的氧化水平。本研究结果显示,在基础呼吸(即底物需求较少)和即最大呼吸(底物需求较多)下,H/R 诱导的心肌细胞OCR 均显著下降,反映了细胞对长链脂肪酸、葡萄糖/丙酮酸和谷氨酰胺等主要底物的利用能力不足。糖酵解和最大糖酵解条件下,H/R 诱导的心肌细胞ECAR 均显著上升,反映了H/R 诱导心肌细胞从氧化表型转换为糖酵解表型。而AS-Ⅳ可显著逆转H/R诱导的心肌能量代谢重编程。
在此基础上,本研究进一步探索了AS-Ⅳ改善H/R 诱导的心肌能量代谢重编程的机制。AMPK 是参与细胞代谢适应的一个关键信号通路,是细胞能量代谢的“感受器”,AMPK 通过氧化还原调节提高细胞存活率。AMPK 激活能够促进脂肪酸β 氧化[11],改善心力衰竭脂肪酸β 氧化不足导致的能量重构。本研究结果显示,AS-Ⅳ可上调H/R 心肌细胞AMPK mRNA 和蛋白表达,促进其磷酸化,提示AS-Ⅳ可激活H/R心肌细胞AMPK。AS-Ⅳ的作用均可被 AMPK 抑制剂逆转,提示,AS-Ⅳ改善H/R 心肌细胞能量代谢重编程的药理效应可能与上调AMPK表达相关。
综上所述,AS-Ⅳ通过AMPK信号传导改善H/R诱导的心肌细胞能量代谢重编程,从而对H/R 损伤的细胞发挥保护作用。

