移植低氧预处理MSC对CKD大鼠肾功能的影响及机制
邵丽诗,邢艺苑,2,罗成诚,杨力 ,马逸群,万珊杉 ,王家平
1 昆明医科大学第二附属医院影像科,昆明650500;2 郑州市疾病预防控制中心内科;3 云县人民医院泌尿外科;4 昆明医科大学解剖学与组织胚胎学系;5 云南昆钢医院 大理大学第七附属医院影像科
慢性肾脏病(CKD)是一种进行性肾功能恶化疾病,目前,尚无有效治疗方法。间充质干细胞(MSC)具有自我更新、多分化潜能性和分泌细胞因子的特性,可通过细胞融合、分化和旁分泌信号传导等多种机制修复受损肾脏[1]。由于MSC能归巢到受损部位的数量较少,且受损组织局部缺血、炎症、缺氧和氧化应激等导致MSC 存活率低,限制了其应用[2]。低氧预处理MSC(HP-MSC)能有效提高细胞存活率和分泌能力[3]。低氧还可通过调节低氧诱导因子提高MSC 活性和促血管生成潜能[4]。基质细胞衍生因子1(SDF-1)是一种干细胞趋化因子,能通过与其特异性受体4(CXCR)结合促使MSC 迁移至损伤部位,因而SDF-1-CXCR4 信号轴对MSC 归巢至受损组织至关重要[5]。研究发现,短期低氧预处理可增加MSC表面CXCR4 的表达,而且HP-MSC 能更有效减轻肾缺血/再灌注损伤[6]。然而,HP-MSC 对 CKD 的影响以及SDF-1-CXCR4 通路在该过程中发挥的作用仍不明确。2016 年 1 月—2017 年 3 月,本研究观察HP-MSC 对CKD 大鼠肾功能的影响,并探讨其可能的作用机制。现将结果报告如下。
1 材料与方法
1.1 动物、试剂及仪器 58 只雄性SD 大鼠,100~120 g,5~6 周,购自四川大学实验动物中心,SCXK(川)2018-026,于动物安置标准设施中饲养,温度24 ℃,光/暗循环时间12 h,每日更换垫料、饲料和水。所有实验操作均符合昆明医科大学实验动物伦理学要求。胎牛血清FBS(美国Sigma 公司);EDTA(美国Amresco Hualcyuan biotechnology 公司);阿霉素(ADR,美国Sigma 公司);PT-PCR 逆转录试剂盒(中国Invitrogen 公司);荧光定量PCR 试剂盒(日本Takara 公司);TRIzol Reagent(中国Invitrogen 公司);兔抗大鼠SDF-1(美国Santa Cruz 公司);山羊抗兔IgG(美国Santa Cruz 公司);兔抗大鼠CXCR4(中国博士德公司);5%CO2培养箱(中国HERACELL 公司);冰冻切片机(德国Leica公司);GDST600凝胶扫描系统(英国UVP 公司);SDS-PAGE 电泳槽(英国Bio-Rad公司);PCR仪(美国Agilent公司);核酸蛋白分析仪(美国Beckman)。
1.2 MSC的分离与培养 取2只12周龄SD大鼠颈椎脱臼处死,剥离股骨及胫骨,用含10% FBS 的DMEM 反复冲洗大鼠胫骨和股骨的骨髓,经无菌滤网过滤冲洗得到细胞悬浮液,收集细胞,2 000 r/min离心30 min,离心半径8 mm,加入PBS 溶液,1 600 r/min 再次离心10 min,离心半径8 mm,获取MSC。收集细胞,将其置于含细胞生长液和抗生素的培养瓶中,于37 ℃、5%CO2的培养箱培养;更换培养基去除非黏附细胞,保留呈梭形形态的贴壁细胞。取传至第四代的MSC 用CD29/CD45/CD11b/CD90 特异性抗体孵育,用流式细胞仪分析MSC的表面抗原。
1.3 动物分组及模型构建 将56 只大鼠适应性饲养1 周,随机分为模型组40 只、假手术(Sham)组12只、对照组4 只。模型组于腹腔注射2%戊巴比妥(0.2 mL/100 mg)麻醉,取俯卧位固定,于左侧肋脊角切口进入腹腔,切除左侧肾脏,止血后逐层缝合包扎创口,4 周后经尾静脉注射 ADR(2.5 mg/kg),1 周后再次给予相同剂量ADR构建CKD模型;对照组于相同部位注射等体积生理盐水;Sham 组做左侧肋脊角切口,随后缝合包扎,于相同部位注射等体积生理盐水。造模成功后将模型组40只大鼠随机分为CKD组4 只及ADR(ADR)组、干细胞移植(MSC)组、低氧预处理干细胞移植(HP-MSC)组各12 只。将CKD组、对照组大鼠颈椎脱臼处死,取肾脏组织待测。
1.4 移植MSC 取部分MSC 在常氧环境[37 ℃、5%CO2、95%空气环境(含大约21%O2)]中培养;另取部分MSC 在低氧环境(37 ℃、5% CO2、2%O2、93%N2)中培养。24 h后加入抗体,用流式细胞术检测细胞表面CXCR4表达。取以上处理后的(1×106/mL)细胞悬液各2 mL,分别经右肾动脉注射入MSC组、HPMSC组,Sham组、ADR组注射L-DMEM培养液2 mL。
1.5 生化指标检测 MSC 移植第1、7 天,于代谢笼中收集 24 h 尿液样本,取 5 mL 尿液,3 000 r/min 离心5 min,离心半径8 mm,去除沉淀。收集尿液的过程中,大鼠自由饮水,但不进食。另外,经内眦静脉采血3~5 mL,3 000 r/min离心l0 min,离心半径6.5 mm,取上清液。用全自动生化分析仪测定PRO、Hb、ALB、BUN、SCr。
1.6 肾脏组织病理变化观察 采用HE 染色法。分别于MSC 移植第1、7 天后,从各组各自抽取4 只大鼠,经颈脱臼处死,迅速取出肾脏分离成若干小块,用4%多聚甲醛固定过夜后,石蜡包埋制作成4 μm 的石蜡切片,进行 HE 染色,于 400 倍光学显微镜下观察拍片。
1.7 肾脏组织中SDF-1 mRNA 表达检测 采用RT-PCR。取CKD 组和正常组肾脏组织研磨离心,TRIzol 法提取总RNA,根据说明书提取总RNA,反转录合成cDNA 后进行聚合酶链式反应。根据PCR试剂盒说明书进行qRT-PCR 反应。PCR 反应体系25 μL,cDNA 0.2 μg,上、下游引物各1 μL,2 X Easy Taq PCR SuperMix 12.5 μL,RNase-free Water 8.5 μL。反应条件:95 ℃预变性5 s,95 ℃变性30 s、55 ℃退火30 s、72 ℃延伸30 s 40 个循环,72 ℃ 延伸5 min,然后用2.0%琼脂糖凝胶电泳分离PCR 扩增产物。以 GAPDH 为内参基因,用 2-ΔΔCt法计算 SDF-1 RNA 的相对表达量。SDF-1 上游引物序列5'-AAGGTCTGCGCTGTGCTG-3',下游引物序列5'-CTCAGGCTGGCTTACC-3';GAPDH 上游引物序列 5'-TGCTGGCTGGCTGCTCTC-3',下游引物序列5'-ATGAGGTCCCACCCCTGTTGC-3'。
1.8 统计学方法 采用SPSS19.0 统计软件。计量资料用表示,两组比较采用t检验,多组比较采用单因素方差分析,进一步两两比较采用LSD-t法。P<0.05为差异有统计学意义。
2 结果
2.1 MSC 特性鉴定结果及 CXCR4 的表达 MSC 形态均一呈梭形,鱼群样分布,旋涡状生长。流式细胞仪显示MSC 高表达CD29(99.8%)、CD90(99.4%),而低表达 CD11b(0.25%)、CD45(0.13%)。常氧MSC 及 HP-MSC 的 CXCR4 表达率分别为(26.80 ±1.57)%、(15.74 ± 1.03)%。HP-MSC 的 CXCR4 表达率高于常氧MSC(P<0.01)。
2.2 各组生化指标比较 见表1。
表1 各组移植第1、7天生化指标比较()
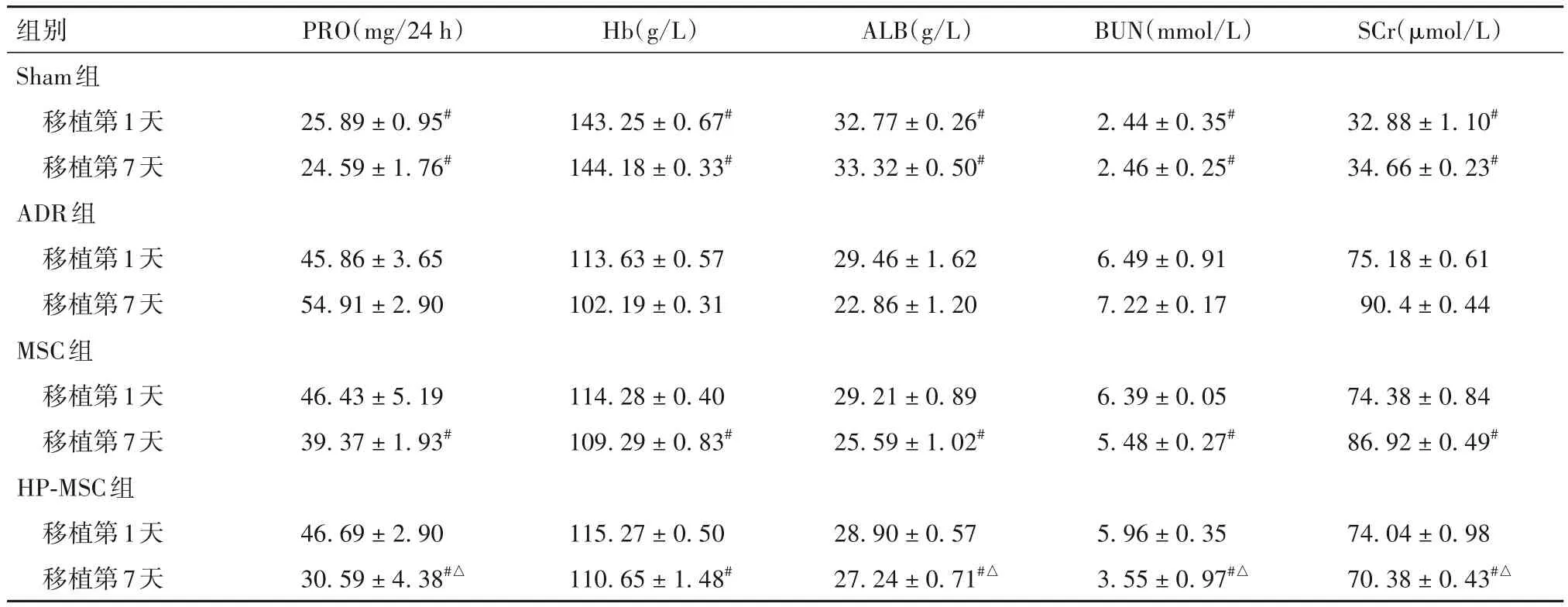
表1 各组移植第1、7天生化指标比较()
注:与ADR组同一时间点比较,#P<0.05;与MSC组同一时间点比较,△P<0.05。
ALB(g/L)PRO(mg/24 h)Hb(g/L)BUN(mmol/L)SCr(μmol/L)组别Sham组移植第1天移植第7天ADR组移植第1天移植第7天MSC组移植第1天移植第7天HP-MSC组移植第1天移植第7天25.89±0.95#24.59±1.76#143.25±0.67#144.18±0.33#32.77±0.26#33.32±0.50#2.44±0.35#2.46±0.25#32.88±1.10#34.66±0.23#45.86±3.65 54.91±2.90 113.63±0.57 102.19±0.31 29.46±1.62 22.86±1.20 6.49±0.91 7.22±0.17 75.18±0.61 90.4±0.44 46.43±5.19 39.37±1.93#114.28±0.40 109.29±0.83#29.21±0.89 25.59±1.02#6.39±0.05 5.48±0.27#74.38±0.84 86.92±0.49#74.04±0.98 70.38±0.43#△46.69±2.90 30.59±4.38#△115.27±0.50 110.65±1.48#28.90±0.57 27.24±0.71#△5.96±0.35 3.55±0.97#△
2.3 各组肾脏组织病理变化比较 HE染色结果显示,Sham 组肾小球和肾小管形态正常,ADR 组肾小球局灶节段性硬化,肾小管严重萎缩,肾小球系膜细胞和基质呈不同程度增生,肾间质明显纤维化。移植第7 天,MSC 组与HP-MSC 组肾脏组织损伤减轻,MSC 组肾小球尚可见局灶节段硬化,HP-MSC 组肾小球袢扩张;与MSC 组比较,HP-MSC 组肾间质纤维化改善更明显,炎症反应更轻。
2.4 对照组与CKD 组肾组织SDF-1 mRNA 表达比较 对照组与CKD组肾组织SDF-1 mRNA相对表达量分别为1.01±0.06、1.41±0.14。与对照组比较,CKD组肾组织SDF-1 mRNA相对表达量高(P<0.05)。
3 讨论
研究证实,MSC 通过发挥抗炎、抗纤维化和促进血管生成等作用修复肾脏[7],但MSC 的治疗效果一直受限于较差的生存率和归巢率。MSC 随着传代次数的增加,纯度越高,细胞贴壁生长越快,但细胞表面CXCR4 的表达量却逐渐降低,进而降低了MSC 对SDF-1的靶向迁移作用。本研究在移植前通过低氧预处理激活MSC。本研究肾功能指标检测证实,用ADR 成功地诱导了大鼠慢性肾损伤,CKD大鼠的 PRO、BUN 和 SCr 水平明显升高,且 ALB 和Hb水平降低。同时,进一步观察到肾脏组织的病理损害,表现为肾小球损伤,肾间质局灶状纤维化和ADR 所致其他的肾损伤的特征。本研究发现,CKD模型大鼠肾组织中SDF-1 mRNA 表达升高,这可能由于ADR 引起肾脏组织炎症反应进而刺激SDF-1表达升高。当移植 MSC 或 HP-MSC 7 天后,CKD 大鼠 PRO、BUN 和 SCr 水平降低,ALB 和 Hb 水平显著升高。病理检查结果显示,MSC 能减轻CKD 大鼠的肾损伤。与移植MSC 比较,移植HP-MSC 后大鼠PRO、BUN 和 SCr 水平更低,表明 HP-MSC 能够更好地减轻CKD大鼠肾损伤。
SDF-1 可控制细胞黏附和分泌其他因子,诱导细胞穿过血管内皮细胞[8]。当MSC 短时间暴露于低氧条件下时,这会导致CXCR4 表达增加,并改善SDF-1 介导的趋化性[9]。本研究结果也证明,HP-MSC 的CXCR4 表达率升高,说明低氧能诱导MSC 表达更多的CXCR4。此外,还有研究认为CKD肾脏组织细胞局部配体SDF-1高表达对表面高表达受体CXCR4的MSC具有定向趋化作用,并且该作用呈浓度依赖性[10]。SDF-1与CXCR4同时高表达能增强MSC 的归巢能力。本研究发现,CKD 大鼠肾组织中SDF-1 mRNA 表达高于正常大鼠。以上表明低氧预处理的MSC 通过调节SDF-1-CXCR4 轴来提高其修复肾损伤的能力。
MSC 暴露于低氧条件下与其归巢到体内受损组织缺氧微环境相似[11]。研究表明,HP有助于移植细胞的存活、增殖、分化以及提高其旁分泌能力[12]。HP-MSC 在受损肾组织中释放 TGF-β 和 IL-10 等抗炎因子,从而抑制炎症进展[13]。在增殖期,HP-MSC分泌肝细胞生长因子和血管内皮生长因子等,从而修复肾脏[14]。研究证实,在肾缺血再灌注损伤模型中,上述有益因子可促进血管再生,减少氧化应激和抑制细胞凋亡[12]。此外,PI3K、AKT、ERK 和 p38 信号通路在SDF-1诱导MSC归巢过程中也发挥重要的调控作用[15]。
本研究证实,HP-MSC 为通过调控SDF-1-CXCR4信号轴治疗慢性肾病提供了新方向。后期研究将进一步探讨低氧对MSC 的作用机制及SDF-1-CXCR4 信号轴涉及的相关保护机制,以期为MSC 治疗CKD提供新的理论依据。

