黑曲霉GOD基因在枯草芽孢杆菌中的表达
于思颖 程 鹏 张静博 曹平华 李元晓 马彦博 李 旺
河南科技大学动物科技学院,河南洛阳 471023
葡萄糖氧化酶(glucose oxidase,GOD)是一类含有黄素腺嘌呤二核苷酸(flavine adenine dinucleotide,FAD)的二聚体蛋白酶,能够特异性催化β-D-葡萄糖被氧化成葡萄糖酸和过氧化氢[1]。GOD 基于其安全无毒等特性广泛地应用于饲料添加剂、食品、制药和化学等领域[2-7]。
枯草芽孢杆菌(B.subtilis)作为一种革兰氏阳性菌,已被美国食品药品监督管理局(FDA)评为生物安全(Generally regarded as safe,GRAS)菌株[8],具有易于培养、繁殖速度快、遗传背景清晰等特点。与大肠杆菌相比,其具有优异的蛋白分泌能力,方便下游表达产物的分离;同时,B.subtilis具有良好的发酵工艺技术,这为目的产物进一步扩大生产提供了基础。B.subtilis表达系统已表达了多种产物并广泛应用于制药、食品和饲料等行业中[9-13]。
目前,大部分GOD 为野生菌或诱导菌生产,存在酶活力低且后续纯化困难等问题,基因工程表达的GOD宿主多为毕赤酵母,由于毕赤酵母的表达往往需要甲醇诱导,难以直接应用于饲料和养殖生产。因此,本研究克隆了来源于黑曲霉的GOD 基因,以野生型动物益生菌为宿主,以期获得高效表达GOD 的枯草芽孢杆菌,推动其在动物养殖中的应用。
1 材料与方法
1.1 试验材料
1)土样:采自河南省洛阳市某葡萄园,采用多点混合法采集0~10 cm的土壤。
2)菌株、质粒和引物见表1。

表1 本试验所用菌株、质粒和引物
3)主要试剂:邻联茴香胺、辣根过氧化物酶、真菌DNA提取试剂盒购自上海生工生物有限公司;Taq DNA 聚合酶、dNTPs、DNA Marker、蛋白质Marker 购自Takara 公司;T4DNA 连接酶、NotI、NdeI、HindⅢ限制性内切酶购自Sigama 公司;质粒小提试剂盒、胶回收试剂盒购自天根生化科技(北京)有限公司;其他化学试剂均为国产分析纯。
4)培养基。
①平板分离培养基:葡萄糖80 g/L、蛋白胨3 g/L、硫酸铵0.4 g/L、磷酸二氢钾0.19 g/L、硫酸镁0.16 g/L、碳酸钙3.5 g/L、可溶性淀粉10 g/L、碘化钾1.7 g/L、脱氧胆酸钠0.2 g/L、加入适量链霉素(100 μg/mL)、琼脂粉15 g/L、磷酸缓冲液0.1 mol/L,pH为5.6。
②发酵培养基:葡萄糖80 g/L、蛋白胨3 g/L、磷酸二氢钾2 g/L、硫酸镁0.7 g/L、氯化钾0.5 g/L、硝酸钠0.4 g/L、碳酸钙3.5 g/L,自然pH。
③PDA 培养基:马铃薯200 g(加水1 L,煮沸30 min,纱布过滤),葡萄糖20 g,补水至1 L,自然pH,配制固体培养基时加入琼脂粉20 g/L。
④LB 培养基:蛋白胨10 g/L,酵母膏5 g/L,NaCl 10 g/L;pH 7.0,121 ℃下灭菌20 min,配置固体培养基时加入琼脂粉20 g/L。抗性培养基中Amp的最终质量浓度是100 μg/mL。
1.2 试验方法
1)菌株筛选。采用Fiedure.K.J 显色法,称取10 g 采集的土样置于灭菌的装有100 mL生理盐水且带有适量玻璃珠的250 mL锥形瓶中,28 ℃,160 r/min振荡培养30 min。然后用无菌水稀释上清液至10-3、10-4、10-53个稀释度,分别用无菌枪头吸取100 μL 涂布于预先配制且灭菌的平板分离培养基,28 ℃培养3 d 后置于4 ℃冰箱中静置,观察蓝紫色颜色圈,选取较大颜色圈中的菌株接种于PDA 斜面培养基,28 ℃培养至长出成熟孢子,保存于4 ℃。将初筛得到的斜面培养的菌株接种于发酵培养基中,28 ℃、180 r/min摇床振荡培养5 d,取发酵上清液及菌体测酶活。
2)酶活力测定方法。
①葡萄糖氧化酶酶活的定义:在pH 5.6,温度为30 ℃的条件下,每分钟催化1 μmol葡萄糖转化为葡萄糖酸和过氧化氢所需的葡萄糖氧化酶的量定义为1个酶活力单位(U)。
②底物体系:吸取1 mL 5%葡萄糖溶液,2 mL 0.07 g/L 邻联茴香胺溶液,0.1 mL 60 U/mg 辣根过氧化物酶溶液于同一试管中,30 ℃恒温水浴10 min。
③酶活测定:吸取0.1 mL 稀释10 倍后的粗酶液于底物中摇匀,于波长460 nm 处每1 min 记录1次吸光度值(A460nm),共测定5 min,以A460nm对时间作图,计算最大斜率ΔA(min),根据下式计算酶活(X):
X=ΔA*f/(11.3*t*V1/V2)
式中:f为粗酶液稀释倍数;11.3 为消光系数;t为感应时间,min;V1为粗酶液体积,mL;V2为反应液总体积,mL。
3)基因组DNA的提取与目的基因的克隆。
①菌体的预处理:采用PDA 培养基平板活化待测菌株,于28 ℃培养至长出褐色孢子,之后接种于PDA 液体培养基,30 ℃、180 r/min 振荡培养2~3 d,过滤出菌体,-80 ℃冻存。
②基因组DNA 的提取与鉴定:取冻存的菌体,在液氮中研磨,称取0.2 g 研磨后的菌体,参照真菌DNA 抽提试剂盒提取待测菌株的基因组DNA,-20 ℃保存备用。采用真菌通用引物ITS1与ITS4 对5.8S rDNA-ITS 区序列进行PCR 扩增(94 ℃3 min,94 ℃30 s,55 ℃30 s,72 ℃2 min,运行35 个循环,72 ℃终延伸10 min),PCR 反应产物送至北京六合华大基因公司测序。
③目的基因的克隆:根据NCBI GenBank 上已公布的黑曲霉GOD 基因序列(登录号:MH593586.1),设计克隆GOD 基因所用的特异性引物F、R。以黑曲霉基因组DNA 为模板,F、R 为引物进行PCR 扩增(98 ℃10 s,55 ℃30 s,72 ℃2 min,运行30 个循环),PCR 产物经纯化回收后得到GOD 基因片段,连接pGEM-T Easy 载体,并转化E.coliDH5α,通过蓝白斑筛选,挑取白斑单菌落经菌落PCR 鉴定获得阳性克隆子,提取pGEM-T-GOD 质粒双酶切验证后送测序,保存测序正确的菌株。
4)重组表达质粒的构建。结合枯草芽孢杆菌密码子偏好性,对黑曲霉GOD编码序列进行密码子优化,优化后的氨基酸序列及核酸序列如下,在N端加上了34 个氨基酸信号肽(绿色部分),C 端加上了His-tag(红色部分)。在核酸序列两端添加NdeI(黄色序列)和HindⅢ(灰色序列)酶切位点,核酸序列全长1 902 bp,编码629 个氨基酸,蛋白分子量约68.44 ku,序列交由公司(南京金斯瑞)合成。
氨基酸序列:MFAKRFKTSLLPLFAGFLLLFHLVLAGPAAASAE-Protein-HHHHHH..
核酸序列 pGOD:CATATGTTTGCAAAACGATTCAAAACCTCTTTAC
TGCCGTTATTCGCTGGATTTTTATTGCTGTTTC ATTTGGTTCTGGCAGGACCGGCGGCTGCGAGTGCTGAA-DNAsequence-CACCACCATCATCATCATTAATGAAAGCTT
分别酶切目的片段GOD 和载体质粒pT7M,用胶回收试剂盒将片段GOD 的酶切产物和质粒pT7M的酶切产物回收纯化。在T4 DNA 连接酶的作用下构建重组质粒pT7M-GOD,转化E.coli DH5α,经Amp(氨苄青霉素)抗性平板筛选和双酶切鉴定,同时送至华大基因公司测序验证,保存测序正确的菌株。
5)枯草芽孢杆菌的转化及诱导表达。将鉴定正确的重组质粒pT7M-GOD通过化学转化的方式转入枯草芽孢杆菌7024E感受态中,在37 ℃、200 r/min摇床复苏培养60 min 后涂于含有12.5 μg/mL 四环素的LB琼脂平板上,37 ℃培养过夜。选取3株长势良好的单菌落,分别接种于含有12.5 μg/mL 四环素的4 mL LB 培养基中,分为3 组,37 ℃、200 r/min 振荡培养至OD600值达0.6~0.8 时,第1 组作为阴性对照,不添加诱导剂;第2组加入终浓度为2%木糖诱导表达,25 ℃诱导培养16 h;第3 组加入终浓度为2%木糖诱导表达,37 ℃诱导培养4 h。
6)目的基因的表达。收集培养物上清与菌体沉淀,在沉淀中加入裂解液(50 mmol/L Tris,150 mmol/L NaCl,5%甘油,pH 8.0),用超声波破碎仪破碎。分别取培养物上清,全细胞裂解液,破碎液上清与沉淀,加入5×loading buffer 混匀,煮沸10 min,通过SDSPAGE 检测粗蛋白的表达情况,通过制备单克隆抗体,利用Westen-blot检测目的基因的表达。
2 结果与分析
2.1 产酶菌株的筛选与鉴定
通过对采集的土样进行初筛和复筛,得到4 株产胞内GOD 酶活较高的菌株,测得酶活力如表2所示,由表2可以看出,菌株P-1 产酶性能较好,发酵5 d 后发酵液中GOD 酶活为2.820 U/mL,选定菌株P-1为出发菌株进行后续研究。
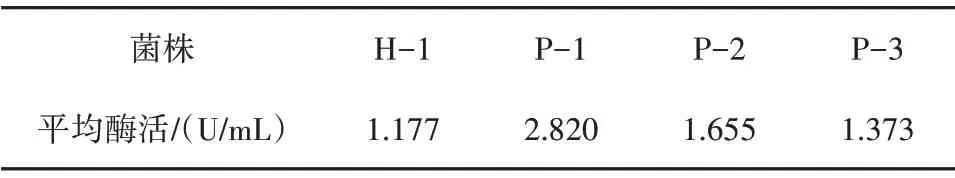
表2 分离菌株产GOD酶活测定结果
分析菌株P-1 的生长及形态特征,与曲霉鉴定手册中黑曲霉比较接近。利用真菌通用引物ITS1/ITS4,扩增菌株P-1 的ITS 区基因,PCR 产物经琼脂糖凝胶电泳,结果与理论编码序列大小相符,如图1所示。将测序得到的菌株P-1 IST 区基因序列在NCBI 中进行BLAST 分析,并构建系统发育树见图2。由图2可知,与GenBank 数据库中曲霉菌相关菌株的ITS 区基因序列的5.8S rDNA-ITS 区序列比较分析,发现其与曲霉属(Aspergillussp.)的黑曲霉菌(Aspergillus niger)亲缘关系最近。综合菌株的菌落形态、生长特性及5.8S rDNA-ITS 区序列系统进化分析,确定菌株P-1为黑曲霉。
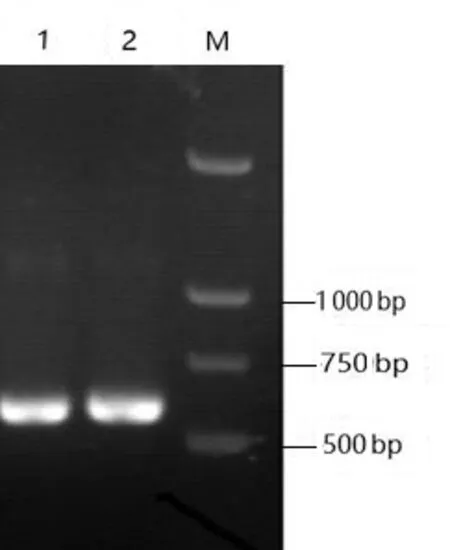
图1 菌株P-1的IST区基因PCR产物

图2 菌株P-1的5.8S rDNA ITS区序列系统发育树
2.2 目的基因的克隆与鉴定
以黑曲霉P-1基因组DNA为模板,利用引物F、R 进行PCR 扩增,扩增产物经琼脂糖凝胶电泳,结果如图3A。质粒pGEM-T-GOD 经酶切,结果如图3B。测序结果显示,目的基因片段全长1 818 bp,编码605 个氨基酸,将其序列与GenBank 中公布的GOD 基因序列进行比对,相似度为81%~99%,证明成功扩增了黑曲霉GOD基因,命名为pGOD。
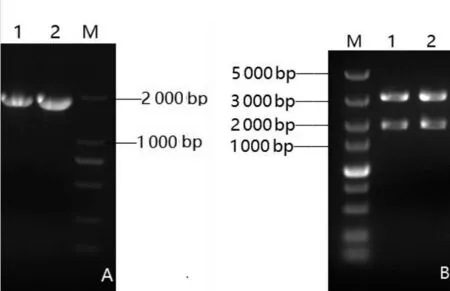
图3 pGOD基因的PCR 扩增(A)和pGEM-T-pGOD的酶切鉴定(B)
2.3 重组表达质粒的构建与鉴定
重组质粒pT7M-GOD 经双酶切验证,结果显示GOD 基因已经插入到表达载体pT7M 中(图4)。重组质粒的测序结果显示,目的基因序列与优化后pGOD 的序列完全一致,重组表达载体pT7M-pGOD构建正确。

图4 pT7M-GOD的双酶切鉴定
2.4 目的基因的表达
将鉴定正确的重组质粒pT7M-pGOD 转入枯草芽孢杆菌7024E 感受态中,经2%木糖诱导发酵培养后的SDS-PAGE 分析结果见图5。结果显示,1,2泳道和7,8泳道可见约68 ku大小的条带,与理论上pGOD蛋白的分子质量大小一致。且2、8泳道明显比1、7泳道的表达量高。结果表明,pGOD 基因能够在枯草芽孢杆菌中表达,且在37 ℃培养4 h 表达量较高。

图5 pGOD蛋白表达产物的SDS-PAGE
制备单克隆抗体,利用Westen-blot对表达的粗蛋白进行检测,结果如图6所示,在样品3、4、5、6 中出现明显的目的基因产物。大小与预期pGOD蛋白分子质量一致,说明该表达系统成功表达了pGOD基因,属于胞内表达的可溶性蛋白。

图6 表达产物Western-blot检验
3 讨 论
GOD 作为一种新型的酶制剂,近年来在养殖行业应用广泛,GOD 可以改善动物肠道环境,增强肠道有益菌群,降低霉菌毒素中毒损伤,提高内源酶活,提高饲料消化率。大量的文献报道表明产GOD的菌种主要是曲霉属(Aspergillus)和青霉属(Penicillium)[14-16],本研究从土壤样品中筛选到产GOD 的微生物,经鉴定为黑曲霉,也验证了这一结论,说明霉菌是产GOD的主要微生物菌种。
但天然菌株发酵生产GOD 的酶活性低,且纯化工艺复杂。因此,构建高效表达GOD的重组菌株成为主要研究方向。近十几年来,多种来源的GOD基因被克隆[17-18],本研究所扩增的GOD 基因片段全长1 818 bp,编码605 个氨基酸,将其序列与GenBank中公布的GOD 基因序列进行比对,相似度为81%~99%,部分位点的碱基出现差异,其主要原因是不同物种的编码基因有差异。所克隆的GOD 基因在大肠杆菌(Escherichia coli)、里氏木霉(Trichoderma reesei)、酿酒酵母(Saccharomyces cerevisiae)和毕赤酵母(P. pastoris)等宿主中成功表达[19-22],并且酶活性得到显著提高。如陈楠等[23]利用具有AOX1 强启动子的表达载体pPICZαA,在毕赤酵母SMD1168 中成功表达了黑曲霉PCTC GOD 基因,并对重组菌进行产酶条件优化,优化后酶活达32 U/mL,提高了27倍。然而在动物益生菌枯草芽孢杆菌中表达GOD基因的未见报道,B. subtilis属于动物益生菌,发酵条件简单,目前已有很多的研究报道使用B.subtilis作为高效生产的工程菌株[24-25]。加之为了更好地服务于养殖和饲料,本研究将GOD基因在野生型枯草芽孢杆菌中进行了表达,成功获得了表达产物。但由于是异源表达,需对目的基因的密码子进行优化[26-27],通过密码子优化构建表达载体pT7M-pGOD,使枯草芽孢杆菌成功地表达了来源于黑曲霉的GOD基因,为构建高效表达GOD的基因工程菌提供了新的思路。
4 结 论
从土壤样品中筛选出1 株高产葡萄糖氧化酶(GOD)的黑曲霉菌株,将黑曲霉菌的GOD基因克隆到载体pT7M,重组质粒pT7M-pGOD 转化到枯草芽孢杆菌中异源表达,获得了产GOD的枯草芽孢杆菌工程菌株。
——一道江苏高考题的奥秘解读和拓展

