不同改性方法对花生蛋白理化特性影响研究
李 响 张焕丽 郭世 陈 岚 闵钟熳 肖志刚
(沈阳师范大学粮食学院1,沈阳 110034)(华南理工大学食品科学与工程学院2,广州 510641)
花生是我国重要的粮食作物,种植范围广、产量高,富含脂肪、蛋白质等多种营养物质,是全球第三位的植物蛋白质来源[1]。随着我国经济水平的发展和生活质量的提高,花生类产品的需求量也逐步上升[2]。由于花生中各类营养素比较全面且营养价值均衡,因此被认为是理想的高蛋白、高脂肪优质健康食品[3]。与其他植物源蛋白相比,花生蛋白具有较高的消化性,其有效利用率高达98%,易于人体的消化吸收[4],其中赖氨酸有效利用率达到98.8%,而大豆蛋白中的有效利用率仅为78%[5],比大豆的高出20%。研究表明,花生中含有的抗营养因子要明显少于大豆,因此,花生可替代蛋白基料和牛乳等动物奶类为乳糖不耐症人群提供适宜的高蛋白食品[6]。
目前,许多专家学者开始对花生蛋白特性进行研究,为了进一步改善花生蛋白的特性,可对花生蛋白进行改性处理,常用的改性方法有物理法、化学法和酶法等,现有改性方法中也会采用复合法对花生蛋白进行改性处理。He等[7]研究了高压对花生分离蛋白的理化特性的影响,高压处理后发现,花生分离蛋白的持水力、持油率以及油结合能力均显著改善。熊柳[8]对花生分离蛋白进行磷酸化改性,改性后花生分离蛋白的功能特性(如吸油性、吸水性、乳化性、持水性、乳化稳定性、泡沫稳定性)均不同程度的提高。张兆丽研究通过酶法处理花生分离蛋白,得出碱性蛋白酶改性的最佳条件,改性后,花生分离蛋白的吸水性、乳化性均得到显著改善。Dong等[9]将高压均质联合酶处理技术对花生蛋白进行复合改性,提高了花生蛋白的酶解程度,产物中的小分子肽含量明显增多。现有研究结果表明,单一改性方法对花生蛋白改性的效率不高[10],鲜有复合法对花生蛋白进行改性的研究。挤压膨化改性法利用高温、高压和高剪切作用,可显著破坏花生蛋白结构,暴露更多的酶切位点[11,12],反应效率高,对花生蛋白影响较显著。酶法改性因其条件温和,专一性较高,是对花生蛋白改性有效方法之一。复合改性具有改性效果好、成本低等优点, 因此, 在实际生产中的应用越来越广泛。
本实验采用挤压、酶法和挤压协同酶解3种方法对花生蛋白进行改性处理,通过溶解性、乳化性、乳化稳定性、起泡性等方法对花生蛋白的功能特性进行分析,采用傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FT-IR)、圆二色谱(circular dichroism,CD)和聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,SDS-PAGE)、蛋白质水解度等现代分析手段,研究花生蛋白结构、分子质量等的变化,进一步探讨3种改性方法花生蛋白理化性质的影响,结合蛋白空间结构模型,以期为开发花生蛋白适宜营养产品,提高花生蛋白类食品的附加价值提供参考。
1 材料与方法
1.1 材料与试剂
花生蛋白(PPI)、牛血清蛋白、碱性蛋白酶、十二烷基硫酸钠(SDS)、丙烯酰胺(Acr)、三羟甲基氨基甲烷(Tris)、甘氨酸、过硫酸铵、四甲基乙二胺(TEMED)、考马斯亮蓝R-250、溴酚蓝、二硫苏糖醇(DTT)、蛋白样标准品(电泳纯)、冰乙酸、甲醇、β-巯基乙醇、磷酸二氢钠。
1.2 仪器与设备
DWF-100电动粉碎机,HH-4Nicolet Nexus 470傅里叶红外光谱仪,Scientz-12 N冷冻干燥机,SDS-PAGE电泳仪,DS56-Ⅲ双螺杆挤压膨化机,DELTA 320 pH计,UV-1200S紫外可见光分光光度计,J-1100圆二色谱仪。
1.3 方法
1.3.1 花生蛋白的改性
挤压膨化:以溶解性为指标, 花生蛋白挤压改性的工艺参数经过前期优化实验确定,准确称取3.0 kg纯度为92%的PPI,调整原料含水量至25%,机筒温度为100 ℃,螺杆转速为300 r/min,喂料速度10 kg/h。蛋白挤出物经真空冷冻干燥后,粉碎过100目筛,放入自封袋中备用。
酶法:以溶解性为指标, 花生蛋白酶解改性的工艺参数经过前期优化实验确定为采用碱性蛋白酶对未处理的PPI进行酶解。酶解条件为:温度60 ℃、pH 8.0、底物蛋白质量浓度8%、酶活216735 U/g、酶活与底物蛋白比例为100 U/g、酶解时间60 min。将酶解处理后的样品经真空冷冻干燥后放入自封袋中,备用。
挤压协同酶法:准确称取3.0 kg挤压预处理的PPI,利用碱性蛋白酶进行酶解,挤压和酶解条件分别同酶法。处理后的样品经真空冷冻干燥后放入自封袋中,备用。
1.3.2 蛋白质水解度测定(DH)
采用OPA发法对花生蛋白水解度进行测定,用紫外分光光度计测量酶底物的DH,以精氨酸作为标准品,绘制标准曲线[13]。计算公式见式(1)。
h=(ht-hc)×DF
(1)
式中:ht为样品的浓度;hc为对照品(未水解样品)的浓度;htot为7.8 mmol/g;DF为样品的稀释倍数。
1.3.3 蛋白质溶解性的测定
参考Shimada等[14]的方法,将处理前后的花生蛋白样品溶于超纯水中,用1 mol/L的HCl和NaOH来调节pH,使其pH处于7,在水浴锅中搅拌1 h(室温),搅拌均匀后于室温下离心30 min(10 000 r/min),取上清液,采用Bradford法测定上清液中蛋白含量[15],用凯氏定氮法测定样品中总蛋白含量,根据上清液中的蛋白占样品总蛋白含量的百分比计算溶解度,并以氮溶解指数表示(NSI%),见式(2)。
(2)
1.3.4 蛋白质乳化性及乳化稳定性的测定
采用浊度法[16],并稍加改动:将不同处理的样品(花生分离蛋白作对照)溶于0.1 mol/L的磷酸盐缓冲溶液(pH 7.0)中,配成 0.1%质量浓度的样品溶液。将8 mL大豆油加入30 mL样品溶液中,然后用高速匀质机在室温条件下均质2 min(13 500r/min)。分别在均质结束后和静置10 min后立即从底部吸取100 μL的样品,然后用10 mL 0.1%的 SDS(m)进行稀释,测定3次500 nm处吸光度值,分别记为A0和A10,乳化活性指数(Emulsification Activity Index,EAI)按式(3)计算。
(3)
式中:EAI为乳化活性指数/m2/g;N为稀释倍数;φ为体系中油相占比;C为蛋白质量浓度/g/mL;L为比色池光径/1 cm。
乳化稳定性(Emulsification Stability Index,ESI)按式(4)计算。
(4)
式中:ESI为乳化稳定性指数/min;A0为0 min时的吸光度值;ΔT为测定乳化性的两次时间间隔,本实验取10 min;A10为10 min时的吸光度值。
1.3.5 蛋白质起泡性及泡沫稳定性的测定
参考Sathe等[17]的实验方法并稍加修改,首先配制100 mL花生分离蛋白样品溶液(1%,pH 7.0),置于500 mL量筒中,然后于室温条件下用高速匀质机在17 500 r/min条件下连续均质3次,每次40 s。起泡能力(Foaming Capacity)和泡沫稳定性(Foaming Stability)分别按式(5)和式(6)计算。
(5)
(6)
式中:FC为起泡能力/%;FS为泡沫稳定性/%;V0为均质后的液面高度;V30为静置30 min后再次记录液面高度。
1.3.6 傅里叶变换红外光谱法(FT-IR)
将样品与溴化钾混合,置于研钵中研细混合均匀,采用压片法制样,将其置于红外光谱分析仪进行测试,扫描波数范围为 4 000~400 cm-1,分辨率为4 cm-1。
1.3.7 圆二色光谱(CD)
准确称取0.2 mg/mL蛋白质溶液,将其置于190~250 nm波长范围内,以100 nm/min的速率扫描,室温下带宽为1 nm,路径长度为0.1 cm。使用磷酸钠缓冲液(10 mol/L,pH 7.0)校正基线。并用Jasco二级结构软件计算不同二级结构的含量。
1.3.8 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)
参考Backman等[18]方法并稍作修改。将样品溶于1 mL的超纯水中,取40 μL Laemmli缓冲液(0.1 mol/L Tris-HCL,pH 6.8,10%十二烷基硫酸钠,20%甘油,溴酚蓝),向混合好溶液中加入50 μL DTT,在沸水浴中加热5 min。冷却至室温后,进样后将凝胶置于恒定电流下电泳,在5%质量浓度的浓缩胶中电泳20 min,在12%质量浓度的分离胶中电泳40 min,待条带跑至凝胶底端时,结束电泳,凝胶用甲醇溶液固定30 min,染色40 min,用冰醋酸溶液浸泡3~4次后,直到蛋白条带清晰,将脱色后的凝胶置于凝胶成像系统中进行成像处理。
1.3.9 巯基(-SH)和二硫键(-S-S-)含量的测定。
根据Song等[19]的方法并稍作修改。将4 mg 5,5′-二硫双歧杆菌(2-硝基苯甲酸)(DTNB)试剂溶于1 mL三甘氨酸缓冲液(pH 8.0)中制备Ellman试剂。分别称取75 mg不同改性条件下的花生蛋白样品快速溶于1.0 mL三甘氨酸缓冲液中,然后加入50 μL Ellman试剂,在涡旋振荡器中振荡混匀后在水浴锅中25 ℃保温15 min,用紫外可见分光光度计在412 nm处测定上清液的吸光度,用试剂缓冲液作空白对照。用摩尔消光系数13 600除以吸光度值,得到巯基含量,表示为μmol/g蛋白质。SH含量计算见式(7)。
(7)
式中:A412是样品在412 nm处的吸光度;C为样品质量浓度/mg/mL。
参考Benjaknl等[20]的方法并稍作改动,分别称取一定量的不同处理条件下的花生蛋白溶解于0.6 mol/L,pH 7.5的KCl缓冲溶液中,将其稀释至100 mg/mL,室温下以4 000 r/min离心20 min,取0.5 mL上清液,加入3.0 mol/L,pH 9.5的NTSB检测液,混合均匀后在室温条件下置于暗处25 min,利用分光光度计于412 nm处测定其吸光值,二硫键含量以mol/106 g蛋白质计。其中摩尔消光系数(ε)为13 900/L/(mol·cm),二硫键含量按式(8)计算。
(8)
式中:C为二硫键浓度;A412为412 nm处的吸光值;D为稀释倍数。
1.3.10 蛋白质表面疏水性(H0)的测定
采用Shi等[21]方法并稍作修改。称取一定量的不同改性条件下的花生蛋白,并溶解于0.1 mol/L、pH 7.0的磷酸盐缓冲液中,在20 ℃处理2 min后,将混合物在10 000 r/min离心20 min,离心结束后立即取上清液,并测定上清液的浓度,测定浓度后用磷酸盐缓冲液稀释,质量浓度稀释范围为0.05~0.4mg/mL,然后将20 μL的1-苯胺基-8-苯磺酸(ANS)添加到4 mL不同改性处理的蛋白质样品溶液中。测试条件为:激发波长390 nm,发射波长470 nm,扫描速度为10 nm/min。荧光强度与蛋白质浓度曲线的初始斜率作为H0的指标。
1.3.11 统计分析
每组实验做3次平行,数据分析采用SPSS20.0统计软件,采用Duncan对数据进行显著性分析(P<0.05),利用Origin 9.5软件作图。
2 结果与分析
2.1 溶解性
图1为原花生蛋白(PPI)和挤压膨化法处理后花生蛋白(EPPI)、酶解法处理后花生蛋白(EHPPI)、挤压协同酶解法改性花生蛋白(EEPPI)在处理条件下的溶解性。由图1可知,EPPI的溶解性明显低于PPI,EHPPI和EEPPI溶解性显著高于PPI。EPPI溶解性降低的原因可能是花生蛋白在挤压机筒内受到高温高压、高剪切力作用,其分子结构发生改变,蛋白分子结构展开,部分疏水基团暴露,促进花生蛋白分子之间相互作用形成大量不溶大分子聚集体,表现出低于原花生蛋白的溶解性[22]。EHPPI溶解性高于PPI的原因可能是原花生蛋白具有致密的分子结构[23],而酶解过程促使花生蛋白分子的巯基断裂,分子质量降低,肽链舒展,暴露出更多的亲水性基团,不溶性的聚集体含量降低[24]。同时,围绕着新暴露的极性基团的结合水逐渐增多,引起蛋白质的水化作用增强,从而表现出高于原花生蛋白的溶解性。从而使得溶解性增加。EEPPI在挤压过程中蛋白由于分子热运动破坏了束缚力,致其分子展开,二硫键受到破坏,原本包裹有序的状态发生改变,特别是抗酶解的蛋白质组分,显著增加了蛋白酶对蛋白的亲和性,溶解性高于EPPI和EHPPI,综合分析,挤压协同酶解法效果优于单一改性方法[25]。

注:PPI、EPPI、EHPPI、EEPPI分别为花生蛋白、挤压膨化法处理后花生蛋白、酶解法处理后花生蛋白、挤压协同酶解法处理后花生蛋白。图1 不同处理条件下花生蛋白的溶解性
2.2 蛋白质乳化性及乳化稳定性
图2为不同处理方式对花生蛋白乳化性和乳化稳定性的影响。由图2可知,与未处理花生蛋白相比,三种处理方式花生蛋白的乳化性和乳化稳定性均得到显著提高。挤压处理方式提高的原因是因为挤压膨化处理给予蛋白质短时间的高温、高压和高剪切作用,部分蛋白变性并发生分子结构的变化,改变蛋白质表面疏水性和亲水性基团的分布位点,分子内部亲油性疏水基团暴露,从而提高蛋白的乳化能力。通过比较不同处理的改性效果,EHPPI的乳化性和乳化稳定性最高,是因为经碱性蛋白酶水解后,花生蛋白分解成更多小分子肽段,分子内部、外部及疏水基团暴露,界面性质发生变化,溶解性增强[26],从而改善蛋白质的乳化性。同时,蛋白羧基上带有相同电荷的液滴,相互之间存在静电排斥作用,乳液液滴间不易于絮凝和凝聚,提高了蛋白的乳化稳定性。EEPPI低于酶解的原因是因为挤压协同酶解处理后蛋白的水解度较大,其分子被水解为更小分子质量的短肽,维持花生分离蛋白分子空间结构的作用力和化学键(包括范德华力、氢键、离子键等)被破坏程度较大,阻碍了油水界面上起到保护作用界面膜的形成,导致油滴表面的保护层变薄,小油滴逐渐聚集成大颗粒[27],从而引起乳化性和乳化稳定性降低。

图2 不同处理条件下花生蛋白的乳化性和乳化稳定性
2.3 蛋白质起泡性及泡沫稳定性
图3为不同处理方式对花生蛋白起泡性及泡沫稳定性的影响。由图3可知,与原花生蛋白相比,挤压处理显著提高花生分离蛋白的起泡性和泡沫稳定性,酶解和挤压协同酶解处理只起到提高起泡性的效果,反而导致泡沫稳定性变差。挤压处理的花生蛋白起泡性及泡沫稳定性提高的原因可能是经挤压作用,破坏了蛋白分子结构,蛋白疏水性增强,从而快速吸附至气—液界面,界面上的蛋白质-蛋白质相互作用,形成粘稠状的膜,同时界面和吸附分子之间也缺乏推斥力,被吸附至界面的蛋白质的数量增加,吸附在气-水界面上的蛋白质膜的厚度和硬度的增加,疏水基团的暴露,多肽链的交联,界面膜层的黏度提高,增加泡沫的稳定性[28]。酶解及挤压协同酶解处理方式提高起泡性,降低泡沫稳定性的原因可能是由于花生蛋白经酶解后蛋白质分子间的肽链展开,疏水基团的暴露,并增加了多肽分子的界面活性,增加了界面的亲和力和吸附率[29]提高了发泡的能力。由于酶解后蛋白质的黏度会变小,液膜会变得很脆弱无法裹住气泡,使得泡沫稳定性变差。经挤压处理后脱敏的花生蛋白其水解度较大,溶解性较好,起泡能力比单独酶解处理效果强,黏度的变小,泡沫稳定性会较差。

图3 不同处理条件下花生蛋白的起泡性和泡沫稳定性
2.4 傅里叶变换红外光谱分析(FT-IR)
图4为不同处理方式花生蛋白的红外光谱图。与PPI相比,EPPI、EHPPI和EEPPI酰胺Ⅰ谱带的强度和波数均有明显变化,酰胺Ⅰ谱带振动频率取决于羰基和氨基之间的氢键性质[30],可以反映多肽或蛋白质特定二级结构的变化。经挤压膨化法、酶法和挤压协同酶法3种方法处理后,花生蛋白在1 621 cm-1处吸收峰强度均有不同程度的增强,表明其β-折叠含量有所增加[31]。1 652 cm-1峰宽明显减小,表明α-螺旋含量有所减少。挤压膨化法、酶法和挤压协同酶法处理均会影响花生蛋白的二级结构变化。挤压改性导致PPI的反褶积酰胺I带峰红移(约1 cm-1),这表明经挤压处理后花生蛋白分子链展开,EHPPI和EEPPI的红移增加(约2 cm-1),这说明酶法和挤压协同酶法处理有助于花生蛋白分子链的展开。
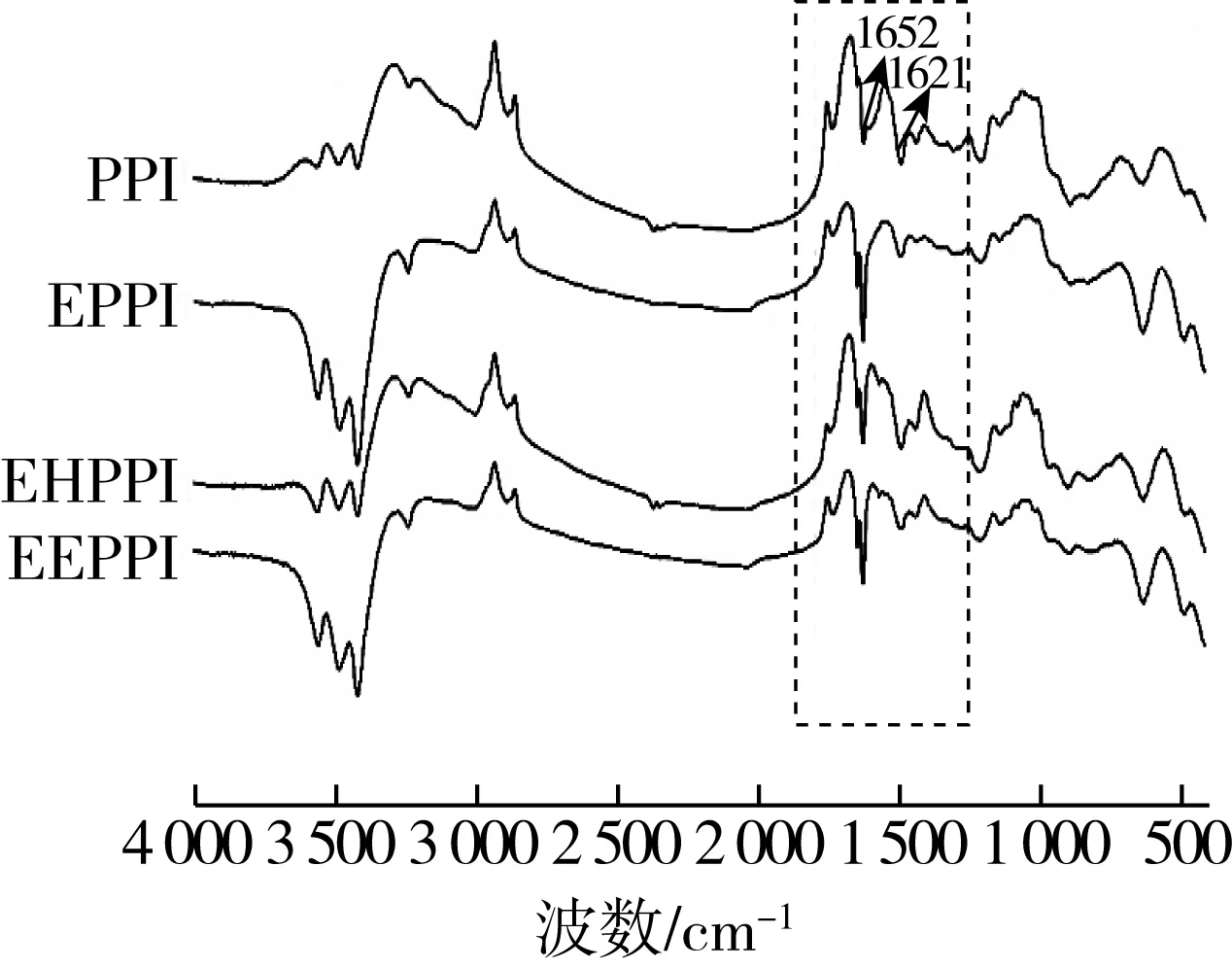
图4 不同改性方法下花生蛋白的红外图谱
2.5 圆二色谱分析 (CD)
表1为花生蛋白二级结构的变化。从表1可以看出,花生蛋白经3种方法改性后,α-螺旋和β-转角相对含量降低,β-折叠和无规卷曲含量升高。经挤压膨化法处理后α-螺旋和β-转角相对含量分别降低3.00%和2.20%,β-折叠和无规卷曲相对含量分别升高了4.10%和1.10%。酶解处理后α-螺旋和β-转角相对含量分别降低了3.30%和3.10%,β-折叠和无规卷曲相对含量分别升高了4.60%和1.80%。挤压协同酶法处理后蛋白质二级结构变化最明显,α-螺旋和β-转角含量分别降低7.30%和6.10%,β-折叠和无规卷曲含量分别升高了6.60%和6.80%。挤压处理引起花生蛋白二级结构相对含量变化的原因可能是因为挤压过程中产生的高温、高剪切力破坏了蛋白质二级结构的有序性,导致部分蛋白分子变性重新聚集。酶法处理引起花生蛋白二级结构相对含量变化的原因可能是花生蛋白经酶解处理后其花生蛋白分子链受到破坏,肽链或花生蛋白的二级结构展开,暴露出大量分子内氢键,形成了肽链间的氢键,导致α-螺旋含量减少,β-折叠和无规则卷曲含量增加。挤压协同酶解处理导致花生蛋白二级结构含量相对含量变化最明显的原因可能是,挤压预处理破坏了蛋白质的二硫键,分子打开,增加了花生蛋白与酶作用的机会,有利于花生蛋白的水解。
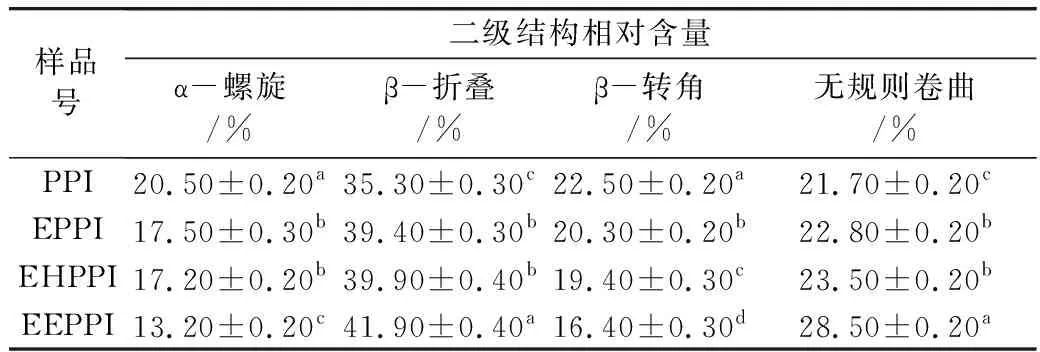
表1 不同处理方式下花生蛋白二级结构的相对含量及水解度
2.6 巯基(-SH)和二硫键(-S-S-)含量分析
图5为不同处理方式对花生蛋白巯基和二硫键含量的影响。如图2所示,与PPI相比,EPPI、EHPPI和EEPPI巯基含量均有所增加,而二硫键含量明显降低。EPPI、EHPPI和EEPPI的巯基分别增加了10.77%、16.27%、50.47%,二硫键含量分别减少了33.01%、55.28%、87.33%。这表明挤压和酶解反应对花生分离蛋白游离巯基和二硫键含量都有显著的影响。挤压和酶解处理导致巯基含量增加的原因可能是由于蛋白质分子的高级结构增到破坏,降解,肽链伸展,二硫键部分断裂,包裹在花生蛋白内部的巯基基团外露,巯基含量增多,二硫键含量减少,这与Anderson等[32]研究结果一致。
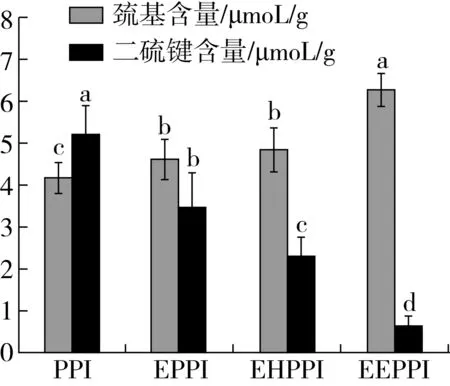
注:不同字母表示差异显著(P<0.05),图6同。图5 不同处理方式下花生蛋白中巯基含量和二硫键含量
2.7 表面疏水性(H0)
图6为不同处理方式对花生蛋白表面疏水性的影响规律。从图6可以看出,PPI的表面疏水性为149.00,EPPI、EHPPI和EEPPI的表面疏水性分别为200.12、225.89、251.42,呈现逐渐升高的趋势。表面疏水性的变化与蛋白质变性和热聚集体的形成有关,说明3种处理方法改变了花生蛋白的三级结构。挤压处理破坏了蛋白的二硫键,分子结构展开,改变了花生蛋白分子的空间结构。酶解处理下破坏了蛋白质的相互作用,诱导蛋白分子解折叠展开更明显,花生蛋白被逐渐酶解为小片段多肽,包埋于蛋白质分子内部的疏水性氨基酸趋于“暴露态”,从而导致蛋白质表面疏水性增加[33]。挤压后增加了无规则卷曲含量,此时更有利于酶解进行,使得包埋于球蛋白分子内部的疏水基团外露, ANS荧光探针结合位点增加,所以挤压协同酶法改性能够促使花生蛋白分子结构得到充分的伸展,H0达到最大值[34]。挤压协同酶解处理改变蛋白质高级结构,暴露更多的酶作用位点,蛋白质表面疏水性与游离巯基含量呈线性正相关,这与臧学丽等[35]研究结果一致。
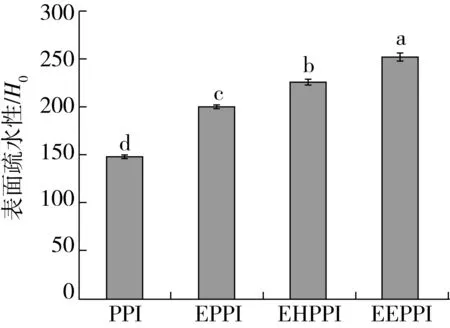
图6 不同处理方式对花生蛋白的表面疏水性影响
2.8 花生蛋白水解程度及十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分析(SDS-PAGE)
不同处理方式下花生蛋白SDS-PAGE的影响如图7所示。各个处理组在EPPI凝胶电泳图上没有看到明显的条带变化,EHPPI和EEPPI凝胶电泳图上有明显的条带变化,这表明在挤压膨化处理方式可以改变花生蛋白的二、三、四级结构,而一级结构不受温度和机械力影响。酶解后的花生蛋白泳道中分子质量为17~20、36、38、43、64 ku均有不同程度变浅,在14.4 ku处有弥散性条带存在,说明碱性蛋白酶已经能够将花生蛋白水解至14.4 ku以下的小分子蛋白质片段。挤压膨化协同酶解处理后碱性蛋白酶花生蛋白泳道中分子质量为64、43、38、36 ku条带彻底消失,17~20 ku条带明显变浅,在14.4 ku处也有弥散性条带存在,这可能是挤压膨化处理使二、三、四级紧密结构展开[36],暴露更多的酶解位点,使酶分子更容易进入蛋白质内部,促进了碱性蛋白酶的水解,小分子蛋白片段增多。从14.4 ku处条带深浅来看,酶解和挤压协同酶解处理小分子蛋白片段并没有明显的区别,说明SDS-PAGE图不能判断挤压协同酶解处理花生蛋白是否能得到更低分子质量的蛋白片段[37]。

图7 不同处理方式下花生蛋白的凝胶电泳图
3 结论
实验选择对花生蛋白的理化性质进行了研究。研究结果表明,挤压、酶解、挤压协同酶法3种改性方式均为有效的花生蛋白改性手段,综合对比下挤压协同酶解法对花生蛋白理化性质影响更为明显。对3种改性花生蛋白的功能特性进行分析,其溶解性、乳化性以及起泡性均有所提高,通过红外光谱、电泳及圆二色谱结果分析发现,蛋白质二级结构被破坏,平均分子质量降低,α-螺旋结构比例大幅下降、β-折叠和自由卷曲结构比例的提升,巯基含量增加,二硫键含量降低,表面疏水性指数增大。挤压协同酶法改性花生蛋白,对实际生产中产品的质量必然起到积极作用,可提高花生蛋白产品的附加价值,增加其产品的应用范围。

