弓形虫MIC11基因敲除株的构建及鉴定
千慧燕,王浩,杨冰祎,闵鹏飞,张爽,贾立军*
(1. 东北寒区肉牛科技创新教育部工程研究中心/延边大学,吉林 延吉 133002;2. 延边大学农学院,吉林 延吉 133002)
弓形虫(Toxoplasmagondii) 属于真球虫目弓形虫科,是一种专性细胞寄生原虫[1]。在世界范围内流行,具有广泛的宿主群,哺乳动物、鸟类、人都是它的中间宿主[2-4]。弓形虫病是人兽共患寄生虫病,严重威胁人类健康,并能引起家畜死亡,造成严重经济损失[5-8]。弓形虫入侵宿主的过程是由多种分泌蛋白介导完成,这些分泌蛋白主要来自弓形虫顶端复合体微线体蛋白(MICs)、棒状体蛋白(ROPs)和致密颗粒蛋白(GRAs)等分泌型细胞器[9-11]。
MICs在弓形虫识别、附着和入侵宿主细胞过程中起重要作用[12]。在虫体与宿主细胞接触早期,MICs最先从速殖子顶端分泌,通过识别宿主细胞膜上的受体进行黏附;随之ROPs分泌到宿主细胞膜的棒状体颈部蛋白RONs与MICs的顶膜抗原AMA1形成移动连接[13-14]。MIC11位于微线体前端,属于钙离子依赖性蛋白,具有在成熟之前移除内部前肽的特性[15-16],其表达具有部分限制性,在速殖子和子孢子期有表达,缓殖子期不表达[17]。MIC11水解部位在其肽链中间,而其他微线体蛋白水解部位在其C-末端或N-末端[18]。目前关于弓形虫MIC11基因的研究报道较少,本试验利用CRISPR/Cas9技术对MIC11基因进行敲除,并通过乙胺嘧啶、绿色荧光蛋白(GFP)标记及PCR等方法筛选MIC11基因敲除株,以期为弓形虫MIC11基因的后续研究奠定基础。
1 材料与方法
1.1 虫体与实验动物
弓形虫RH株、Vero细胞均由延边大学预防兽医实验室保存,清洁级BALB/c小鼠购自延边大学实验动物中心,6~8周龄30只。
1.2 主要试剂
DMEM细胞培养液购自Gibico公司,胎牛血清(FBS)购自浙江天杭生物科技公司,双抗(青链霉素混合液)、胰蛋白酶-EDTA消化液、PBS和二甲基亚砜(DMSO)均购自北京索莱宝科技有限公司;细胞基因组DNA提取试剂盒、组织基因组DNA提取试剂盒购自南京诺唯赞生物科技有限公司;同源重组试剂盒、限制性内切酶等购自OMEGA公司;乙胺嘧啶购自上海麦克林生化科技有限公司;SV40-载体由日本带广畜产大学原虫病研究中心惠赠。
1.3 细胞和虫体培养
用含10%热灭活胎牛血清、1%双抗的DMEM完全培养液在37℃、5% CO2培养箱中培养Vero细胞。2 d更换1次培养液。弓形虫RH虫株接种到已长满的Vero细胞培养瓶中,培养条件与Vero细胞相同。
1.4 弓形虫MIC11敲除株的构建与筛选
参照谢素珠等[19]方法进行弓形虫MIC11基因敲除株的构建,通过E-CRISP软件确定弓形虫RH株MIC11基因(TGGT1_204530)的靶向gRNA序列,设计gRNA引物,采用重叠PCR和同源重组试剂盒将gRNA连接至SV40载体,构建重组质粒SV40-MIC11。使用质粒电转试剂盒进行转染,将电转后弓形虫接种于Vero细胞中,培养8 h后加入1 μm乙胺嘧啶继续培养,24 h后在荧光显微镜下观察,当培养瓶中有大量的游离虫体时,将速殖子重悬于PBS中,纯化后计数板计数,采用终点稀释法在96孔板中进行筛选,96孔板细胞长满后,每孔加入100 μL含1 μm乙胺嘧啶的培养液,第1排每孔接种4个速殖子,混匀后吸取50 μL接种至第2排各对应孔,余下各排依次倍比稀释至最后一排每孔0.5个速殖子,荧光显微镜下观察最后两排虫体荧光情况,标记单个虫体荧光孔进行扩大培养,即为筛选的单克隆虫株,暂命名为KO-MIC11株。
1.5 弓形虫KO-MIC11株的鉴定
根据弓形虫B1基因(ToxoDB:AF179871)和MIC11基因(ToxoDB:TGGT1_204530),以及载体中GFP基因设计引物,提取增殖后的单克隆KO-MIC11敲除株DNA和RH株DNA进行PCR鉴定[20],引物序列见表1。

表1 KO-MIC11敲除株鉴定引物
1.6 弓形虫MIC11基因敲除株小鼠体内PCR鉴定
将BALB/c小鼠随机分为3组,每组10只,试验组小鼠每只腹腔注射KO-MIC11敲除株1 000个,其他两组对照组小鼠分别注射RH虫株1 000个及生理盐水0.1 mL,每天观察小鼠的临床症状。5 d后处死小鼠,提取其心、肝、脾、肺、肾、脑、生殖器官及血液的DNA。应用B1基因引物和GFP基因引物对提取的DNA进行PCR鉴定。
2 结果
2.1 弓形虫MIC11基因敲除株筛选
弓形虫敲除MIC11基因后,经过乙胺嘧啶药物和终点稀释法筛选,筛选出的单克隆虫株在荧光显微镜下观察到绿色荧光(见图1)。

A.单克隆敲除株纳虫空泡;B.单克隆敲除株速殖子
2.2 KO-MIC11株体外不同基因的PCR鉴定
经PCR检测KO-MIC11株和RH株均扩增出B1基因的193 bp条带;MIC11基因引物在RH株中扩增出274 bp条带,而在KO-MIC11株中未扩增出该条带(见图2);GFP基因引物在KO-MIC11株中扩增出609 bp条带,而在RH株未扩增出该条带(见图3)。

M. DL2000 Marker;1~2. KO-MIC11株B1基因引物扩增;3~4. RH株B1基因引物扩增;5. 水对照;6. 空泳道;7~8. KO-MIC11株MIC11引物扩增;9~10. RH株MIC11引物扩增;11. 阴性对照
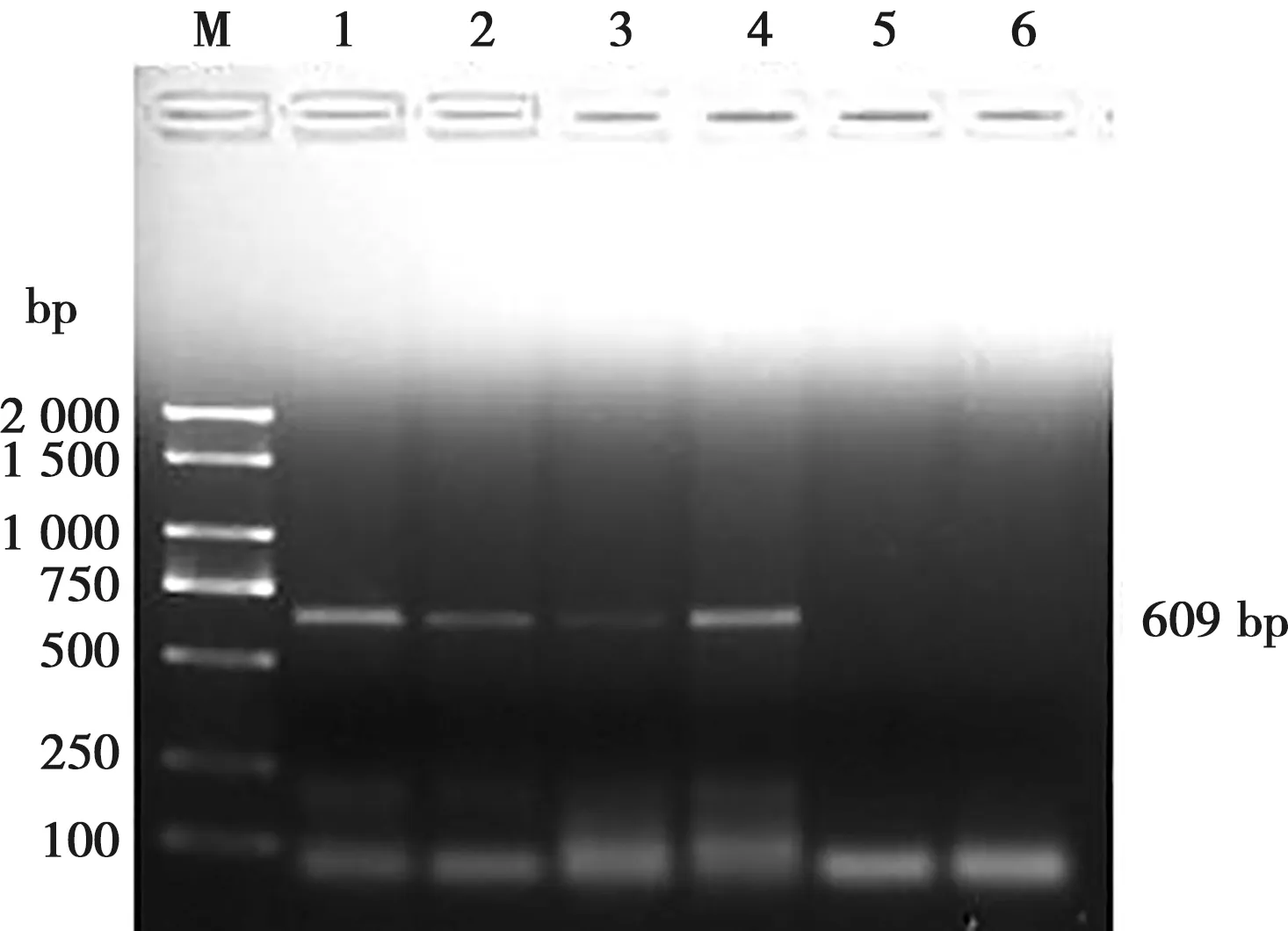
M. DL2000 Marker;1~4. KO-MIC株;5. RH株;6. 阴性对照
2.3 KO-MIC11株小鼠体内PCR鉴定
以提取的KO-MIC11株接种小鼠心、肝、脾、肺、肾、脑和血液等基因组DNA为模板,RH株基因组DNA为对照组,分别以B1基因引物和GFP基因引物进行扩增,小鼠体内除血液中未扩增出虫体基因外,其他组织中均扩增出目的基因。KO-MIC11株和RH株均扩增出了B1基因193 bp条带(图4);接种KO-MIC11株小鼠扩增出了GFP基因609 bp条带,而接种RH株小鼠未扩增出该基因片段带(图5)。

M. DL2000 Marker;1~8. 心、肝、脾、肺、肾、脑、生殖器官、血液;9. KO-MIC11株;10. 阴性对照

M. DL2000 Marker;1~8. 心、肝、脾、肺、肾、脑、生殖器官、血液;9. RH株;10. KO-MIC11株;11.阴性对照
3 讨论
目前已报道的微线体蛋白MIC有15种以上,它们2种或2种以上相互结合,以复合体形式存在,在虫体识别、黏附、入侵宿主细胞过程中起到重要作用[21]。其中MIC2和MIC3为主要研究蛋白[22]。关于MIC11的研究报道较少,Harper等[23]研究表明MIC11蛋白在分泌时,被2个连续的蛋白酶水解修饰,去除内部的前肽,形成成熟蛋白,是MIC家族中唯一的一种特殊结构;Tao等[24]通过MIC11疫苗免疫小鼠后进行攻虫试验,表明MIC11疫苗成功提高了小鼠的存活率。本试验筛选出的单克隆KO-MIC11株接种小鼠后,在小鼠的心、肝、脾、肺、肾、脑及生殖器官中均能扩增出KO-MIC11株B1基因和GFP基因片段,但扩增不出MIC11基因片段,说明本试验成功构建并筛选出MIC11基因敲除的单克隆虫株。
谢素珠等[19]构建了弓形虫MIC10基因敲除株,通过乙胺嘧啶药物筛选、GFP绿色荧光观察进行体外和小鼠体内PCR鉴定MIC10基因确定了单克隆敲除虫株。本试验在此基础上进行了改进,对构建的弓形虫KO-MIC11株应用弓形虫B1基因和MIC11基因,以及载体中GFP基因进行了PCR鉴定,并与弓形虫RH株进行了比较,结果表明KO-MIC11株和RH株均扩增出B1基因条带;RH株扩增出MIC11基因条带,而KO-MIC11株未扩增出MIC11基因条带;KO-MIC11株扩增出GFP基因条带,而RH株未扩增出GFP基因条带,说明本试验构建的KO-MIC11株能够在Vero细胞和小鼠体内稳定增殖,而且GFP基因在KO-MIC11株内能够稳定表达。本试验为弓形虫MIC11基因敲除株致病性研究奠定了基础。
相关研究表明,弓形虫微线体蛋白MIC家族成员与弓形虫的毒力与致病性密切相关,该家族成员已被用于弓形虫疫苗的研究[25-26]。目前关于弓形虫MIC11基因的研究报道较少,本试验构建的弓形虫KO-MIC11虫株,为后续探究MIC11基因对弓形虫生长、入侵、增殖、逸出及致病性等功能的影响奠定了基础;通过接种KO-MIC11株可探究该虫株对动物抗野生虫株感染的保护能力,有望用于弓形虫基因工程疫苗的研发。

