良性脑膜瘤原代细胞培养及脂多糖对其增殖的影响
李云峰,张弘池,孙昱皓,卞留贯,王宝锋
脑膜瘤是常见的中枢神经系统肿瘤,其发病率为1.3/105~7.8/105,仅次于胶质瘤,约占颅内原发性肿瘤的30%[1-2]。虽然近90%的脑膜瘤为良性肿瘤(WHO Ⅰ级),但由于脑膜瘤常侵犯邻近的软组织或颅骨,或由于生长部位邻近重要结构无法全切,即使Ⅰ级脑膜瘤的复发率也有7%~25%[3]。术后残留或复发的脑膜瘤是外科医生面临的难题,虽然可以采用放射治疗或化学治疗,但患者仍存在较差的预后[4]。目前对于良性脑膜瘤发生发展的研究仍然较少,需要更多的基础研究以寻找新的治疗方法。本研究培养良性脑膜瘤及柔脑膜原代细胞,并用脂多糖(lipopolysaccharide,LPS)对细胞进行处理,检测细胞的增殖活力及炎症因子表达水平;以探讨良性脑膜瘤及柔脑膜原代细胞的培养技术和LPS对细胞增殖的影响,以及炎症与良性脑膜瘤发生发展的机制。
1 材料与方法
1.1 材料 孕19 d的SD大鼠(购于西谱尔-必凯公司),饲养于SPF级环境,人工昼夜节律,自由饮食。待娩出新生鼠后,将新生1 d的SD大鼠用于提取柔脑膜原代细胞。动物实验遵循上海交通大学医学院动物伦理委员会的要求。脑膜瘤标本取自3例经病理检查证实为WHO Ⅰ级脑膜瘤的患者,术中切除的肿瘤标本常温保存送至实验室提取细胞。所有标本获取及后续操作均获得上海交通大学医学院附属瑞金医院伦理委员会同意。
1.2 方法
1.2.1 脑膜瘤及柔脑膜原代细胞提取 根据文献介绍的方法[5-6],用灭菌眼科剪将脑膜瘤标本剪碎成小于1 mm3块状组织,置入37 ℃ 0.25%胰蛋白酶中,37 ℃温箱中消化(根据组织硬度决定消化时间,10~30 min,如组织过硬将无法消化,不能提取细胞),每2~3 min摇晃1次;10% FBS中和胰蛋白酶,反复吹打组织碎块形成细胞悬液,离心后以10% FBS DMEM培养液培养原代细胞;48 h后以无血清DMEM培养液纯化细胞,之后继续以10% FBS DMEM培养细胞,2~3 d更换一次培养液。将新生1 d的SD大鼠颈椎脱臼处死后,75%乙醇消毒,体视显微镜下剥离柔脑膜,HBSS洗涤后,0.25%胰蛋白酶消化10 min,中和后吹打成细胞悬液。后续培养方法同脑膜瘤原代细胞。
1.2.2 细胞免疫荧光检测 脑膜瘤原代细胞传代种植于细胞爬片上,细胞贴附后以4% PFA固定,0.3% Triton处理细胞;10% FBS封闭后加一抗处理,上皮膜抗原(epithelial membrane antigen,EMA)1∶200,波形蛋白(vimentin,VIM)1∶200,过夜孵育;二抗IgG(Alexa Fluor®488,1∶400,Invitrogen) 37 ℃反应1 h。DAPI染色后荧光显微镜观察。
1.2.3 细胞毒性/增殖实验 实验采用Cell Counting Kit-8(CCK-8)试剂盒(碧云天生物)。将原代细胞传代后种植于96孔板中,每孔种植100 μL 2 000个细胞,培养24 h后加入LPS处理。处理后,更换新培液,每孔加入10 μL CCK-8溶液,在培养箱中继续培育0.5~4 h,最后用酶标仪测吸光度(检测波长:450 nm)。
1.2.4 实时聚合酶链反应(real-time PCR) 采用LPS处理原代细胞,Trizol法提取RNA。根据PubmedGeneBank公布的大鼠及人相关基因序列,应用PrimerExpress 2.0(ABI)软件设计引物,由Invitrogen(Shanghai)合成(表1)。real-time PCR均采用One Step SYBR®PrimeScriptTMPLUS RT-PCR试剂盒(TakaRa),根据其说明书配制反应体系。利用ABIHT7900 real-time PCR仪进行PCR反应。实验以GADPH为内参,校正每个样品的Ct值,比较每个基因表达差异。ΔCt=目的基因Ct值-GADPH Ct值;ΔΔCt=实验组ΔCt值-对照组ΔCt值。
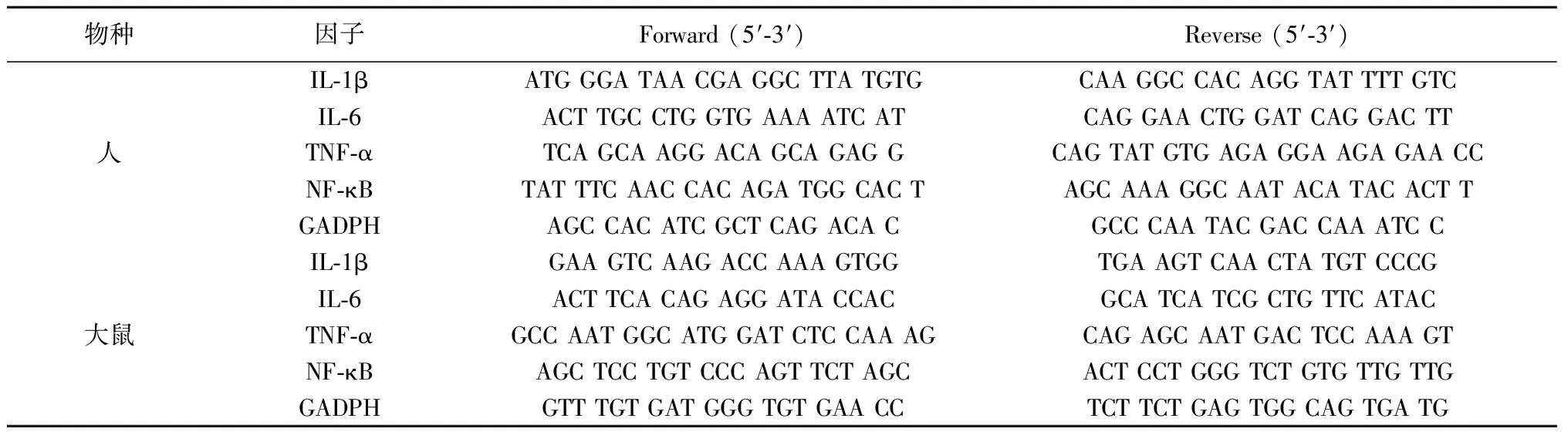
表1 real-time PCR引物序列
2 结 果
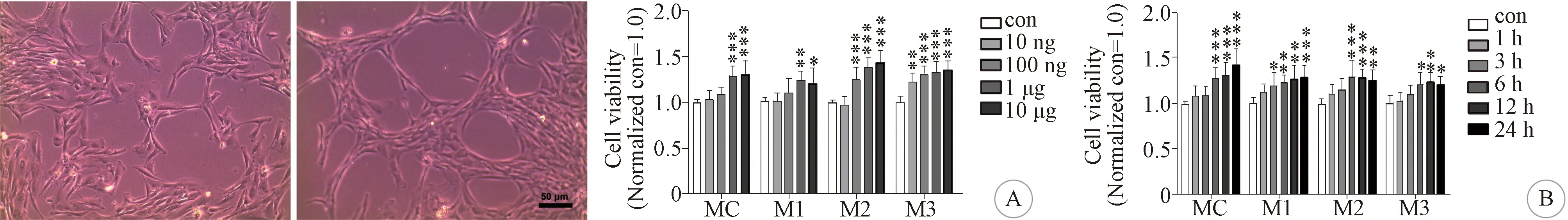
2.1 原代良性脑膜瘤细胞的培养、鉴定及生长特点所取的3个脑膜瘤标本均为病理证实WHO Ⅰ级脑膜瘤,其中2例为纤维型、1例为内皮型脑膜瘤。良性脑膜瘤原代细胞培养大约12 h后贴壁,此时培养液中漂浮部分死亡细胞或未消化组织碎块,贴壁细胞呈双极长梭形,部分可聚集成团。约48 h后需要传代,传代细胞用低营养无血清培养基培养(单纯DMEM),以提高脑膜瘤和柔脑膜原代细胞的纯度。之后继续以10% FBS DMEM培养。原代细胞在 1~4代之间生长活跃,增殖能力最强,约2~3 d可传一代。多数传至第6代以后,细胞开始出现老化,细胞内包涵体增多,增殖能力明显下降。脑膜瘤原代细胞的形态为两极或多极,相互连接成片、束状排列或聚集成团,胞浆丰富,核大,部分可见包涵体;细胞免疫荧光检测显示3个脑膜瘤原代细胞的胞浆中均表达EMA和VIM(图1)。柔脑膜细胞形态较为均一,大小相对一致,呈成纤维细胞形态,束状排列或聚集成团(图2)。
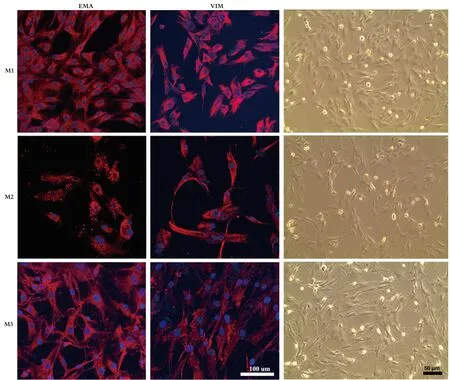
红色荧光:EMA或VIM;蓝光荧光:DAPI;白色标尺=100 μm;黑色标尺=50 μm图1 脑膜瘤原代细胞的形态及鉴定
2.2 LPS对良性脑膜瘤原代细胞增殖活力的影响良性脑膜瘤及柔脑膜原代细胞传代后,用不同浓度的LPS(con,10 ng/L,100 ng/L,1 μg/L,10 μg/L)处理细胞12 h,采用CCK-8溶液测定细胞的吸光度(反映细胞增殖活力)。结果显示,随着LPS浓度提高,良性脑膜瘤与柔脑膜原代细胞的增殖活力都明显增加,呈剂量依赖关系;LPS浓度为1 μg/L时细胞增殖活力达峰值;浓度为10 μg/L时出现毒性反应,细胞活力下降(图3A)。当LPS浓度为1 μg/L时,细胞活力随着处理时间延长(con,1 h,3 h,6 h,12 h,24 h)不断增强,在6 h或12 h达到峰值,呈明显时间依赖关系(图3B)。
2.3 LPS对良性脑膜瘤原代细胞炎症因子表达的影响 经1 μg/L LPS处理6 h后,良性脑膜瘤和柔脑膜原代细胞的3种炎症因子(IL-1β、IL-6、TNF-α)和NF-κB的RNA表达水平均明显增高(图4)。
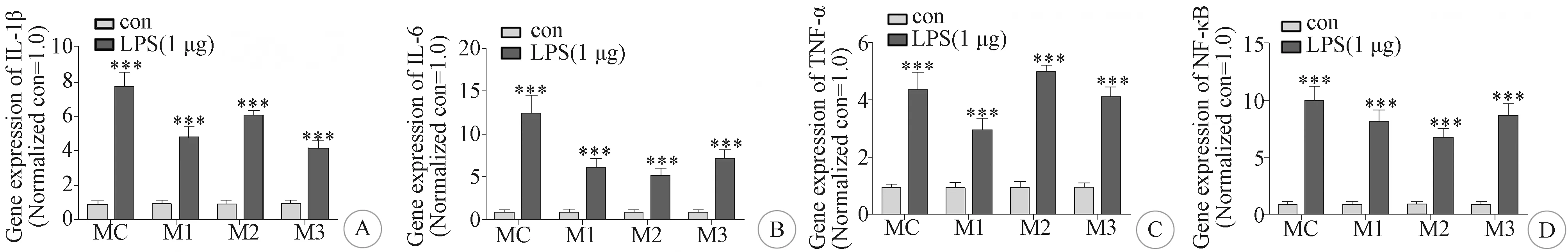
A:IL-1β; B:IL-6; C:TNF-α; D:NF-κB(与对照组比较***P<0.001)图4 LPS处理后脑膜瘤与柔脑膜细胞的炎症因子和NF-κB表达水平
3 讨 论
脑膜瘤基础研究中采用的细胞株如IOMM-Lee、CH-157 MN、HKBMM等,主要来源于恶性脑膜瘤;而非典型或良性脑膜瘤的研究,目前还依赖于原代培养技术[7-8]。脑膜瘤的原代培养技术与常见的原代细胞培养方法类似,包括组织块培养法、机械分离法和化学消化法;前两者获得的细胞数量较少,加上良性脑膜瘤细胞增殖能力较弱,培养时间较长,难以得到足够细胞。化学消化法采用胰蛋白酶直接去除肿瘤的纤维组织或基质,肿瘤细胞充分分离,得到单细胞悬液,容易在短时间内获得大量的原代细胞。且经过低营养(低血清或无血清)培养基筛选,去除多数杂质细胞,所收获原代细胞纯度高。当然也有文献报道良性脑膜瘤永生细胞株的建立,采用慢病毒导入端粒酶亚单位(telomerase reverse transcriptase,hTERT)质粒,构建良性脑膜瘤细胞永生株[9-11]。但hTERT本身对于脑膜瘤的发生发展也存在重大影响,导入该质粒后对脑膜瘤的基础研究可能存在潜在影响,此永生株目前国内也没有相关报道。本研究采用化学消化法,利用体积较大的肿瘤,一次可以得到大量的原代细胞,有利于实验的进行。
EMA和VIM是脑膜瘤的两个主要分子标记物,几乎所有的脑膜瘤中均有表达[12-14];因此,EMA和VIM常用于脑膜瘤的病理诊断和脑膜瘤细胞鉴定。本研究的3种良性脑膜瘤原代细胞经免疫荧光检测,EMA和VIM表达均为阳性,可证实为脑膜瘤细胞。
脑膜由硬脑膜、蛛网膜与软脑膜组成,蛛网膜和软脑膜的胚胎来源类似,两种合在一起称为柔脑膜,柔脑膜细胞是柔脑膜的主要细胞成分。目前研究认为,柔脑膜不单是脑组织表面的一层阻止脑脊液溢出的屏障,还存在其他更为重要的作用。如在炎症刺激下,柔脑膜细胞可独立于胶质细胞影响神经系统内的免疫调节反应;柔脑膜细胞自身也可以合成分泌与神经元相关的神经生长因子(nerve growth factor,NGF)、转移生长因子(transfer growth factor,TGF)等,并可在一定条件下转化为神经干细胞,促进神经系统发育[15-17]。
目前研究较为认可的观点是脑膜瘤起源于蛛网膜盖细胞,与柔脑膜关系密切;所以在脑膜瘤相关基础研究中,常以柔脑膜细胞作为正常对照[5-6];也有研究直接以蛛网膜细胞作为正常对照组[18]。因人源蛛网膜细胞的来源、分离与纯化更为困难,故本研究以大鼠柔脑膜原代细胞为正常对照。虽然获取柔脑膜组织是在体视显微镜下进行,但柔脑膜与膜下脑组织连接较为紧密,在分离时容易同时取下部分小血管和脑组织,造成细胞污染。但由于神经组织细胞为成熟分化细胞,需要较高的培养条件,在低血清或无血清等低营养条件下,污染细胞无法生长进而死亡,所以经过低营养条件培养后可以得到高纯度的柔脑膜细胞[16]。本研究中的原代细胞到第3代后应用于下一步实验检测。
肿瘤的发生发展与慢性炎症关系密切。长时间慢性炎症刺激诱导基因突变,引起癌基因激活和抑癌基因失活,进而促进肿瘤细胞增殖和血管生成;而癌细胞出现侵袭或远处转移也与炎症引起细胞外基质降解相关。同时,在肿瘤自身生长过程中,肿瘤微环境也会通过诱导炎症细胞或肿瘤细胞本身分泌大量炎性因子,活化炎症相关信号传导通路,如NF-κB、STAT3等,提高肿瘤细胞生存、增殖或远处转移的能力[19]。本研究中,良性脑膜瘤/柔脑膜原代细胞经LPS处理后增殖活力明显增强,并与LPS浓度及时间明显相关。这与LPS在其他肿瘤细胞中的研究结果基本一致[20-22]。
LPS进入培养液后,先与脂多糖结合蛋白(lipopolysaccharide-binding protein,LBP)结合,LBP将LPS运送至靶细胞膜表面与CD14结合,随后再联合Toll样受体4(toll-like receptor,TLR4)及髓样分化蛋白2(myeloid differentiation protein-2,MDP-2)形成蛋白复合体。TLR4进一步将信号传递给NF-κB和MAPKs通路,最终活化转录因子NF-κB,促使靶细胞中各种细胞因子的大量表达[23]。本研究结果显示,良性脑膜瘤及柔脑膜原代细胞的相关炎性因子,如IL-1β、IL-6、TNF-α和NF-κB等,在LPS刺激后表达水平明显增高。而在脑膜瘤标本的检测也显示其IL-1β与TNF-α的表达水平明显高于瘤周正常组织;而且在体内与体外实验中均证实,塞来昔布可以抑制脑膜瘤生长,提示炎性刺激可以诱导脑膜瘤形成有利于其生存和生长的微环境[24]。
综上所述,良性脑膜瘤与柔脑膜原代细胞的培养成功为良性脑膜瘤的基础研究打下了基础。LPS处理良性脑膜瘤与柔脑膜细胞后,细胞增殖明显增加,炎性因子(如IL-1β、IL-6、TNF-α)和NF-κB的表达上调;表明良性脑膜瘤的生长与炎症有密切关系。