FGG与FGA在吸烟所致COPD中的表达及意义*
刘宏军, 顾建军, 高君吟, 王玉秀, 闵凌峰
(扬州大学临床医学院,苏北人民医院呼吸与危重症科,江苏扬州,225001)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种常见的慢性疾病,持续的呼吸道症状和气流受限是它的主要特征,被认为是来自于各种终生的、动态的和累积的基因-环境相互作用的结果,吸烟是其中最主要的危险因素[1]。它是目前全世界排名前三的死亡原因之一,90%的死亡发生在低收入和中等收入国家[2]。在2015 年,中国20 岁及20 岁以上的COPD 患者总数估计为9 990万,其中相当一部分患者未能得到及时诊断[3]。此外,在许多未达到COPD 肺功能诊断标准的人群中,已经发现了肺部损害,和某些功能的下降[4]。寻找参与COPD 发病机制的生物标志物,将有利于COPD的早期发现、干预和治疗。近年来,高通量测序已广泛用于研究肺部疾病的发病机制[5],多个COPD 相关的差异基因被发现,由于检测和分析方法的局限性,目前仍不能完全解释COPD 发病原因[6-7]。有人尝试利用多个数据集综合分析,提高可靠性,获得了一定成果[8]。在本研究中,我们利用差异分析方法,鉴定出在多个COPD 相关mRNA 数据集中均差异表达的2 个基因为FGG和FGA,结合不同数据库来源、不同组织样本、不同种属的数据集分析它们的表达特点,结果提示纤维蛋白原γ 链(fibrinogen gamma chain,FGG)和纤维蛋白原α 链(fibrinogen alpha chain,FGA)可能是参与COPD 发病机制的生物标志物。FGG 与FGA 在蛋白水平与mRNA 表达是否一致不得而知,因此我们构建了小鼠吸烟模型进行了验证,具体报告如下。
材 料 和 方 法
1 数据分析
1.1 数据来源 从基因表达数据库(GEO)找到3个人肺组织来源的mRNA 表达数据集GSE57148、GSE47460(测序平台:GPL14550)、GSE76925,人小气道上皮(支气管镜刷检获得)来源数据集GSE5058,小鼠肺组织来源数据集GSE17737。肿瘤基因组图谱数据库(the Cancer Genome Atlas,TCGA)获得病理正常的癌旁肺组织的mRNA表达数据。
1.2 差异基因获取方法 利用R 软件的limma包对GSE57148 表达矩阵数据进行差异基因分析,使用GEO2R 在线分析获得GSE47460(GPL14550 平台)数据集差异基因的.txt文件,显著差异基因标准为|log-FC|>0.5,adj.P. Val<0.05,对获得的两组差异基因取交集,在GSE76925 进行GEO2R 在线分析获得的差异基因文件中进行验证。
1.3 GO 分析 在DAVID 网站(6.8)对获得的上调基因及下调差异基因分别做GO 富集分析,以P<0.05,FDR<0.01为标准筛选结果。
1.4 基因表达特征分析 选择人肺组织数据集GSE76925、小气道上皮数据集GSE5058、小鼠肺组织数据集GSE17737 和TCGA 病理正常的癌旁肺组织的mRNA 表达数据,在各个表达矩阵中提取FGG 与FGA 的mRNA 表达值,结合各组数据包含的吸烟或COPD状态信息进行特征分析。
2 实验方法
2.1 动物模型构建及样本取材 雄性C57BL/6J 小鼠(8周龄,体重20~25 g)16只购自北京维通利华实验动物中心,许可证号为SCXK(京)2016-0006。随机分配为对照组与吸烟组,每组8 只,采用烟熏法建立小鼠COPD 模型,对照组予新鲜空气,吸烟组在自制染毒箱内以南京牌香烟(焦油量11 mg)烟雾(cigarette smoke,CS)作为刺激物处理30 min,每次使用5支香烟,每天2 次,间隔4 h,每周暴露5 天,连续处理24 周,处理完成后麻醉小鼠行气管插管,0.8 mL 生理盐水冲洗肺部3 次,收集支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF),从胸腔取肺,左肺制匀浆离心后冻存上清,右肺行组织切片,4%甲醛固定肺组织24 h后石蜡包埋。所有动物实验方案均经扬州大学研究伦理委员会批准。
2.2 ELISA 采用ELISA 试剂盒,按说明书操作,检测小鼠肺组织及肺泡灌洗液中白细胞介素6(interleukin-6,IL-6)水平。
2.3 HE 染色及免疫组化染色 蜡块样本正中矢状面切片,二甲苯脱蜡,梯度乙醇洗脱二甲苯,苏木紫染色,1%酸性乙醇分化后水洗,伊红染色后,梯度乙醇脱水,二甲苯透明后盖片,观察肺泡间隙扩大情况。蜡块样本正中矢状面切片,以二甲苯脱蜡、乙醇水合、柠檬酸钠高温修复、兔抗小鼠FGG、FGA、α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)和E-钙黏蛋白(E-cadherin)抗体孵育;山羊抗兔IgG H&L(HRP)Ⅱ抗在室温下染色20 min,最后DAB 反应显色。所有切片均采用Olympus显微镜拍摄。
3 统计学处理
采用SPSS 19.0统计软件包进行统计学处理,所有实验均独立重复3 次,计量资料使用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析,并采用SNK 法进行事后比较,两组均数间比较采用t检验,以P<0.05为差异有统计学意义。
结果
1 筛选差异基因
以adj.P.Val<0.05 和|logFC|>0.5 的阈值进行筛选之后,GSE57148 数据集中鉴定出850 个差异基因(上调495 个,下调355 个),GSE47460(GPL14550)鉴定出238 个差异基因(139 个上调,99 个下调)。两组取交集获得共同的COPD 与非COPD 差异基因(上调22 个,下调7 个),在GSE76925 差异基因结果中进行验证,仍然符合adj.P. Val<0.05 和|logFC|>0.5 标准的差异基因包括8 个上调的差异基因,分别是FGA、FGG、COL14A1、COMP、NPTX1、TIMP4、GREM1和CYP1B1,及2 个下调差异基因分别是SLITRK6和PRPH。
2 GO分析结果
在DAVID 网站(6.8 版本)对上调基因及下调基因分别做GO 富集分析,选择P<0.01,FDR<0.01 为标准,下调基因无阳性结果。上调差异基因GO 分析结果主要包含生物学过程、细胞定位和分子功能3个方面,其中生物学过程结果主要有细胞外基质组织、胶原原纤维组织、凝血,纤维蛋白凝块形成、肽类激素分泌的正调控等;基因主要定位于细胞外间隙、纤维蛋白原复合物、细胞外基质、血小板α 颗粒中;分子功能仅包括一项蛋白质结合、桥接。其中FGA与FGG 以及COL14A1,共同定位于细胞间隙,参与细胞外基质及胶原纤维合成等生物学过程,涉及分子功能是蛋白质结合和桥接。FGA与FGG还共同参与凝血,纤维蛋白凝块形成等其他多个生物学过程。
3FGG与FGA基因表达量与吸烟及COPD的关系
COPD患者肺组织FGG与FGA的表达以及FGG/FGA(FGG 与FGA 表达量的比值)均高于表型正常的吸烟者(P<0.05),见图1A、B。为分析它们诊断COPD 的价值,对FGG/FGA、FGG 和FGA 分别作ROC曲线分析,FGG/FGA 曲线下面积为0.7315,FGG 与FGA 曲线下面积分别为0.7097 和0.6275,见图1C。吸烟20 包1 年以上者肺组织的FGG 表达与FGG/FGA 高于吸烟20 包1 年以下的低剂量吸烟者,见图1D、E。TCGA 数据显示当前吸烟者肺组织FGG与FGA 表达显著高于非吸烟者,戒烟小于15 年者仍不能完全恢复正常,见图1F。
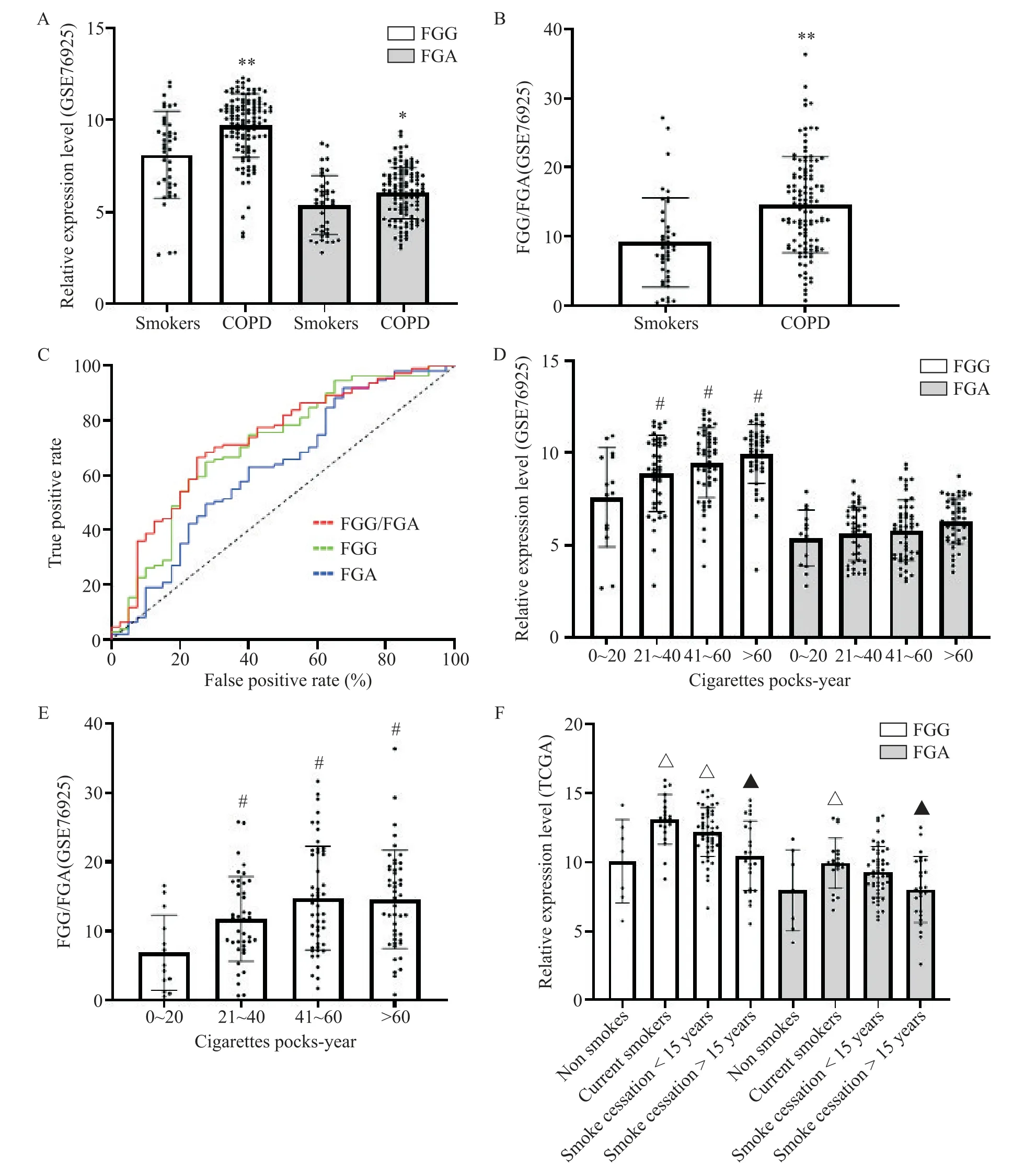
Figure 1. FGG and FGA expression in the lung were affected by smoking and COPD. A:expression of FGG and FGA in smokers and COPD patients;B:the ratio of FGG to FGA expression in smokers and COPD patients;C:ROC analysis of FGG,FGA and FGG/FGA;D:FGG and FGA expression in the lungs analyzed according to the number of cigarettes packs-year;E:the ratio of FGG to FGA expression in the lungs analyzed according to the number of cigarettes packs-year;F:FGG and FGA expression in pathologically normal lung tissue from patients from TCGA by different smoking status. Mean±SD.n=3.*P<0.05,**P<0.01vs smokers;#P<0.05vs 0~20 group;△P<0.05vs non-smokers;△P<0.05vs current smokers.图1 FGG与FGA表达受吸烟史及COPD疾病的影响
肺组织的FGG 与FGA 水平不受年龄和性别的强烈影响,见图2A、B。小气道上皮来源的数据中,FGG 与FGA 水平在COPD 患者中同样高于表型正常的吸烟者,COPD 组患者FGA 表达水平高于COPD 早期分组,且在COPD 早期分组又高于表型正常吸烟者,见图2C。香烟烟雾处理同样会导致小鼠肺组织FGG与FGA基因表达增高,烟雾处理时间越长,这种趋势越明显,脱毒处理后这种趋势可以部分逆转,见图2D。

Figure 2. Relationship between FGG and FGA expression with age,sex,tissue origin and species. A:FGG and FGA expression in lungs from the GSE76925 by sex;B:FGG and FGA expression in lungs from the GSE76925 by age;C:FGG and FGA expression in human tracheal epithelia;D:FGG and FGA expression in the lungs of mice that were sham-treated or that were exposed to cigarette smoke for different weeks. Mean±SD.n=3.*P<0.05vs smokers group;#P<0.05vs early COPD group;△P<0.05vs sham group;@P<0.05vs smoke 12 weeks group;▲P<0.05vs smoker 24 weeks group.图2 FGG和FGA表达与年龄、性别和组织来源与种属的关系
4 小鼠肺组织与肺泡灌洗液中IL-6水平的变化
经ELISA 试剂盒检测,吸烟组小鼠肺泡灌洗液及肺组织匀浆中,IL-6 水平均高于对照组(P<0.01),见表1。

表1 ELISA检测小鼠BALF及肺组织匀浆中IL-6的水平Table 1. Detection of IL-6 in BALF and lung homogenate of the mice by ELISA(ng/L. Mean±SD.n=8)
5 小鼠肺组织HE染色观察
如图3 所见,吸烟组小鼠肺组织可见部分肺泡腔扩大、肺泡间隔断裂、肺泡腔融合形成,而对照组小鼠肺泡结构相对完整。
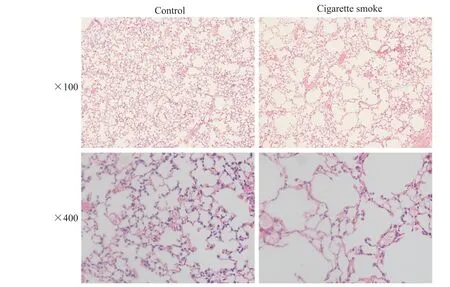
Figure 3. HE staining of mouse lung tissues. The mice in the 2 groups were treated with air and cigarette smoke,respectively.图3 小鼠肺组织HE染色
6 小鼠肺组织FGG、FGA、α-SMA 与E-cadherin水平的变化
免疫组织化学方法检测小鼠肺组织FGG、FGA、α-SMA与E-cadherin的表达,结果表明香烟烟雾处理可致肺组织中FGG、FGA 和α-SMA 水平升高,E-cadherin 水平下降,FGG 与FGA 主要表达于支气管及肺泡上皮细胞,以肺泡上皮细胞为主,见图4。
讨论
本研究中,我们对GSE57148 与GSE47460 数据集分别进行了差异基因分析后取交集,以上数据集的共同特点是均采用COPD 患者与非COPD 患者的分组方式,均为肺组织标本,每组样本量都大于90。GSE76925是一个以COPD 患者与表型正常吸烟者为分组方式的数据集,将前述结果在该数据集再次进行验证。对最终获得的差异基因进行了GO 分析,显示以上差异基因中FGA与FGG以及COL14A1共同定位于细胞间隙,参与细胞外基质及胶原纤维合成等生物学过程。而细胞外基质重塑是COPD 的重要特征[9]。
COL14A1在肺动脉高压患者的血管内膜中层显著上调,通过稳定胶原纤维增加了血管硬度[10],COL14A1与COPD的关系尚未见报道。
FGG 与FGA 除参与细胞外基质重塑,还共同参与凝血等多个生物学过程。很多凝血指标,如血浆纤维蛋白原等变化,被证明与COPD 相关[11]。FGA、FGB 和FGG 各自独立编码的3 个多肽链,以链内和链间的二硫键的形式,构成了纤维蛋白原[12]。纤维蛋白原被认为是可行的COPD 标志物,主要用来预测COPD 的不良预后[13]。FGG、FGA、FGB基因均被报道存在多个突变体,可致遗传性纤维蛋白原缺陷[14-15]。
我们选择FGG 与FGA 作为下一步研究对象。通过对GSE76925 数据分析发现,吸烟可致人肺组织FGG与FGA表达增高,戒烟有助于逆转这个情况,但需时较长,TCGA 的数据表明戒烟小于15 年,这种趋势仍不能完全缓解。研究表明,吸烟时间越长、吸烟强度越高,COPD 的风险就会显著增加,戒烟后,与现在的吸烟者相比,曾经吸烟者患COPD 的风险较低[16],我们的统计结果有助于解释驱动这一现象的内在原因。COPD 患者肺组织FGG/FGA 值高于表型正常吸烟者,辅助诊断COPD的效果甚至要优于FGG或FGA单个基因的表现。此外肺组织FGG 与FGA的mRNA 表达不受年龄和性别的强烈影响,因而具备成为COPD标志物的良好潜力。
在一个小气道上皮来源的数据集中,我们发现FGA 还有助于区分肺一氧化碳弥散量(diffusion capacity for carbon monoxide of lung,DLCO)下降的COPD 早期患者,DLCO 与COPD 的发病和预后显著相关[17],与肺组织样本的区别在于,小气道上皮样本中FGG 与FGA 表达水平相接近。肺组织FGG 与FGA 的mRNA 表达变化,先于COPD 发生就已出现,这为COPD的早期诊断提供了可能。
吸烟及COPD 状态下,肺组织FGG 与FGA 在蛋白水平是否与mRNA水平一致,尚未得到验证。由于人肺组织获取困难,我们决定以小鼠为研究对象,在来自小鼠的数据集中,我们再次验证了吸烟对小鼠肺FGG 与FGA 表达的影响,与人肺组织中得到的结果是基本一致的。我们以香烟烟雾全身暴露法构建了COPD 模型鼠[18],HE 染色显示吸烟组小鼠出现肺气肿改变,提示COPD造模成功。免疫组化结果显示吸烟处理可致小鼠肺组织FGG 与FGA 肽链含量增加,FGG与FGA在蛋白质水平与mRNA密切相关。
ELISA 结果显示,吸烟小鼠肺泡灌洗液及肺组织内的IL-6 水平高于对照组,提示吸烟会诱发肺组织炎症,这与已有的研究结果是相符的。A549 细胞被证明在IL-6刺激下能合成纤维蛋白原,相应的3个多肽链表达均增高,但增高的水平不一致,这个过程受糖皮质激素影响[19],而香烟烟雾提取物刺激可使A549 细胞、单核细胞以及人支气管上皮细胞内IL-6水平升高[20-21],吸烟或通过诱导肺局部炎症促使肺上皮细胞合成FGG 与FGA 肽链,进而合成纤维蛋白原。金黄色葡萄球菌可通过与纤维蛋白原结合发挥致病作用[22],这可以部分解释,COPD 患者更高的肺炎发生率和更差的预后[23]。FGG与FGA虽然是合成纤维蛋白原的原料,但我们的研究表明,FGG 与FGA的表达变化并不一致,显然不能与纤维蛋白原变化水平相等同。
FGG 与FGA 除参与合成纤维蛋白原,是否存在其他参与COPD 发生的机制仍是未知领域。已有研究发现,FGG 可以通过激活上皮-间充质转化(epithelial-mesenchymal transition,EMT)促进肝癌细胞迁移和侵袭[24]。FGA基因敲除促进A549 和H1299 细胞的增殖、迁移和侵袭,降低EMT 标志物E-cadherin 和细胞角蛋白5/8的表达[25]。EMT机制深度参与COPD发病过程中的气道重构[26],小气道重构与肺泡附件丢失是COPD 小气道气流受限的决定性因素[27],而小气道与肺泡上皮正是FGG 与FGA 的主要表达区域。我们的动物实验结果也显示,吸烟可致小鼠肺组织α-SMA水平升高,E-cadherin水平下降。吸烟可能通过上调IL-6 影响FGG 与FGA 的表达调节肺泡上皮细胞EMT转化,参与COPD的发生。
综上所述,通过生物信息学分析,我们发现FGG与FGA 在肺组织的表达水平与吸烟及COPD 的发生显著相关,FGG/FGA 有助于早期识别COPD,具有成为COPD 标志物的潜力。动物实验证明FGG 与FGA在蛋白水平与mRNA 水平变化一致,吸烟或通过上调IL-6 刺激小鼠肺组织FGG 与FGA 的合成,继而影响EMT 水平参与COPD 的发生。戒烟有助于缓解吸烟引起的肺组织基因表达异常。

