二甲双胍经Nrf2-Gpx4通路抑制铁死亡并减轻非酒精性脂肪性肝病大鼠的肝损伤*
岳亚光, 檀薇薇, 王文川, 殷建敏, 李 鑫△
(邢台市人民医院 1消化内科,2中西医结合肝病科,3超声科,河北邢台 054001)
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是一种从单纯性脂肪变性到非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)的代谢综合征,是世界上发病率最高的肝脏疾病,进展为NASH 是肝硬化和癌变的严重危险因素[1]。肝脏铁沉积的存在与NAFLD 患者的不同组织学特征相关,10%~50%的NAFLD患者表现出肝脏铁积累和/或高铁蛋白血症[2];并且肝脏中铁的积累被认为是NASH 的加重因素[3-4]。铁死亡是最近公认的一种细胞死亡形式,是铁依赖性和脂质过氧化介导的非凋亡性细胞死亡;该死亡方式依赖于细胞内铁和活性氧(reactive oxygen species,ROS),以脂质过氧化为特征。当细胞的内源性抗氧化状态受到损害时,它就会被触发,导致脂质ROS 积累,这对膜结构具有毒性和破坏性。因此,细胞的氧化应激和抗氧化水平是诱导这种新型细胞死亡脂质过氧化的重要调节剂[5]。
越来越多的证据表明,铁死亡在调节肝脏多种病理进展中起着不可忽视的作用,肝铁死亡作为引发NASH 炎症的触发因素起着重要作用,并且可能是预防NAFLD 发作的治疗靶点[6-7]。谷胱甘肽过氧化物酶4(glutathione peroxidase 4,Gpx4)是铁死亡的调节剂,核因子E2 相关因子2(nuclear factor E2-related factor 2,Nrf2)的转录激活与抗铁死亡有关[8]。在铁死亡途径中,大多数级联或相互作用的酶和蛋白质,例如胱氨酸/谷氨酸逆向转运蛋白(cystine/glutamate antiporter system light chain,xCT)、Gpx4、铁转运蛋白和血红素加氧酶1(heme oxygenase-1,HO-1)等均受抗氧化反应元件Nrf2 的转录调节。Nrf2 基因的失活、抑制和敲低会增强细胞的铁死亡;激活Nrf2信号通路减少铁死亡可改善NAFLD[9]。
二甲双胍(metformin,Met)是2 型糖尿病的一线治疗药物,可减少胰岛素抵抗和2 型糖尿病患者的心血管事件。Met减少了肝脏葡萄糖的产生[10],肝脏被认为是其作用的靶组织。据报道,Met可通过多种作用途径减轻NAFLD 的肝损伤,但其具体作用机制还有待进一步研究探讨[11-12]。Met 对胰岛素抵抗的改善作用与其调控Nrf2信号通路中关键基因的表达从而改善氧化应激有关[13],并且其可通过激活Nrf2/HO-1 信号通路减轻糖尿病大鼠肝脏损伤[14]。另有研究显示Met 可通过激活Nrf2 信号通路发挥抗铁死亡作用,增强血管平滑肌细胞的抗氧化能力,减弱高脂血症相关的血管钙化[15],但其对NAFLD 中细胞铁死亡现象是否具有调控作用尚未有研究。因此,本研究通过高脂饮食(high-fat diet,HFD)构建大鼠NAFLD 模型,探究Met 对NAFLD 大鼠肝细胞铁死亡现象的影响并进一步探讨其发挥抗铁死亡作用的具体机制。
材 料 和 方 法
1 材料
1.1 动物 SPF 级雄性Sprague-Dawley(SD)大鼠46只,6 周龄,体质量(200±20)g,购自济南朋悦动物繁育有限公司,合格证号为SCXK(鲁)20190003。大鼠在温度(20±2)℃、湿度(45~55)%、12 h 光照/12 h 黑暗周期的条件下饲养,可自由饮食和摄水。实验前,所有大鼠均用普通饲料适应性饲养7 d,然后开始实验。实验经本院伦理委员会批准,并按实验动物使用的3R原则给予人道关怀。
1.2 试剂 Met(格华止,中美上海施贵宝制药有限公司);Nrf2 抑制剂鸦胆子苦醇(brusatol),购自Med-ChemExpress;天门冬氨酸氨基转移酶(aspartate amino transferase,AST)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、丙二醛(malondialdehyde,MDA)和谷胱甘肽(glutathione,GSH)检测试剂盒购自南京建成生物工程研究所;大鼠白细胞介素6(interleukin-6,IL-6)和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)ELISA 检测试剂盒均购自上海酶联生物科技有限公司;普鲁士蓝染色试剂盒(Perls stain,核固红法)购自北京索莱宝科技有限公司;ROS 测定试剂盒(化学荧光法)购自南京建成生物工程研究所;油红O 染色试剂盒和铁测定试剂盒(比色法)购自Sigma-Aldrich;HE 染色、RIPA 裂解液和BCA 试剂盒均购自碧云天生物科技公司;兔源I抗Gpx4、xCT、Nrf2、HO-1、β-actin 及羊抗兔IgG H&L(HRP)购自Abcam;Gpx4、xCT、Nrf2及HO-1的引物序列购自上海GenePharma。
2 方法
2.1 模型的建立与分组 SD 大鼠46 只,随机选取11 只大鼠为对照(control)组,以普通饲料喂养,其余35 只大鼠为造模组,给予高脂饲料(73.6%基础饲料、1.2%胆固醇、0.2%胆酸钠、10%蛋黄粉、15%猪油)连续喂养8 周复制NAFLD 模型[16-17]。8 周后从对照组和造模组中随机抽取3 只大鼠处死,进行肝功能(ALT 和AST)、血脂(TG、TC、LDL-C 和HDL-C)水平检测及肝组织HE染色,判断造模是否成功。结果显示,造模大鼠肝组织结构紊乱,肝细胞出现明显脂肪变性,脂肪空泡、小叶炎症,同时肝功能和血脂均异常,造模成功。
将造模大鼠随机分为NAFLD 组、低剂量(100 mg/kg)Met(Met-low dose,Met-L)组、高剂量(200 mg/kg)Met(Met-high dose,Met-H)组和Met+brusatol(Nrf2 抑制剂)组[18],每组8 只。分组完成后,Met 各剂量组灌胃相应的药物,每天1 次,连续给药6 周;Met+brusatol 组大鼠在给予200 mg/kg Met 灌胃的同时隔天腹腔注射Nrf2 抑制剂2 mg/kg brusatol(溶于1%二甲基亚砜中),连续给药6 周;control 组和NAFLD组给予等量生理盐水灌胃和腹腔注射。
2.2 血清肝功能、血脂和炎症因子水平检测 给药结束后,麻醉大鼠,腹主动脉取血,静置后以1 008×g离心15 min,分离血清,按照试剂盒说明书的操作检测血清中ALT、AST、TG、TC、LDL-C、HDL-C、TNF-α和IL-6水平。
2.3 肝组织铁离子和氧化应激指标的检测 取血完成后,处死大鼠,取出肝脏,预冷的生理盐水洗净残血,于冰上用无菌手术刀片切分为4 部分,第1 部分置于冻存管中,-80 ℃保存;第2部分用4%多聚甲醛固定;第3 部分做冰冻切片,OCT 包埋;第4 部分称重后,加预冷的生理盐水研磨,制备10%的匀浆,离心取上清液。BCA 法测定蛋白浓度后,TBA 法检测匀浆中MDA 含量,微量酶标法检测GSH 含量,比色法检测铁离子含量;并按照ROS 试剂盒说明书于荧光酶标仪中在593 nm 处检测各孔吸光度(A)值,对照标准曲线计算各样品中ROS水平。
2.4 HE 染色检测肝组织病理学变化 取4%多聚甲醛固定的肝组织,梯度乙醇脱水,石蜡包埋,连续切4 μm 薄片,二甲苯脱蜡,梯度乙醇脱苯,蒸馏水冲洗;常规HE染色,封片,光学显微镜下观察肝组织形态变化,对肝组织HE 染色切片进行病理分析,并对NAFLD 活动评分(NAFLD activity score,NAS)进行统计学评估[19],每张切片选取4 个不同的视野,总得分0~8分,具体情况见表1。
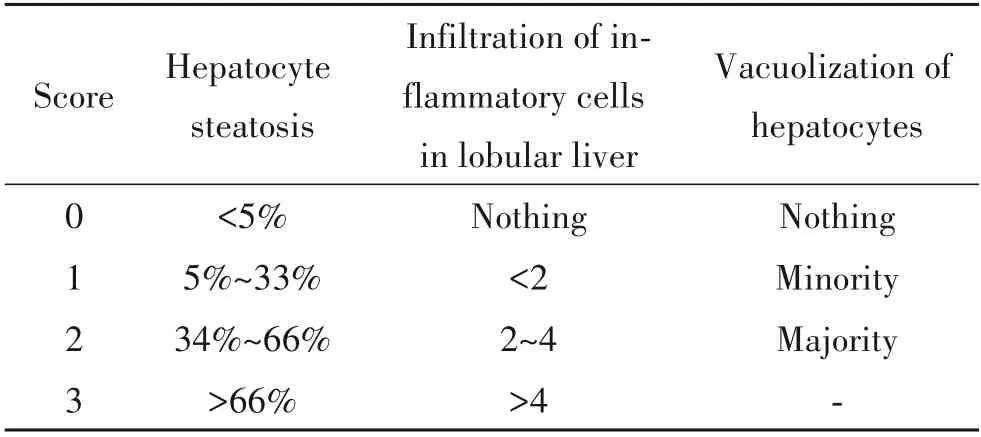
表1 NAS评分标准Table 1. NAS scoring standard
2.5 油红O染色检测肝细胞脂质积累 取2.3项下部分肝组织在15%和30%蔗糖溶液中脱水48 h,然后包埋OCT 中,切10 μm 切片,油红O 染色15 min,75%乙醇分化2 s,苏木素复染2 min,流水冲洗后1%盐酸乙醇分色,氨水返蓝,甘油明胶封片,倒置荧光显微镜下观察,采用Image-pro Plus 6.0 软件计算油红O 阳性面积的百分比,评估肝细胞的脂质积累情况;肝组织细胞中脂滴呈橘红色,核呈蓝色。
2.6 普鲁士蓝染色检测肝脏中铁沉积 取2.4 项下石蜡切片,常规脱蜡至水,蒸馏水冲洗后,Perls 染色液(试剂A1 与试剂A2 等量混合均匀,现配现用)染色30 min,再次冲洗后,用核固红试剂B 染核10 min,蒸馏水冲洗,常规脱水透明,中性树胶封片,光学显微镜下观察肝组织胞质内蓝色颗粒。每张切片随机选取5 个视野,通过图像分析测量普鲁士蓝染色阳性面积占整个面积的百分比。
2.7 Western blot 检测肝组织Nrf2、HO-1、Gpx4 和xCT 蛋白的表达 称取适量肝组织,加入RIPA 裂解液提取蛋白质。经BCA 定量后,取每孔30 μg 蛋白质样品上样,经10%SDS-PAGE 凝胶电泳分离,转移至聚偏二氟乙烯(PVDF)膜上。膜用5%脱脂牛奶封闭1 h,然后用含有0.1% Tween-20 的Tris 缓冲液(TBST)洗涤3 次,每次10 min。然后将膜与Ⅰ抗(Nrf2、HO-1、Gpx4、xCT和β-actin;1∶500稀释)在4 ℃下孵育过夜。用TBST洗涤3次,每次10 min,后将膜与Ⅱ抗(1∶2 000 稀释)在37 ℃孵育2 h。然后用TBST 洗涤膜3次,每次10 min。最后ECL 显色,以βactin为内参照,分析膜上蛋白质表达水平。
2.8 RT-qPCR 检测肝组织Nrf2、HO-1、Gpx4 和xCT的mRNA 表达 取-80 ℃保存的部分肝组织,使用Trizol提取组织中的总RNA,NanaDrop分光光度计检测总RNA 的浓度和纯度;然后按照试剂盒说明书将RNA 反转录为cDNA,进行PCR 扩增。反应体系(25 μL):SYBR®Premix Ex TaqTM(2×)12.5 μL,上下游引物各0.5 μL,cDNA(200 mg/L)1 μL,ddH2O 11 μL。反应条件:94℃10 min;95 ℃15 s,60 ℃20 s,75 ℃20 s,40 个循环结束后,采用2-ΔΔCt方法计算目的基因的相对表达量。用β-actin 作为内参照,引物序列见表2。

表2 RT-qPCR相关引物的序列Table 2. Sequences of RT-qPCR-related primers
3 统计学处理
实验所得数据均以均数±标准差(mean±SD)表示,采用GraphPad Prism 9.0 和Image-Pro Plus 6.0 软件进行分析,多组间比较采用单因素方差分析(oneway ANOVA),组间有差异进一步采用SNK-q检验进行两两比较;P<0.05为差异有统计学意义。
结果
1 各组大鼠肝功能和炎症因子水平的比较
与control 组相比,NAFLD 组血清ALT、AST、TNF-α 和IL-6 水平显著升高(P<0.05);与NAFLD 组相比,Met-L、Met-H 组血清ALT、AST、TNF-α 和IL-6水平显著降低(P<0.05);与Met-H 组相比,Met+brusatol 组血清中上述指标水平均显著升高(P<0.05),见表3。

表3 各组大鼠血清ALT、AST、TNF-α和IL-6水平Table 3. Serum ALT,AST,TNF-α and IL-6 levels of rats in each group(Mean±SD.n=8)
2 各组大鼠血脂水平的比较
与control 组相比,NAFLD 组血清TC、TG 和LDLC 水平显著升高,HDL-C 水平显著降低(P<0.05);与NAFLD 组相比,Met-L 和Met-H 组血清TC、TG 和LDL-C 水平显著降低,HDL-C 水平显著升高(P<0.05);与Met-H 组相比,Met+brusatol 组血清TC、TG和LDL-C 水平显著升高,HDL-C 水平显著降低(P<0.05),见表4。

表4 各组大鼠血脂水平Table 4. Blood lipid levels of rats in each group(Mean±SD.n=8)
3 各组大鼠肝组织铁离子含量和氧化应激指标的比较
与control 组相比,NAFLD 组肝组织铁离子含量及MDA 和ROS 水平显著升高,GSH 含量显著降低(P<0.05);与NAFLD 组相比,Met-L 和Met-H 组肝组织铁离子含量及MDA 和ROS 水平显著降低,GSH 含量显著升高(P<0.05);与Met-H组相比,Met+brusatol组铁离子含量及MDA 和ROS 水平显著升高,GSH 含量显著降低(P<0.05),见表5。
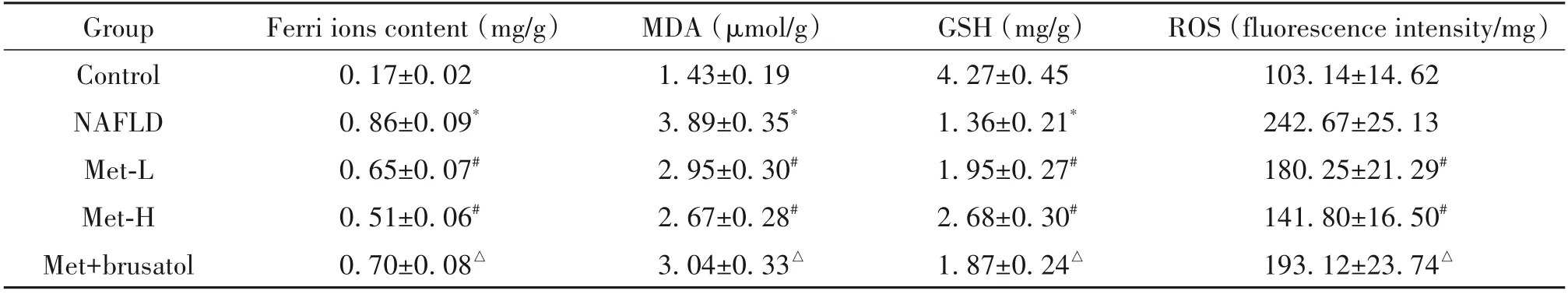
表5 各组大鼠肝组织铁离子和氧化应激指标水平Table 5. The levels of ferri ions and oxidative stress indexes in the liver tissues of rats in each group(Mean±SD.n=8)
4 各组大鼠肝组织病理学变化
HE 染色结果显示,control 组肝细胞排列整齐,肝小叶结构清晰,细胞无脂化,无炎症细胞浸润;NAFLD组肝细胞排列紊乱,出现肿胀,细胞内存在脂滴空泡,有明显的炎症细胞浸润现象;在给予Met 治疗后,肝细胞脂肪变性明显减轻,大部分肝细胞接近正常形态,脂滴空泡现象和炎症细胞浸润减少,且Met-H 组肝细胞损伤改善最佳;Met+brusatol 组肝细胞脂滴空泡现象和炎症细胞浸润程度较Met-H 组有所加重,见图1。与control 组相比,NAFLD 组肝组织NAS 评分显著升高(P<0.05);与NAFLD 组相比,Met-L 和Met-H 组肝组织NAS 评分显著降低(P<0.05);与Met-H 组相比,Met+brusatol 组肝组织NAS评分显著升高(P<0.05),见表6。

Figure 1. Representative image of HE staining of rat liver tissues. The transparent vesicles shown by the black arrows are lipid droplets,the red is the cytoplasm,and the blue is the nucleus. A:control group;B:NAFLD group;C:Met-L group;D:Met-H group;E:Met+brusatol group. The scale bar=20 μm.图1 大鼠肝组织HE染色图
5 各组大鼠肝细胞脂质积累和铁沉积比较
油红O 染色和普鲁士蓝染色结果显示,control组大鼠肝组织无明显脂滴沉积,肝细胞内未见明显蓝色染色颗粒,普鲁士蓝染色呈阴性,表明没有脂质积累和铁沉积;NAFLD 组大鼠肝脏中有大量脂滴沉积,肝细胞内出现不同数量的深蓝色颗粒,油红O 染色和普鲁士蓝染色阳性面积百分比较control 组显著增加(P<0.05),表明有显著的脂质积累和铁沉积;给予Met 治疗后,肝组织脂滴沉积和胞质内蓝色颗粒明显减少,油红O 和普鲁士蓝染色阳性面积百分比较NAFLD 组显著降低(P<0.05);与Met-H 组相比,Met+brusatol 组肝组织油红O 和普鲁士蓝染色阳性面积百分比显著升高(P<0.05),见图2、3及表6。
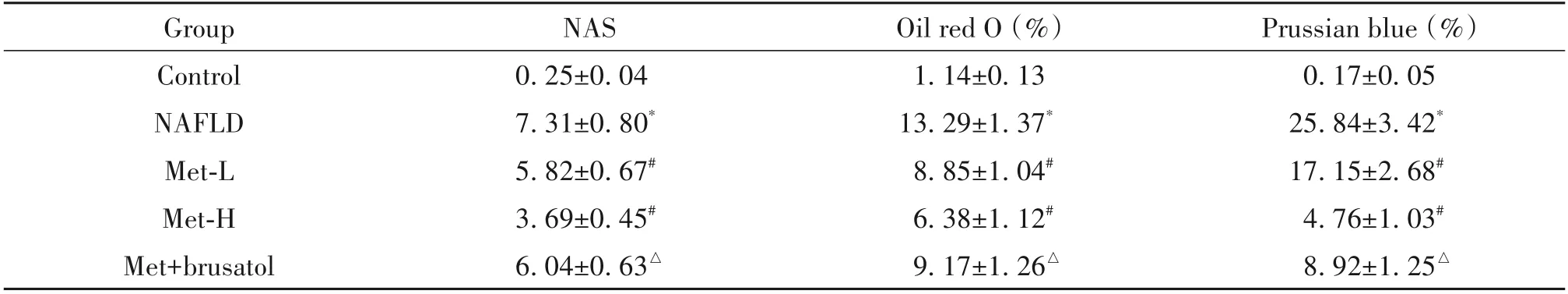
表6 各组大鼠肝组织NAS及油红O和普鲁士蓝染色阳性面积Table 6. NAS,and oil red O and Prussian blue staining positive areas of rat liver tissues in each group(Mean±SD.n=8)

Figure 2. Representative image of oil red O staining of rat liver tissues. Red represented lipid droplets,and blue representd cell nuclei. A:control group;B:NAFLD group;C:Met-L group;D:Met-H group;E:Met+brusatol group. The scale bar=20 μm.图2 大鼠肝组织油红O染色图

Figure 3. Representative image of rat liver tissues stained with Prussian blue. The blue particles in the cytoplasm were iron deposits.A:control group;B:NAFLD group;C:Met-L group;D:Met-H group;E:Met+brusatol group. The scale bar=20 μm.图3 大鼠肝组织普鲁士蓝染色图
6 各组大鼠肝组织Nrf2、HO-1、Gpx4 和xCT 蛋白表达的比较
与control 组相比,NAFLD 组肝组织Nrf2、HO-1、Gpx4 和xCT 蛋白表达显著降低(P<0.05);与NAFLD组相比,Met-L和Met-H组肝组织Nrf2、HO-1、Gpx4和xCT 蛋白表达显著升高(P<0.05);与Met-H 组相比,Met+brusatol 组肝组织上述蛋白表达水平显著降低(P<0.05),见图4。

Figure 4. The protein expression of Nrf2,HO-1,GPx4 and XCT in rat liver tissues. Mean±SD.n=8.*P<0.05vs control group;#P<0.05vs NAFLD group;△P<0.05vs Met-H group.图4 大鼠肝组织Nrf2、HO-1、Gpx4和xCT蛋白表达
7 各组大鼠肝组织Nrf2、HO-1、Gpx4 和xCT mRNA表达的比较
与control 组相比,NAFLD 组肝组织Nrf2、HO-1、Gpx4 和xCT 的mRNA 表达显著降低(P<0.05);与NAFLD 组相比,Met-L和Met-H组肝组织Nrf2、HO-1、Gpx4 和xCT 的mRNA 表达显著升高(P<0.05);与Met-H 组相比,Met+brusatol 组肝组织上述mRNA 表达水平显著降低(P<0.05),见表7。

表7 各组大鼠肝组织Nrf2、HO-1、Gpx4和xCT的mRNA表达Table 7. The mRNA expression of Nrf2,HO-1,Gpx4 and xCT in liver tissues of the rats in each group(Mean±SD.n=8)
讨论
肥胖、胰岛素抵抗、特别是2 型糖尿病是NAFLD和NASH 发展的主要因素。因此,NASH 可以称为“糖尿病肝病”。由于肥胖和糖尿病的流行,NAFLD和NASH 的患病率正在增加。目前没有针对NAFLD/NASH 的既定疗法。唯一被证明有效的干预措施是减肥和体育锻炼[20]。Met在抑制肝脏糖异生、改变肝脏脂肪酸代谢、提高脂肪酸氧化及抑制脂肪生成和增强胰岛素敏感性方面的益处已得到公认。近年来研究显示Met 可改善NAFLD,减轻高脂饮食诱导的NAFLD 小鼠肝脏中的炎症和脂质过氧化标志物水平[21-22];还可改善NASH 患者的肝功能生化指标(ALT、AST 和γ-谷氨酰转移酶等)[23],并降低患有肝硬化的糖尿病患者发生肝细胞癌的风险[24]。本研究结果显示,NAFLD 大鼠经Met治疗后,大鼠的肝功能和血脂异常得到明显改善,与以往的研究结果一致,再次验证了Met对NAFLD的保护作用。
氧化应激是指ROS 的过度产生,削弱了内源性抗氧化防御功能,导致细胞损伤[25]。铁依赖性脂质过氧化物的积累是NAFLD 的重要原因之一[9]。铁在人体中通常以三价铁(Fe3+)形式存在,在一些酶和转运蛋白的作用下其从循环系统进入到细胞质和线粒体内变成具有氧化还原活性的二价铁(Fe2+),这些活性铁会通过芬顿反应催化产生ROS,铁依赖产生的ROS 与脂质发生过氧化反应,从而诱导细胞铁死亡。此外,GSH 消耗诱导的Gpx4 失活所导致的脂质过氧化也参与铁死亡[26-27]。有研究显示,在大约三分之一的成年NAFLD 患者中可观察到肝脏铁储备的增加,其可通过增加氧化应激和脂质代谢来促进疾病的发生和进展[28]。在本研究中,给予高脂饲料喂养后,NAFLD 大鼠肝组织铁离子含量、MDA、ROS 水平显著升高,而GSH 含量显著降低,同时油红O 染色和普鲁士蓝染色结果表明大鼠肝脏中有大量的脂质积累和铁沉积;说明NAFLD 大鼠肝组织出现脂质过氧化和铁过载,这与已有的报道一致。通过查阅文献,高脂饲料喂与主要铁摄取蛋白转铁蛋白受体1(transferrin receptor-1, TfR-1)的表达增加有关,可诱导肝脏铁过载,促进脂肪变性的发展[29]。给予铁死亡抑制剂可抑制肝脏脂质过氧化及其相关的细胞死亡,从而降低NASH 的严重程度[30]。本研究结果显示,经Met治疗后,NAFLD 大鼠的抗氧化防御能力增强,脂质积累和铁沉积显著减少;提示Met 可减少铁依赖性脂质过氧化物的积累,具有抑制铁死亡的作用。然而,其抑制铁死亡的分子机制尚不清楚。
铁死亡是一种由脂质过氧化驱动的铁依赖性氧化细胞死亡。各种抗氧化系统在防止脂质过氧化介导的铁死亡中起重要作用,尤其是系统胱胺酸/谷胺酸逆向转运体/GSH/Gpx4 轴[26]。系统胱胺酸/谷胺酸逆向转运体是一种反向转运蛋白,它输出谷氨酸盐,同时输入胱氨酸以转化为半胱氨酸用于GSH 合成;Gpx4是一种脂质修复酶,是铁死亡的主要调节者,可利用GSH 干扰脂质过氧化反应。而Gpx4 的表达受Nrf2 的调节,当受到外界氧化应激因子刺激后,Nrf2与其抑制蛋白Keap1 解离活化,进入细胞核,启动其下游靶基因如SOD、Gpx4、xCT和HO-1等的表达,发挥抗氧化作用[31-32]。Nrf2/HO-1 信号通路在NAFLD的进展中发挥着重要作用;激活Nrf2/HO-1 通路可改善脂质功能障碍,保护肝脏免受NAFLD 的侵害[33]。钟桂玲等[34]的研究显示通过激活Nrf2,上调Gpx4 的表达,可降低细胞内氧化应激,抑制RSL3(一种铁死亡诱导剂)诱导的心肌细胞铁死亡;这就提示我们Nrf2/Gpx4 通路的激活可抑制铁死亡。本研究结果显示,Met 可上调NAFLD 大鼠肝组织中Nrf2、HO-1、Gpx4、xCT 的表达;而且Nrf2 抑制剂brusatol 能明显逆转Met 对Nrf2/Gpx4 通路的激活作用以及对NAFLD 大鼠肝脏的保护作用,提示Met 可能通过激活Nrf2/Gpx4通路,抑制铁死亡,保护肝脏免受损伤。
综上所述,本研究结果表明Met 对NAFLD 大鼠肝脏的保护作用可能与其抑制细胞铁死亡有关,机制可能与激活Nrf2/Gpx4 通路有关。然而本研究尚存在一定不足,未对Nrf2上游通路进行研究,亦有研究显示激活AMPK通路可抑制铁死亡[35],而Met是一种公认的AMPK 激动剂[36],AMPK 是否为其上游机制,有待进一步研究。

