基于肠道菌群探讨电针对APP/PS1小鼠认知能力的改善机制*
廖冬梅, 庞 芳, 杨云昊, 夏青倩, 李 怡, 郭 啸, 唐成林△
(重庆医科大学 1中医药学院,2基础医学院,重庆 400016)
阿尔茨海默病(Alzheimer disease,AD)是一种年龄相关的,进行性发展的神经退行性疾病,主要表现为记忆学习能力减退,执行功能障碍及焦虑抑郁等神经精神症状[1-2]。随着对AD 发病机制的深入,研究表明该病可能是一种慢性中枢神经系统炎症反应性疾病,神经炎症反应处于该病病理过程的中心位置[3-6]。研究显示,AD 小鼠存在肠道菌群的改变和肠源性炎症反应,通过神经、内分泌和免疫等途径,肠道菌群可以调控其脑部的淀粉样变性和神经炎症反应[7-10]。通过调控肠道菌群的组成,恢复肠道微生态环境的平衡,抑制肠源性炎症反应以减轻中枢神经炎症反应也是目前缓解AD 的途径之一。研究表明,电针可以调控AD 小鼠的中枢神经炎症反应,改善其认知功能[11-12]。然而其改善AD 小鼠认知能力的作用与肠道菌群间的关系尚不明确,故本实验采用电针干预APP/PS1小鼠,观察其对小鼠结肠组织中核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)、结肠组织及血清中肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素1β(interleukin-1β,IL-1β)和IL-18 含量及肠道菌群的影响,探讨电针改善AD 小鼠认知能力的可能机制。
材 料 与 方 法
1 实验动物与分组
14 只SPF 级5 月龄雄性APP/PS1双转基因小鼠及7 只同月龄雄性C57BL/6 小鼠,体质量(29±3)g,均购于南京君科生物工程有限公司,许可证号为SCXK(苏)2017-0003。代养于恒温恒湿、12 h/12 h明暗交替、自由摄取食物和水的重庆医科大学IVC 级动物房内。适应性喂养1周后,将APP/PS1小鼠随机分为模型(model)组和电针(electroacupuncture,EA)组,以C57BL/6 小鼠作为对照(control)组,每组7 只。所有动物在实验操作中的处理均符合重庆医科大学实验动物伦理委员会规定。
2 主要试剂及仪器
华龙牌针灸针(0.17 mm×7 mm,北京大名科技有限公司);6805-AⅡ电针治疗仪(广州佳誉医疗器械有限公司)。NLRP3 抗体(Novus);β-actin 抗体(Affinity);小鼠TNF-α、IL-1β 和IL-18 酶联免疫分析试剂盒(江苏晶美);Morris 水迷宫(重庆医科大学药学院提供);SMART 3.0 视频跟踪平台软件(HARVARD APPARATUS)。
3 干预方法
电针组:将小鼠俯卧位固定于解剖板上,选取“百会”、“大肠俞”和“足三里”穴交替进行电针干预,选穴参考《实验针灸学》[13]。“百会”、单侧“大肠腧”为一组,对侧“大肠俞”及同侧“足三里”为一组,“足三里”隔日交替使用,同侧腧穴分别连接电针仪一对正负极,连续波,频率2 Hz,电流强度1.0 mA,于上午9点开始干预,每日1 次,每次15 min,1 周5 次,连续5周。模型组和对照组小鼠给予相同的抓取操作,不做其他处理。
4 检测方法及观测指标
4.1 小鼠粪便收集及检测 干预结束后,于超净台上,采用腹部逼迫法收集小鼠新鲜粪便于无菌冻存管中,每次收集完成后立即将粪便样本放入液氮中,随后放入-80 ℃冰箱储存。样品16S rDNA 检测由上海中科新生命生物科技有限公司完成。采用CTAB法对小鼠粪便样本的总基因DNA 进行提取,并通过1%的琼脂凝胶对DNA 的纯度和浓度进行检测。根据测序区域的选择,使用带Barcode 的特异引物和高保真DNA 聚合酶对选定的V3-V4 可变区进行PCR扩增。PCR 产物用2%琼脂糖凝胶电泳检测,并对目标片段切胶回收。根据电泳检测结果,进行PCR 扩增,回收产物后用QuantiFluor™-ST 蓝色荧光定量系统进行定量检测,根据相应样本的测序量要求,按不同比例混合。使用NEBNext®Ultra ™DNA Library Prep Kit 建库试剂盒构建文库,并通过Agilent Bioanalyzer 2100 和Qubit进行质检,质检合格后上机测序;对测序的有效数据进行OTUs 聚类和物种分类,基于OTU 的结果,使用STAMP 分析各组间菌属的丰度,获得显著性差异菌属;使用QIIME 计算α 多样性指数包括Shannon、Chao1 和Goods_coverage 指数,并绘制Shannon 曲线;运用R 包进行PCOA 分析并绘图。
4.2 Morris水迷宫 5周干预结束后,采用Morris水迷宫评估各组小鼠的认知能力[14]。按照东西南北四个方向将水池均分为4 个象限(SW、NW、NE 和SE),每个象限池壁上均贴有颜色形状区别明显的标记物,实验过程中标记物的位置固定不变,池壁外周悬挂帘布以减小实验人员的干扰。实验时在NE 象限放置一个圆柱形的平台(直径6 cm,高14 cm),并将水注入池内,水温恒定在(24±2)℃,水的高度以高于平台1 cm 为宜。正式实验前1 d,将小鼠带至实验房间内,放在水迷宫平台上10 s 以适应环境,以SW 象限为入水点让每只小鼠在水池内自由游泳60 s,以排除小鼠视力、运动障碍对实验结果的干扰。
4.2.1 定位航行实验 将各组小鼠按尾部编号依次从4个象限面壁放入水中,记录每只小鼠在4个象限从入水到游上平台所用的时间(逃避潜伏期),若60 s 内小鼠未游上平台,引导其找到平台,并于平台上学习30 s,逃避潜伏期记为60 s。定位航行实验训练5 d。
4.2.2 空间探索实验 训练第6 天时撤除平台,将小鼠直接从SW 象限(NE 象限的对侧)放入水池,记录60 s 内其穿越平台的次数。空间探索实验训练1 d。
4.3 取材方法 行为学检测结束后,所有小鼠采用异氟烷吸入麻醉,固定四肢,打开腹腔,暴露腹主动脉,用1 mL 无菌注射器从腹主动脉处缓慢吸取血液后,置于促凝管内静置离心。打开胸腔,暴露心脏,于心尖处进针至主动脉弓内,注入0.01 mol/L 的PBS溶液,同时剪开右心耳,使血液流出至肝脏变为浅棕色,清澈液体从右心耳流出后,于冰上沿着胃幽门端向下找到一囊状物(盲肠),取下其后约3 cm 的结肠组织。结肠组织采用PBS溶液冲洗后,置于-80 ℃冰箱储存。
4.4 ELISA 检测各组小鼠血清及结肠TNF-α、IL-1β和IL-18 含量 每只小鼠分别称取20 mg 结肠组织,加入适量PBS 溶液,充分匀浆后收集上清液,分装备检。具体操作按说明书进行。
4.5 Western blot 检测小鼠结肠NLRP3 蛋白表达采用RIPA 裂解液提取结肠组织总蛋白,BCA 试剂盒检测蛋白浓度,根据浓度配制蛋白样品,并于SDSPAGE 上分离,随后转膜,封闭,于4 ℃摇床上孵育Ⅰ抗过夜(NLRP3:1∶1 000;β-actin:1∶1 000),Ⅱ抗(1∶10 000)室温孵育1 h,ECL 化学发光成像,Image J 分析并计算目的蛋白相对表达量。
5 统计学处理
使用GraphPad Prism 8.0 和SPSS 25 处理数据。结果以均数±标准差(mean±SD)形式表示。所有数据符合正态分布则采用单因素方差分析,重复测量资料采用重复测量的方差分析;进一步两两比较时,方差齐用Bonferroni法,方差不齐采用Dunnett T3法;不符合正态分布的数据,采用Kruskal-Wallis 检验,菌群结果则采用Wilcox 检验;STAMP 结果采用Welch检验。以P<0.05为差异有统计学意义。
结果
1 Morris水迷宫实验
1.1 定位航行实验 随着训练天数的增加,各组小鼠逃避潜伏期总体均呈下降趋势。从第2 天开始,与对照组比较,模型组逃避潜伏期延长(P<0.05),第3 天开始,模型组小鼠逃避潜伏期显著延长(P<0.01);与模型组比较,随着训练天数的增加,电针组逃避潜伏期的下降趋势更为显著,且在第5 天,其逃避潜伏期显著缩短(P<0.05)。见图1A。
1.2 空间探索实验 与对照组比较,模型组小鼠穿越平台次数显著减少(P<0.01);与模型组比较,电针组穿越平台次数增加(P<0.05)。见图1B。

Figure 1. Comparison of escape latency(A)and number of crossing the platform(B)in each group of mice. Mean±SD.n=7.*P<0.05,**P<0.01vs control group;#P<0.05vs model group.图1 各组小鼠逃避潜伏期和穿越平台次数比较
2 结肠组织中NLRP3蛋白的表达
与对照组比较,模型组小鼠结肠组织中NLRP3表达显著增高(P<0.01);与模型组比较,电针组NLRP3表达降低(P<0.05)。见图2。

Figure 2. Comparison of expression of NLRP3 in colon of mice in each group. Mean±SD.n=4.**P<0.01vs control group;#P<0.05vs model group.图2 各组小鼠结肠组织中NLRP3表达的比较
3 结肠组织中炎症因子的含量
与对照组相比,模型组结肠组织中TNF-α、IL-1β和IL-18 含量显著增高(P<0.01);与模型组相比,电针组TNF-α、IL-1β 和IL-18 含量降低(P<0.05)。见图3。

Figure 3. Comparison of the contents of TNF-α,IL-1β and IL-18 in colon of mice in each group. Mean±SD.n=7.**P<0.01vs control group;#P<0.05vs model group.图3 各组小鼠结肠组织中TNF-α、IL-1β和IL-18含量比较
4 血清炎症因子含量
与对照组相比,模型组血清TNF-α、IL-1β 和IL-18 含量显著增高(P<0.01);与模型组相比,电针组血清TNF-α、IL-1β 和IL-18 含量降低(P<0.05)。见表1。

表1 各组小鼠血清TNF-α、IL-1β和IL-18含量的比较Table 1. Comparison of the contents of TNF-α,IL-1β and IL-18 in serum of mice in each group(ng/L. Mean±SD.n=7)
5 肠道菌群多样性分析
Shannon指数结果显示(表2),与对照组相比,模型组小鼠Shannon 指数降低,肠道菌群多样性减少,电针干预后,其Shannon指数增高,菌群多样性增加,但差异均无统计学意义;Chao1 指数结果显示(表2),与对照组相比,模型组Chao1 指数降低,肠道菌群数目减少(P<0.05),电针干预后,Chao1 指数增高,菌群数目增加(P<0.05);Goods_coverage 指数各组无明显变化,见表2;Shannon 曲线结果及PCOA 分析结果见图4,3 组组内各样本间距离较小,组间各样本间距离较大。
6 门水平菌群组成分析
在门水平,3 组小鼠粪便菌群均以Bacteroidetes(拟杆菌门)和Firmicutes(厚壁菌门)为主,两者相对丰度总和在对照组、模型组、电针组中分别占比97.17%,98.17%和94.46%。除此之外,丰度排名前10 的菌群还有Actinobacteria(放线菌门)、Proteobacteria(变形菌门)、Epsilonbacteraeota、Verrucomicrobia(疣微菌门)、Patescibacteria、Deferribacteres(脱铁杆菌门)、Cyanobacteria(蓝藻菌门)和Tenericutes(软壁菌门)。与对照组相比,模型组小鼠粪便拟杆菌门相对丰度增高(P<0.05),厚壁菌门、Patescibacteria和软壁菌门相对丰度降低(P<0.05),电针干预后拟杆菌门相对丰度轻度降低,厚壁菌门、Patescibacteria、软壁菌门相对丰度轻度升高,但差异较模型组均无统计学意义。见图5。

Figure 5. Relative abundance of microbiota in top 10 at the phylum level in each group.n=6.图5 各组在门水平排名前10的菌群的相对丰度
7 组间差异菌属的STAMP分析
在属水平,各组菌群分析结果见图6。与对照组相比,模型组Lactobacillus(乳杆菌)、Candidatus Saccharimonas、Ruminiclostridium 6(瘤胃梭菌6)、Ruminococcaceae UCG-014(瘤胃球菌UCG-014)、Ruminiclostridium 9(瘤胃梭菌9)、Parabacteroides(副拟杆菌)、Christensenellaceae R-7 group、Eubacterium nodatum group、Family ХШ AD3011 group、Ruminococcaceae UCG-004、GCA-900066225、UBA1819、A2、Candidatus Soleaferrea、Anaerofustis(厌氧菌)(均P<0.05)相对丰度显著降低(P<0.05);uncultured Bacteroidales bacterium、Others、uncultured organism、Rikenella(理研菌)、Coriobacteriaceae UCG-002(红蝽菌UCG-002)(均P<0.01)、Parasutterella(副萨特氏菌)、Marvinbryantia、Ruminococcus torques group相对丰度增高(P<0.05)。与模型组相比,电针组副萨特氏菌、Streptococcus(链球菌)、Rikenella、Caulobacter相对丰度降低(P<0.05);Muribaculum、Candidatus Saccharimonas、Adlercreutzia、mouse gut metagenome、uncultured diatom、hgcl clade、Cyanobium PCC-6307、metagenome、Candidatus Methylopumilus、Microcystis PCC-7914相对丰度增高(P<0.05)。

Figure 6. STAMP analysis of differential microflora between the control group and the model group(A),the model group and the EA group(B)at the genus level.n=6. The bar plot shows mean proportions of differential microflora at genus level,the difference in proportions between the groups is shown with 95%confidence intervals,and onlyP<0.05 are shown.图6 对照组与模型组及模型组与电针组在属水平差异菌群的STAMP分析
在属水平,三组乳杆菌、双歧杆菌和副拟杆菌相对丰度比较结果见图7,与对照组相比,模型组乳杆菌和副拟杆菌相对丰度降低(P<0.05),双歧杆菌相对丰度稍有降低,但差异无统计学意义(P>0.05);电针干预后,三者丰度增高,但差异均无统计学意义(P>0.05)。
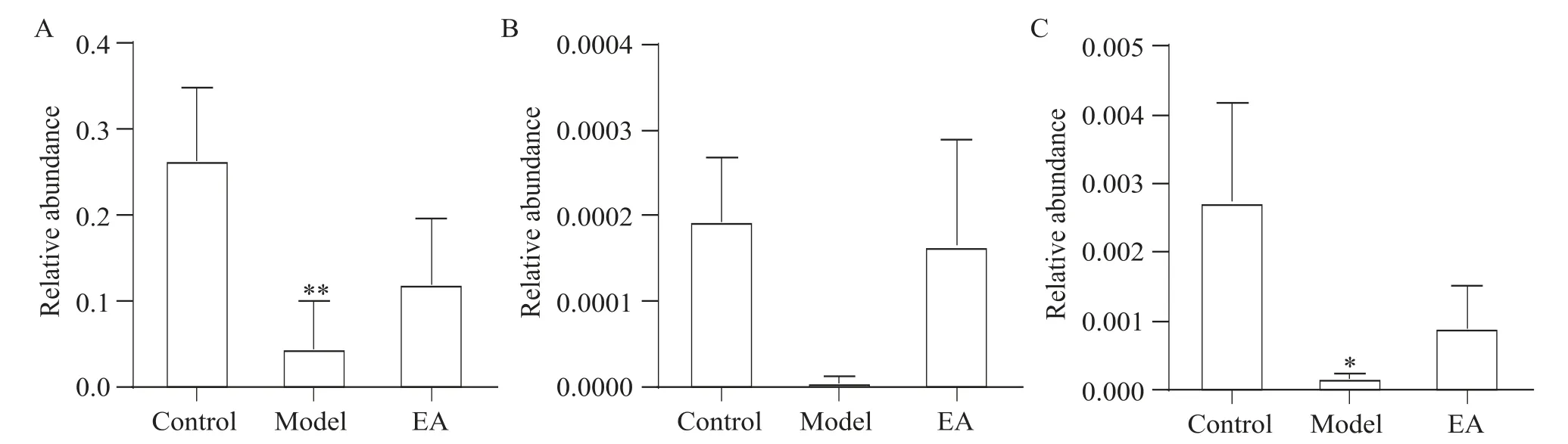
Figure 7. Comparison of relative abundance ofLactobacillus(A),Bifidobacterium(B)andParabacteroides(C)among different groups at genus level. Mean±SD.n=6.*P<0.05,**P<0.01vs control group.图7 各组属水平乳杆菌、双岐杆菌和副拟杆菌相对丰度比较
讨论
AD 是一种老年人常见的神经精神类疾病,认知能力下降是其早期的症状之一。研究显示[15],外周血炎症反应是认知能力下降的危险因素,其与年龄相关的认知能力下降正相关。作为替代医学的组成部分,电针被广泛用于神经精神类疾病的治疗,并被证实通过调节肠道菌群,借助于“微生物-肠-脑轴”改善衰老大鼠的认知障碍和中枢神经炎症反应[16]。与以往仅关注AD 小鼠脑部病变的研究不同,本实验以“微生物-肠-脑轴”为着眼点,探讨电针对AD 小鼠肠道菌群及相关炎症因子的影响,分析电针改善其认知障碍的可能机制。
作为胃肠道两大优势菌门,厚壁菌门和拟杆菌门比值(F/B)的增加或减少分别与肥胖、炎症性肠病的发展有关[17]。Cui等[18]认为,厚壁菌门丰度与胃肠道炎症负相关,在溃疡性结肠炎小鼠中F/B 值降低,推测F/B 值的降低与结肠炎症性反应有关。本实验粪便菌群组成结果显示,APP/PS1小鼠粪便拟杆菌门丰度增加,厚壁菌门丰度降低,F/B 值降低,电针治疗在一定程度上可提高其F/B 值。表明APP/PS1小鼠肠道可能存在炎症反应,而电针治疗可以通过调节厚壁菌门、拟杆菌门的丰度来改善其肠道炎症反应。
研究表明[19],在急性坏死性胰腺炎和药物诱导性关节炎大鼠粪便中,Candidatus Saccharimonas丰度降低,且其与IL-17 和TLR4 等炎症相关蛋白的水平负相关,推测其在维持肠道的正常功能中发挥作用。Chen等[20]观察到,在肠易激综合征小鼠粪便中,副拟杆菌属丰度降低,副萨特氏菌属丰度增高,且副拟杆菌属与肠道慢性炎症负相关,副萨特氏菌属与肠道慢性炎症正相关。同时研究显示[21],理研菌与IL-2 和IL-4 等炎症因子正相关,并与慢性全身性炎症性疾病相关,表明其可能促进炎症反应。作为炎症过程的启动器,NLRP3能识别病原体并被其激活,导致IL-1β 和IL-18 等炎症因子释放,引起炎症级联反应[22]。在本研究中,APP/PS1小鼠粪便中Candidatus Saccharimonas、副拟杆菌属丰度降低,副萨特氏菌属、理研菌属丰度增高,促炎菌与抗炎菌失衡,肠道菌群微环境破坏,NLRP3被过度激活,其下游炎症因子IL-1β、TNF-α 和IL-18 过度释放,肠道慢性炎症反应明显,外周血炎症因子IL-1β、TNF-α 和IL-18 水平显著增高,电针干预后,上述促炎菌丰度降低,抗炎菌丰度增高,促炎菌与抗炎菌趋近平衡,肠道微环境向正常状态转换,NLRP3表达被抑制,下游炎症因子释放减少,肠道和外周血炎症反应减轻,表明电针可能通过调控肠道菌群,抑制其导致的炎性小体的激活和炎症因子的释放,发挥抗炎保护作用,减轻肠源性和外周血炎症反应。
研究表明[23-25],外周血TNF-α 和IL-1β 水平增高可导致血脑屏障(blood brain barrier,BBB)紧密连接蛋白claudin-5 和ZO-1 表达降低,且其与血管内皮细胞TNF-α 和IL-1β 受体结合后可损伤内皮细胞并诱导基质金属蛋白酶2 和9 表达,破坏基底膜成分,导致BBB 结构破坏,通透性增加。BBB 通透性增加后,外周血炎症因子及有害物质进入脑组织,导致小胶质细胞或相关炎症反应通路激活,诱发中枢神经炎症反应,引起神经元损伤,认知能力下降[16,26]。研究显示[27-29],AD小鼠BBB紧密连接蛋白ZO-1、claudin-5和occludin 表达降低,BBB 通透性增加,而电针治疗可以上调上述蛋白的表达,改善小鼠BBB 结构。He等[16]证实电针刺激还可降低衰老大鼠血清IL-1β、TNF-α和LPS的水平,上调BBB 中ZO-1的表达,降低BBB 通透性,抑制海马LPS 的表达和TLR4/NF-κB 通路的激活,发挥抗炎和保护海马神经元的作用,改善大鼠的认知障碍。由此推测电针治疗改善AD 小鼠认知障碍的机制可能也与调节BBB 结构及通透性,减轻外周炎症因子所致中枢炎症通路的激活,减少神经元损伤有关。
本实验研究结果显示,除炎症相关菌群改变外,APP/PS1小鼠粪便乳杆菌、双歧杆菌、Muribaculum等与认知相关的菌群丰度也降低。研究表明[30]乳杆菌、双歧杆菌与γ-氨基丁酸(γ-aminobutyric acid,GABA)的产生密切相关。GABA 是脑组织中的一种抑制性神经递质,与神经系统功能的发育相关,GABA系统的功能紊乱会导致认知功能损伤[31];相关分析显示[32],Muribaculum相对丰度与APP/PS1小鼠认知功能正相关。本实验结果显示,电针干预后APP/PS1小鼠逃避潜伏期缩短,空间探索能力提高,肠道Muribaculum相对丰度显著增高,乳杆菌、双岐杆菌相对丰度也呈上升趋势,表明电针可能通过增加认知相关菌属的丰度来改善AD小鼠的认知能力。
综上所述,电针改善APP/PS1 小鼠认知障碍的机制可能与其调控肠道菌群,降低结肠NLRP3 蛋白表达和结肠、外周血IL-1β、IL-18 和TNF-α 水平,减轻肠源性及外周血炎症反应,从而降低认知障碍的危险因素有关。但炎症反应与认知障碍间的具体关系以及电针治疗在其中的作用机制仍需我们进一步研究。

