天香丹对内皮细胞氧化损伤及抗氧化因子和eNOS水平的影响①
辛锦钰,张亚洁,古丽葛娜·萨吾尔,何 欢,任 珊,安冬青
(新疆医科大学中医学院;新疆名医名方与特色方剂学重点实验室,乌鲁木齐 830011)
冠脉微循环是由前小动脉、微动脉、微静脉和毛细血管组成的循环网络结构,担负调控心肌血流量和外周血管阻力的重要作用,生理状态下,可通过调节血管舒缩、内在肌源性反应和物质代谢等来保证局部血流与组织代谢供需相匹配[1],当其结构或功能发生障碍时,血流阻力增加,冠脉血流储备下降,积累日久可损害心肌灌注,致使心肌纤维化甚或心肌坏死[2-3],这一病理过程即为冠脉微循环功能障碍(coronary microcirculation dysfunction,CMD)。研究显示,CMD是冠心病患者发生心肌缺血的重要原因,在没有明显心外膜冠状动脉阻塞情况下,它可导致50%的慢性冠状动脉综合征患者心肌缺血情况加剧[4],同时它也与不良心血管事件的发生密切相关[5-6]。内皮功能障碍是CMD发生发展的重要病理机制,而氧化应激是内皮功能障碍形成的主要影响因素。在氧化应激状态下,氧自由基产生增加,触发线粒体功能障碍、钙超载、DNA损伤和心肌膜脂质过氧化,最终可导致细胞死亡[7]。大量研究证实,中医药在改善患者微循环功能,提高患者生活质量方面具有独特优势[8-9],用于CMD治疗具有良好发展前景。天香丹是新疆医科大学附属中医医院的院内制剂,多年来一直应用于冠心病及心肌缺血综合征的临床治疗,疗效确切[10-11]。该方由红景天、丹参、降香和新塔花组成,方中红景天为君,丹参为臣,两药合用,气血互生,降香与新塔花性味辛香,中医理论中辛香类药材可走窜通络,达到开痹止痛的作用。既往研究显示,红景天苷具有抗氧化、抗缺氧等药理作用[12],丹参多酚盐可抑制ROS的产生[13],降香与新塔花也皆具有抗氧化应激,保护血管内皮的作用[14-15]。本课题组前期研究已表明,天香丹可有效改善CMD动物的心肌损伤[16]。本研究采用叔丁基过氧化氢(tert-butyl hydroperoxide,tBHP)诱导制备人脐静脉内皮细胞(HUVECs)氧化损伤模型,探究其对CMD的相关作用机制,现报道如下。
1 材料与方法
1.1 试药天香丹颗粒(新疆华世丹药业有限公司,批号:Z20200820),维生素C(北京索莱宝科技有限公司,批号:A8100),内皮细胞培养基(美国ScienCell公司,批号:1001),胰蛋白酶(美国Gibco公司,批号:25200-056),青霉素-链霉素(美国Gibco公司,批号分别为:25200-056),PBS(美国Hyclone公司,批号:SH30256.01),四甲基偶氮唑盐(MTT,北京索莱宝科技有限公司,批号:M8180),二甲基亚砜(DMSO,北京索莱宝科技有限公司,批号:D8370),超氧化物歧化酶(SOD)测定试剂盒(南京建成生物工程研究所,批号:A001-3-2),乳酸脱氢酶(LDH)试剂盒(南京建成生物工程研究所,批号:A020-2),微量还原型谷胱甘肽(GSH)测定试剂盒(南京建成生物工程研究所,批号:A006-2-1),人8羟基脱氧鸟苷Elisa试剂盒试剂盒(上海江莱生物有限公司,批号:JL11850),人内皮型一氧化氮合酶Elisa试剂盒(上海江莱生物有限公司,批号:JL11316)。
1.2 仪器MSC-Advantage生物安全柜,Multiskan GO多功能酶标仪(美国Thermo公司),Sigma3-30K低温高速离心机(美国Sigma公司)。
1.3 细胞株人脐静脉血管内皮细胞(HUVECs,购于上海赛百慷生物技术股份有限公司)。
1.4 方法
1.4.1 HUVECs的培养方法 用含有10%胎牛血清、1%双抗(青霉素-链霉素)和1%内皮细胞生长因子的内皮细胞培养液,在37°C、5%CO2的培养箱中培养人脐静脉内皮细胞,每2~3天传代1次,取对数生长期的活跃细胞进行实验。
1.4.2 tBHP对HUVECs存活率的影响 当培养瓶中HUVECs密度达到80%~90%时,用胰蛋白酶进行消化,1 000 r/min离心5 min得到细胞沉淀。用内皮细胞培养液重悬细胞,接种于96孔板中,使每孔细胞数为1.5×104个,置于培养箱中培养,待细胞贴壁完全且密度达到80%~90%后弃去旧培养液。将细胞分为调零组、对照组、tBHP组 60 μmol/L 、tBHP组 120 μmol/L 、tBHP组180 μmol/L 和tBHP组240 μmol/L ,每组4个复孔,除调零组(不含细胞)和对照组(含细胞)加200 μL无血清培养液外,其他各组分别加入等体积含对应不同浓度tBHP的无血清培养液。将96孔板置于培养箱中孵育24 h,随后各孔加入20 μL MTT溶液,培养4 h,弃去上清,加入150 μL DMSO溶液,使蓝紫色甲臜充分溶解,酶标仪492 nm波长处测各孔吸光度A值,计算各组细胞存活率,实验重复3次,细胞存活率/%=[(A实验组-A调零组)/(A对照组-A调零组)]×100%。
1.4.3 天香丹对HUVECs活性的影响 培养瓶中HUVECs密度达到80%~90%时,用胰蛋白酶进行消化,1 000 r/min离心5 min得到细胞沉淀。内皮培养液重悬细胞后,按每孔1.5×104个将细胞均匀接种于96孔板中,待细胞贴壁完全且密度达到80%~90%后弃去旧培养液,并将细胞分为6组(调零组、对照组、天香丹30、60、90、120 μg/mL浓度组),每组4个复孔,调零组不含细胞只加200 μL无血清培养液,对照组含细胞并加等体积无血清培养液,其余各组分别加入等体积含对应不同浓度天香丹的无血清培养液。将96孔板置于培养箱中孵育24 h,按“1.4.2”项下MTT法检测各组细胞活性,每组重复3次,细胞活性/%=[(A实验组-A调零组)/(A对照组-A调零组)]×100%。
1.4.4 天香丹对tBHP诱导的HUVECs存活率的影响当培养瓶中HUVECs长至80%~90%时,用胰蛋白酶进行消化、离心,重悬细胞沉淀,按每孔1.5×104个将细胞均匀接种于96孔板中,待细胞密度达到80%~90%后弃去旧培养液,将细胞分为调零组、对照组、模型组、维生素C组(50 μg/mL)和低、中、高(30、60、90 μg/mL)剂量天香丹组,其中调零组、对照组、模型加入200 μL无血清培养液,维生素C组和天香丹低、中、高剂量组分别加入等体积含对应不同浓度药物的无血清培养液,预处理12 h后弃去培养液,加入240 μmol/L tBHP作用24 h。按“1.4.2”项下MTT法检测各组细胞存活率,每组重复3次。细胞存活率/%=[(A实验组-A调零组)/(A对照组-A调零组)]×100%。
1.4.5 HUVECs中LDH、SOD、GSH含量的测定 按每孔3×105个的密度将HUVECs均匀接种于96孔板中,待细胞密度达到80%~90%时按“1.4.4”项下方法处理细胞,tBHP诱导24 h后,收集各组别胞,按试剂盒说明书操作测定各组细胞中LDH、SOD和GSH的含量。
1.4.6 HUVECs中8OHdG、eNOS含量的测定 将HUVECs均匀接种于96孔板上,按“1.4.4”项下方法处理细胞,tBHP诱导24 h后,收集各组细胞培养液,1 000 r/min离心20 min,取上清液,按说明书操作测定各组细胞中8OHdG和eNOS的含量。
1.5 统计学处理采用SPSS 26.0和Graph Pad Prism 8.0统计软件进行统计分析,计量资料以均数±标准差(±s)表示,组间差异采用单因素方差分析和LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度tBHP对HUVECs存活率的影响与对照组相比,tBHP 60 μmol/L浓度组HUVECs存活率无明显变化,差异无统计学意义(P>0.05),tBHP 120、180、240 μmol/L浓度组HUVECs存活率均降低,差异有统计学意义(P<0.05),见表1。
表1 不同浓度tBHP对HUVECs存活率的影响(±s,n=3)
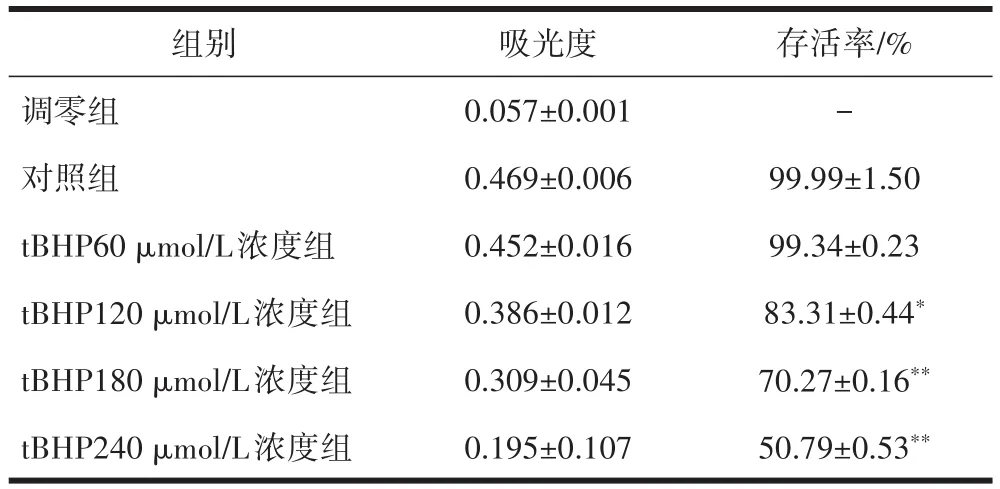
表1 不同浓度tBHP对HUVECs存活率的影响(±s,n=3)
注:与对照组相比,*P<0.05,**P<0.01。
组别调零组对照组tBHP60 μmol/L浓度组tBHP120 μmol/L浓度组tBHP180 μmol/L浓度组tBHP240 μmol/L浓度组存活率/%-99.99±1.50 99.34±0.23 83.31±0.44*70.27±0.16**50.79±0.53**吸光度0.057±0.001 0.469±0.006 0.452±0.016 0.386±0.012 0.309±0.045 0.195±0.107
2.2 天香丹对HUVECs活性的影响与对照组相比,天香丹30、60 μg/mL浓度组HUVECs细胞活性无明显变化,差异均无统计学意义(P>0.05);天香丹90、120 μg/mL浓度组HUVECs细胞活性均降低,差异有统计学意义(P<0.01),见表2。
表2 不同浓度天香丹对HUVECs活性的影响(±s,n=3)

表2 不同浓度天香丹对HUVECs活性的影响(±s,n=3)
注:与对照组相比,**P<0.01。
组别 吸光度 细胞活性/%调零组0.057±0.001-对照组0.675±0.019100.00±3.05天香丹30 μg/mL浓度组0.659±0.016101.19±2.40天香丹60 μg/mL浓度组0.630±0.01796.57±1.50天香丹90 μg/mL浓度组0.574±0.02187.62±0.37**天香丹120 μg/mL浓度组0.499±0.02275.74±1.25**
2.3 天香丹对tBHP诱导的HUVECs存活率的影响与对照组相比,模型组HUVECs存活率降低,差异有统计学意义(P<0.05);与模型组相比,维生素C组和天香丹低、中、高剂量组HUVECs存活率均升高,差异均有统计学意义(P<0.05);与维生素C组相比,天香丹低剂量组HUVECs存活率升高,差异无统计学意义(P>0.05),天香丹中、高剂量组HUVECs存活率均升高,差异有统计学意义(P<0.05),见表3。
表3 天香丹对tBHP诱导的HUVECs存活率的影响(±s,n=3)

表3 天香丹对tBHP诱导的HUVECs存活率的影响(±s,n=3)
注:与对照组相比,*P<0.05;与模型组相比,#P<0.05,##P<0.01;与维生素C组相比,^P<0.05,^^P<0.01。
存活率/%-100.00±6.13 49.34±2.45*^64.51±2.39#66.63±2.73#79.52±1.00##^84.63±1.53##^^组别调零组对照组模型组维生素C组天香丹低剂量组天香丹中剂量组天香丹高剂量组吸光度/A 0.057±0.001 0.553±0.030 0.205±0.023 0.330±0.023 0.356±0.020 0.430±0.019 0.489±0.014
2.4 天香丹对tBHP诱导的HUVECs细胞LDH、SOD、GSH的影响与对照组相比,模型组细胞LDH释放量上升,SOD活性和GSH含量下降,差异有统计学意义(P<0.01);与模型组相比,维生素C和天香丹各剂量组LDH释放量下降,SOD活性和GSH含量上升,差异有统计学意义(P<0.01);与维生素C组相比,天香丹各剂量组SOD活性和GSH含量均上升,差异有统计学意义(P<0.05),天香丹中高剂量组LDH释放量下降,差异有统计学意义(P<0.01),天香丹低剂量组LDH释放量下降,差异无统计学意义(P>0.05),见表4。
表4 天香丹对各组HUVECs细胞LDH、SOD和GSH的影响(±s,n=3)
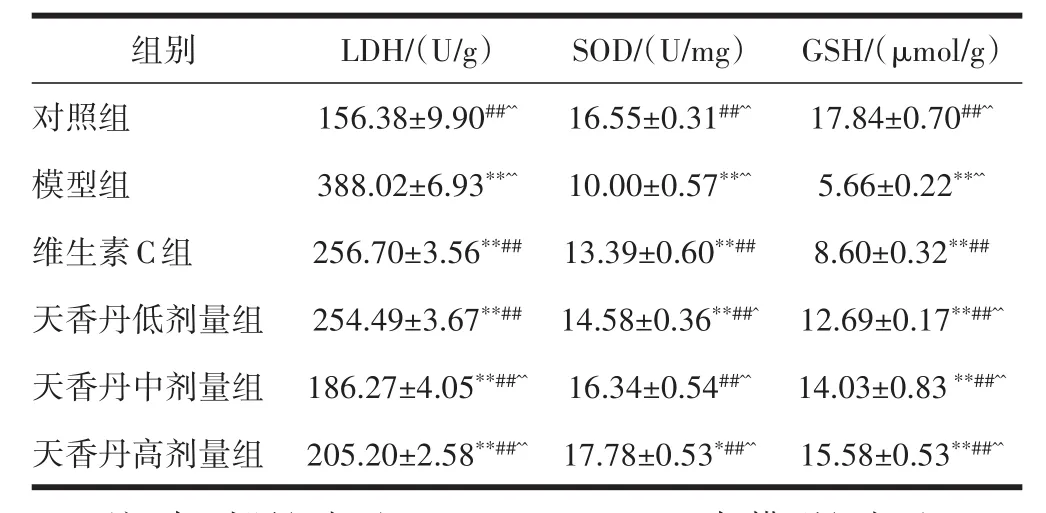
表4 天香丹对各组HUVECs细胞LDH、SOD和GSH的影响(±s,n=3)
注:与对照组相比,*P<0.05,**P<0.01;与模型组相比,#P<0.05,##P<0.01;与维生素C组相比,^P<0.05,^^P<0.01。
组别对照组模型组维生素C组天香丹低剂量组天香丹中剂量组天香丹高剂量组GSH/(μmol/g)17.84±0.70##^^5.66±0.22**^^8.60±0.32**##12.69±0.17**##^^14.03±0.83**##^^15.58±0.53**##^^LDH/(U/g)156.38±9.90##^^388.02±6.93**^^256.70±3.56**##254.49±3.67**##186.27±4.05**##^^205.20±2.58**##^^SOD/(U/mg)16.55±0.31##^^10.00±0.57**^^13.39±0.60**##14.58±0.36**##^16.34±0.54##^^17.78±0.53*##^^
2.5 天香丹对tBHP诱导的HUVECs细胞8OHdG和eNOS的影响与对照组相比,模型组细胞eNOS水平降低,8OHdG水平升高,差异有统计学意义(P<0.01);与模型组相比,维生素C组及天香丹各剂量组细胞eNOS水平均上升,8OHdG水平均下降,差异有统计学意义(P<0.05);与维生素C组相比,天香丹低剂量组8OHdG和eNOS水平无明显变化,差异无统计学意义(P>0.05),天香丹中高剂量组8OHdG水平降低,eNOS水平升高,差异有统计学意义(P<0.05),见表5。
表5 天香丹对各组HUVECs细胞8OHdG和eNOS的影响(±s,n=3)

表5 天香丹对各组HUVECs细胞8OHdG和eNOS的影响(±s,n=3)
注:与对照组相比,*P<0.05,**P<0.01;与模型组相比,#P<0.05,##P<0.01;与维生素C组相比,^P<0.05,^^P<0.01。
eNOS/(ng/mL)8.34±0.45##^^4.83±0.47**^6.06±0.51**#6.38±0.58**##7.08±0.17*##^7.48±0.76##^^对照组模型组维生素C组天香丹低剂量组天香丹中剂量组天香丹高剂量组11.73±0.34##^^13.75±0.09**^^13.01±0.04**##12.91±0.17**##12.20±0.20**##^^12.13±0.05*##^^组别8OHdG/(ng/mL)
3 讨论
CMD在心血管疾病中普遍存在,在心肌缺血缺氧、高血脂等病理因素作用下,内皮活性因子的产生和释放受到影响,内皮功能出现异常,微血管顺应性调节失常,可进一步导致CMD的恶性循环[17-18]。氧化应激是内皮功能障碍的重要诱因,tBHP是常见的体外氧化应激模型诱导剂,较H2O2具有稳定性强,不易分解的优点[19-20]。研究显示,山楂酸可通过降低LDH释放,提高SOD活性和GSH含量,减轻H2O2导致的细胞损伤[21]。本研究采用tBHP诱导HUVECs建立氧化损伤模型,细胞存活率显著降低,细胞膜受损严重,LDH释放量升高,DNA经氧化修饰,8OHdG水平升高,SOD的活性、GSH的含量及eNOS的水平均下降,提示此时细胞抗氧化能力不足,氧化与抗氧化系统失衡,内皮细胞结构与功能均发生障碍。
维生素C是天然抗氧化剂的一种,具有极强的还原型,有研究显示,其可有效抑制氧化应激诱导的HUVECs死亡,本研究将其作为阳性对照药,研究结果也与其他研究结果相符[22]:经过维生素C预处理后,与模型组相较,细胞存活率逐渐上升,LDH释放量和8OHdG的水平有所下降,eNOS的水平则有所上升,提示此时细胞膜及细胞中DNA分子的氧化损伤程度较轻,内皮功能得到改善,氧化应激受到一定程度的抑制。与维生素C组相比,HUVECs经天香丹不同剂量组预处理后,细胞存活率、SOD的活性、GSH的含量和eNOS水平均有上升,LDH释放量和8OHdG的水平均有下降,天香丹对HUVECs氧化损伤和内皮功能具有改善作用,这种改善作用随剂量加大而增强。综上所述,天香丹对HUVECs氧化损伤具有抑制作用,在一定程度上能够改善内皮功能,这与细胞抗氧化能力的增强有关,本研究为天香丹防治CMD提供了实验依据。

