CYP7B1 和CYP4B1 基因mRNA在不同毛色贵州剑白香猪皮肤组织中的表达分析
石钰仕,陈 伟 *,覃 海,王 康,洪 星
(1. 贵州大学高原山地动物遗传育种与繁殖教育部重点实验室,贵州 贵阳 550025;2. 贵州大学贵州省动物遗传育种与繁殖重点实验室,贵州 贵阳 550025; 3. 贵州大学动物科学学院,贵州 贵阳 550025)
剑白香猪是我国珍稀猪种,被农业农村部列为国家二级稀有保护畜种,主产地在贵州省黔东南苗族侗族自治州剑河县,当地称为“两头乌”,头部和尾部毛色为黑色,中间为白色,因其肉味鲜香、肉质细嫩而闻名[1]。相关研究发现,黑色素细胞对动物毛色的形成有至关重要的作用,哺乳动物的毛色由黑色素细胞产生的真黑素和褐黑素在组织中的含量和分布所决定。近年来的研究表明,一些基因的表达对黑色素的形成起着至关重要的作用,如TYR、TYRP1、SOX10等基因的表达均与黑色素沉积相关[2]。CYP7B1(cytochrome P450 family 7 subfamily B member 1,细胞色素P450家族7亚家族B成员1)和CYP4B1(cytochrome P450 family 4 subfamily B member 1,细胞色素 P450家族4亚家族B成员1)是细胞色素CYP450酶系家族的成员。而CYP7B1和CYP4B1基因在不同组织中表达出不同的生物学功能,如在肝组织中CYP7B1与胆汁酸的合成有关,在脑组织中含量较高,并且通过脱氢表雄酮 (DHEA) 和孕烯醇酮这2种神经甾体作为底物来调控相关激素的合成分泌[3];CYP4B1对多种脂溶性、内源性和外源性化合物有强烈的氧化催化作用[4]。有研究表明,CYP450家族成员基因在皮肤组织中发挥着巨大的作用[5];CYP3A4与P糖蛋白能减少有害物质在表皮细胞的聚集,从而构成了皮肤药物生物利用度屏障[6]。对于皮肤组织中CYP7B1和CYP4B1基因的研究鲜见报道。本研究采用实时荧光定量PCR(qRT-PCR)分析CYP7B1和CYP4B1基因在贵州剑白香猪黑色和白色皮肤组织中的表达水平,以了解CYP7B1和CYP4B1基因在猪黑色和白色皮肤组织中的表达规律,以期为进一步研究其在猪皮肤组织中的功能提供数据基础。
1 材料与方法
1.1 试验样品分别采集贵州大学猪场的3头剑白香猪耳组织部位的黑色和白色皮肤组织样品,用锡箔纸包装后置于液氮罐内短暂保存,随后移至实验室分别提取2个组织样品的总RNA,置于冰箱-80 ℃保存。
1.2 主要仪器凝胶电泳图像分析系统(购自美国Bio-Rad公司,型号ChemiDoc XRS)、荧光定量PCR仪(购自美国Bio-Rad公司,型号CFX96)、PCR扩增仪(购自美国ABI公司,型号GeneAmp9600)、电泳仪(购自北京六一仪器厂,型号DYY-2C)。
1.3 主要试剂Trizol试剂、SYBR Green supermix(购自美国Life technologies公司);DL 2 000 DNA Marker(购自宝生物工程有限公司);反转录试剂盒(HiFiScript cDNA Synthesis Kit)、2×EsTaqMasterMix、核酸染料(购自北京康为试剂科技有限公司)。
1.4 方法
1.4.1 引物以CYP7B1基因(GeneBank ID:10073 8003)和CYP4B1基因(GeneBank ID:100523909)的mRNA序列为参考序列,采用prime 5.0软件设计CYP7B1、CYP4B1特异引物(由上海生工生物技术有限公司合成)。引物信息见表1。

表1 荧光定量引物序列、退火温度及产物长度
1.4.2 总RNA提取和cDNA合成通过Trizol法分别提取2个样品组织的总RNA,再根据反转录试剂盒(HiFiScript cDNA Synthesis Kit)说明书方法进行反转录,分别合成CYP7B1、CYP4B1的cDNA,反应体系(20 μL)见表2。反应程序:42 ℃保温15 min,加入反转录酶(HiFiScript)后42 ℃孵育30 min,85 ℃灭活5 min。

表2 cDNA合成反应体系
1.4.3 qRT-PCR应用SYBR Green荧光染料法进行qRT-PCR反应,反应体系25 μL:2×UltraSYBR Mixture 12.5 μL,上、下游引物各0.5 μL,cDNA 1 μL,ddH2O 10.5 μL。每个样品设3个重复。反应程序:95 ℃预变性10 min;95 ℃变性15 s,56 ℃退火1 min,共40个循环。循环结束后进行熔解曲线分析,步骤如下:95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s,60 ℃ 15 s。
1.4.4 数据统计与分析将荧光定量Ct值导入WPS 2019进行整理,应用2-△△CT法对整理数据进行分析。
2 结果
2.1 RNA提取与PCR扩增结果分析 用微量紫外分光光度计分别测定黑色和白色皮肤组织的RNA,D260 nm/D280 nm介于1.9~2.1,浓度分别为1 398 ng/μL和1 001 ng/μL,可进行后续测试。qRT-PCR扩增结果显示:在黑色皮肤组织中出现274 bp左右的特异性条带与CYP4B1cDNA长度相符(见图1);出现362 bp左右的特异性条带与CYP7B1cDNA长度相符(见图2)。在白色皮肤组织中没有出现相应的特异性条带。扩增序列测序比对结果显示:2条序列分别为CYP4B1、CYP7B1cDNA(见图3、图4)。
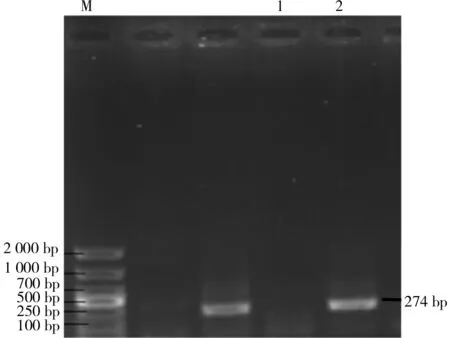
M:DL 2 000 DNA Marker;1:白色皮肤组织;2:黑色皮肤组织图1 CYP4 B1qRT-PCR扩增产物电泳
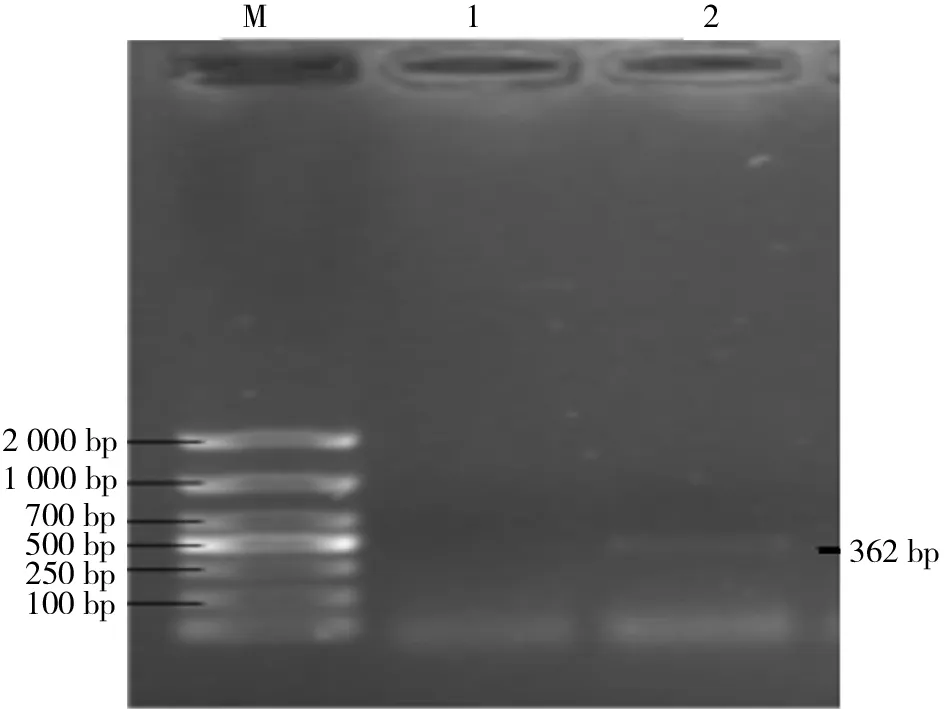
M:DL 2 000 DNA Marker;1:白色皮肤组织;2:黑色皮肤组织图2 CYP7 B1qRT-PCR扩增产物电泳

图3 CYP4 B1测序比对结果

图4 CYP7 B1测序比对结果
2.2 目的基因扩增由图5、图6、图7可见:CYP4B1、CYP7B1、GAPDH基因扩增曲线拐点清晰,斜率较高,表明CYP4B1和CYP7B1基因扩增效率较高;熔解曲线均为光滑的单峰曲线,且退火温度附近无明显杂峰,引物特异性、重现性好,无明显引物二聚体出现,符合试验要求,说明2个基因qRT-PCR结果可信度高。

图5 CYP4 B1基因qRT-PCR的熔解曲线和扩增曲线

图6 CYP7 B1基因qRT-PCR的熔解曲线和扩增曲线
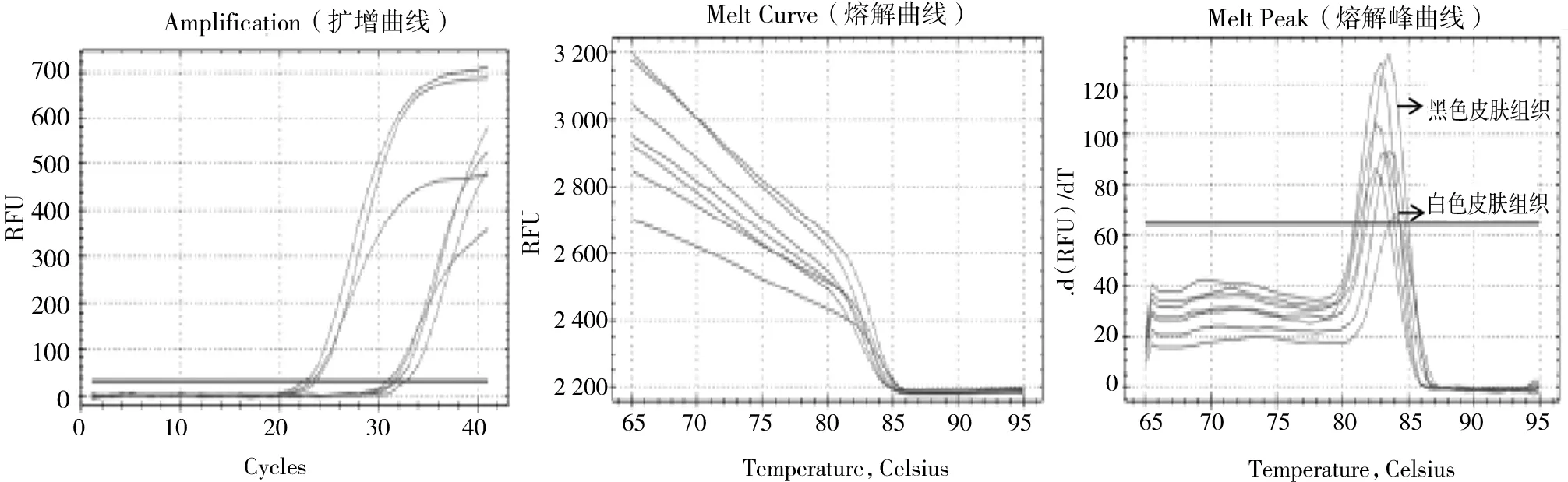
图7 GAPDH基因qRT-PCR的熔解曲线和扩增曲线
2.3 目的基因的表达利用2-△△CT法对qRT-PCR的Ct值进行处理,得到CYP7B1、CYP4B1基因在剑白香猪皮肤组织中的相对表达量。由图8、图9可见:CYP7B1、CYP4B1基因在剑白香猪黑色皮肤组织的表达量均高于白色皮肤组织。
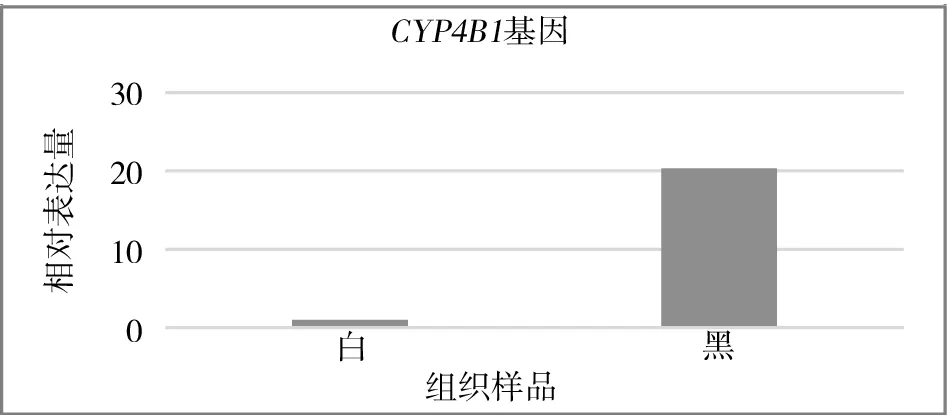
图8 CYP4 B1基因在黑色和白色皮肤组织中的相对表达
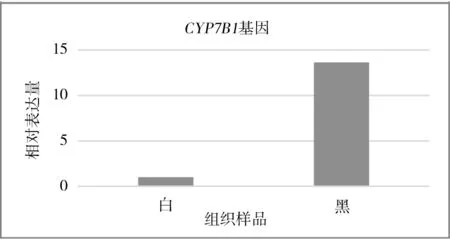
图9 CYP7 B1基因在黑色和白色皮肤组织中的相对表达
3 结论
本研究通过qRT-PCR分析了CYP7B1、CYP4B1基因在剑白香猪的黑色和白色皮肤组织中的表达水平,结果表明CYP7B1、CYP4B1基因在黑色皮肤组织中均有较高的表达量,而在白色皮肤组织中几乎不表达。因此推测CYP7B1基因和CYP4B1基因可能与香猪黑色皮肤的形成有关。
4 讨论
CYP7B1基因和CYP4B1基因与生物体内的许多生理功能息息相关。Zhu Qiqi等[7]通过利用放射性底物检测DHEA和7αOHD对Leydig细胞和微粒体11β- HSD1活性的影响,并通过免疫组织化学染色、Western blot和实时荧光定量PCR鉴定CYP7B1在Leydig细胞中的定位,发现脱氢表雄酮及其CYP7 B1代谢物7α-羟基脱氢表雄酮可调节大鼠Leydig细胞11β-羟基类固醇脱氢酶1方向。Shi Shui-Zhen等[8]通过研究27-HC和TAMs在乳腺癌中的关系发现,CYP7 B1的高甲基化可能参与了乳腺癌中27-羟基胆固醇的积累。Genta Kakiyama等[9]通过对线粒体CYP27A1启动的胆固醇代谢酸性途径的研究,证明了线粒体氧化甾醇生物合成途径为CYP7 B1作为调节氧化甾醇的控制器。Wan-Su Choi等[10]利用小鼠研究骨关节炎发病机制的分子机制时提出,软骨细胞胆固醇代谢的CH25H-CYP7 B1-RORα轴是骨关节炎发病的关键分解代谢调节因子。Hanna Pettersson 等[11]研究发现了CYP7 B1参与1种以前未知的消除3α-己二醇的机制,可能影响细胞内双氢睾酮和GABA(A)调节类固醇的水平。从上述研究中可以看出,CYP7B1基因和CYP4B1基因是众多生物体内极为重要的组成成分,直接或间接参与生物体内新陈代谢过程并发挥了不可代替的作用,其在生物体内所具有的其他尚未发现的功能具有非常大的研究价值。目前关于CYP450家族在皮肤组织中的研究相对较少,CYP4B1基因和CYP7B1基因在皮肤组织中的研究也非常少,这更需要进一步研究以了解其在皮肤组织中到底扮演什么样的角色。

