A型产气荚膜梭菌感染绿壳蛋鸭的病理发生学研究
蔡海情,吕绍亮,袁盛林,文 明,2,3*
(1. 贵州大学动物科学学院,贵州 贵阳 550025; 2. 贵州大学动物疫病研究所,贵州 贵阳 550025;3. 贵州省动物生物制品工程技术研究中心,贵州 贵阳 550025)
产气荚膜梭菌(Clostridiumperfringens)又称魏氏梭菌,由美国病理学家W.H.韦尔奇等于1892年从死亡动物尸体中分离鉴定并命名[1]。产气荚膜梭菌在自然界分布广泛,存在于土壤、污水、动物和人的肠道及粪便中,是1种人畜共患病原菌。根据产生主要毒素(α、β、ε、ι、NetB、CPE)的不同,分为7种类型(A~G型)[2]。产气荚膜梭菌能分解动物肌肉组织和结缔组织中的糖类,产生大量气体导致组织气肿,继而影响血液供应,造成组织大面积坏死,从而引起动物胃肠道疾病(坏死性肠炎、肠出血症等),特别是感染家禽后,可造成养禽业的重大经济损失,成为危害家禽养殖产业健康发展的重要病原之一[3~5]。张彤宇等[6]研究表明,华东部分地区水禽感染A型产气荚膜梭菌的阳性检出率高达68.75%,且水禽只携带A型产气荚膜梭菌。相关研究在对雏鸭感染鸭肠炎病毒(Duck enteritis virus,DEV)后检测其肠道菌群多样性时发现,随着感染时间的增加,种间菌群相当丰富度中产气荚膜梭菌的丰富度逐渐升高[7],而二者在引起的组织病变上存在相似之处,所以推测该菌在DEV感染雏鸭后期对病程发展存在助推作用。有文献报道山东省4个鸭场均检测出A型产气荚膜梭菌[8],但依旧无法明确解释A型产气荚膜梭菌感染与DEV之间共感染的关系。本试验开展A型产气荚膜梭菌感染鸭的病理发生学研究,以明确该菌对鸭的感染性,及感染后各组织的病变特征和发展规律,为阐明A型产气荚膜梭菌感染鸭的相关作用机理提供参考。
1 材料与方法
1.1 实验动物、菌种及试剂1日龄健康清洁级绿壳蛋鸭30只(购自贵州省贵阳绿源禽业有限公司);A型产气荚膜梭菌菌种、1%葡萄糖鲜血培养基(贵州大学动物疫病研究所惠赠);液体硫乙醇酸盐培养基(FT)(购自杭州微生物试剂有限公司)。
1.2 主要仪器单人双面净化工作台(型号SW-CJ-1F,苏州安泰空气净化设备有限公司)、隔水式电热恒温培养箱(型号QYC-2012C,上海贺德实验设备有限公司)、台式高速冷冻离心机(型号G2235 110134,丹麦 LABOGENE公司)、包埋机(型号JB-P5,武汉俊杰电子有限公司)、病理切片机(型号RM2016,上海徕卡仪器有限公司)、光学显微镜(日本 OLYMPUS公司)、恒温摇床(型号HZQ-X100,上海豫明仪器有限公司)。
1.3 方法
1.3.1 试验分组将30只1日龄健康雏鸭按试验要求饲养至30日龄后,随机分为对照组和试验组(分组后再适应性饲养7 d),每组15只。人工感染分3个时段(96、120、144 h),每时段各5只。
1.3.2 菌种复苏与增菌将-20 ℃保存的A型产气荚膜梭菌菌种取出并恢复至室温(25 ℃),取菌液1 mL于无菌FT液体培养基中,50 r/min 37 ℃恒温培养12 h后,用麦氏比浊法调整菌液浓度为1.0×108CFU/mL,每日培养的菌液限当日使用。
1.3.3 人工感染、临床症状观察与组织样品采集试验组雏鸭用A型产气荚膜梭菌菌液灌喂,2次/d,每次8 mL/只,2次灌喂之间隔6 h,每次灌喂前、后禁水、禁食2 h(对照组用生理盐水做同样处理),连续灌喂4 d,每隔6 h观察1次雏鸭的精神、采食、饮水、粪便情况并记录。分别在感染96、120、144 h后解剖并观察雏鸭组织病变,对病变部位、渗出液进行细菌分离培养,并采集十二指肠、空肠、回肠组织样品置于4%多聚甲醛中固定12~24 h。
1.3.4 组织病理切片制作将采集的组织从固定液中取出,在通风橱内用手术刀将目的部位组织修平整后用流水冲洗12 h,经梯度酒精脱水、透明、浸蜡、包埋、切片、贴片、烤片和脱蜡。具体操作过程:(1)脱水与透明。将流水冲洗好的组织取出并放入75%乙醇溶液中脱水10 min→80%乙醇溶液脱水10 min→95%乙醇溶液Ⅰ脱水10 min→95%乙醇溶液Ⅱ脱水15 min→100%乙醇溶液Ⅰ脱水10 min→100%乙醇溶液Ⅱ脱水10 min→二甲苯溶液Ⅰ透明30 min→二甲苯溶液Ⅱ透明30 min。(2)浸蜡与包埋。将已被二甲苯透明处理的组织放入融化的石蜡中,45 min左右后取出,放入包埋盒中并用加热的镊子调整位置,排出其中的小气泡,将包埋盒放置于冷凝板上,待其完全凝固成块前将预先准备好的标签插入其中,凝固好后将蜡块取出常温保存。(3)切片。将取出的蜡块用刀片修整为规整的方形,在连续切片机上切成厚度为5 μm的蜡带。(4)贴片与烤片。将蜡带用毛笔轻托置于水温为39 ℃的展片机中,待其展平后捞至涂抹薄层蛋白甘油的洁净载玻片上铺平(注意铺平位置要控制好),随后用滤纸吸去多余水分后置于60 ℃的烤片机上烘干。(5)脱蜡。将石蜡切片置于二甲苯溶液Ⅰ20 min→二甲苯溶液Ⅱ20 min→100%乙醇溶液Ⅱ10 min→100%乙醇溶液Ⅰ10 min→95%乙醇溶液Ⅱ5 min→95%乙醇溶液Ⅰ5 min→85%乙醇溶液5 min→70%乙醇溶液5 min→流水冲洗3 min。(6)染色。将上述流水处理后的切片进行HE染色与固定,用苏木素染色40 min→微流水冲洗2 min→1%盐酸水溶液分化5~10 s(可观察到切片由蓝变红)→流水缓慢冲洗返蓝5~10 min→0.5%伊红水溶液染色0.5~1 min→中性树胶封片(注意将载玻片背侧伊红溶液擦干,滴上树胶后盖玻片从一侧放入,避免产生气泡)→显微镜镜检,图像采集分析。
2 结果
2.1 人工感染雏鸭症状及病变观察对雏鸭连续灌喂A型产气荚膜梭菌菌液72 h后开始出现腹泻症状,但精神、采食、饮水未表现异常。96 h后雏鸭出现精神萎靡、羽毛凌乱、采食下降、腹泻症状加重、饮水增加的情况;解剖观察发现雏鸭部分组织间有纤维素性渗出液。120 h后雏鸭出现反应迟钝、扎堆、采食饮水下降、粪便变为褐色的情况;解剖观察发现纤维素性渗出加重,部分组织伴有出血点和坏死,十二指肠、空肠、回肠有明显的臌气和出血点。144 h后雏鸭出现死亡;解剖发现十二指肠、空肠、回肠出现坏死。灌喂生理盐水的对照组未表现异常。
2.2 病变组织细菌分离培养鉴定将纤维素性渗出液、严重病变组织用接种环无菌接种于1%葡萄糖鲜血培养基,50 r/min 37 ℃恒温培养12 h,出现圆形、凸起、光滑、灰白色、边缘整齐的菌落(见图1);革兰氏染色镜检为革兰氏阳性菌,呈细直杆状,两端钝圆(见图2),与人工感染的A型产气荚膜梭菌相同。
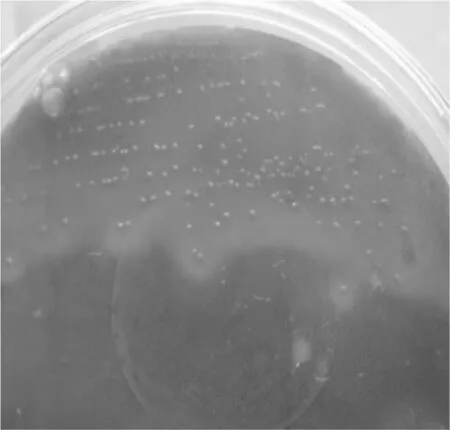
图1 培养菌落
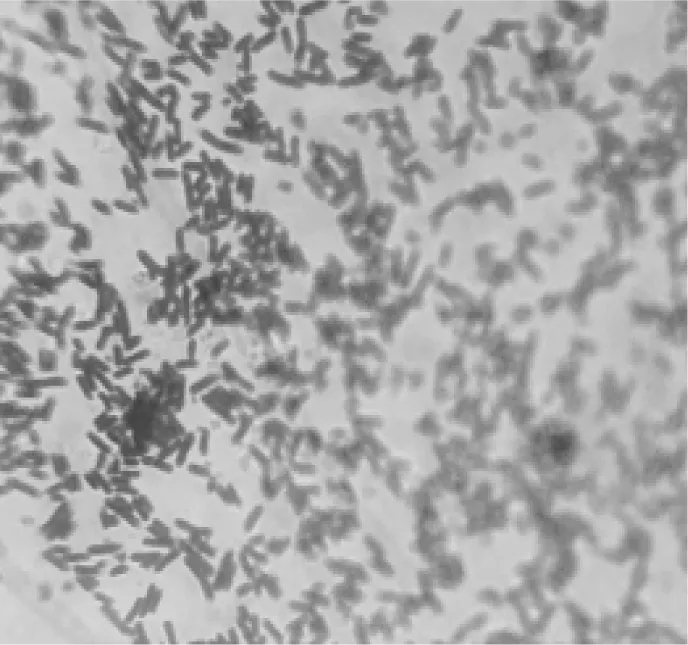
图2 革兰氏染色菌体
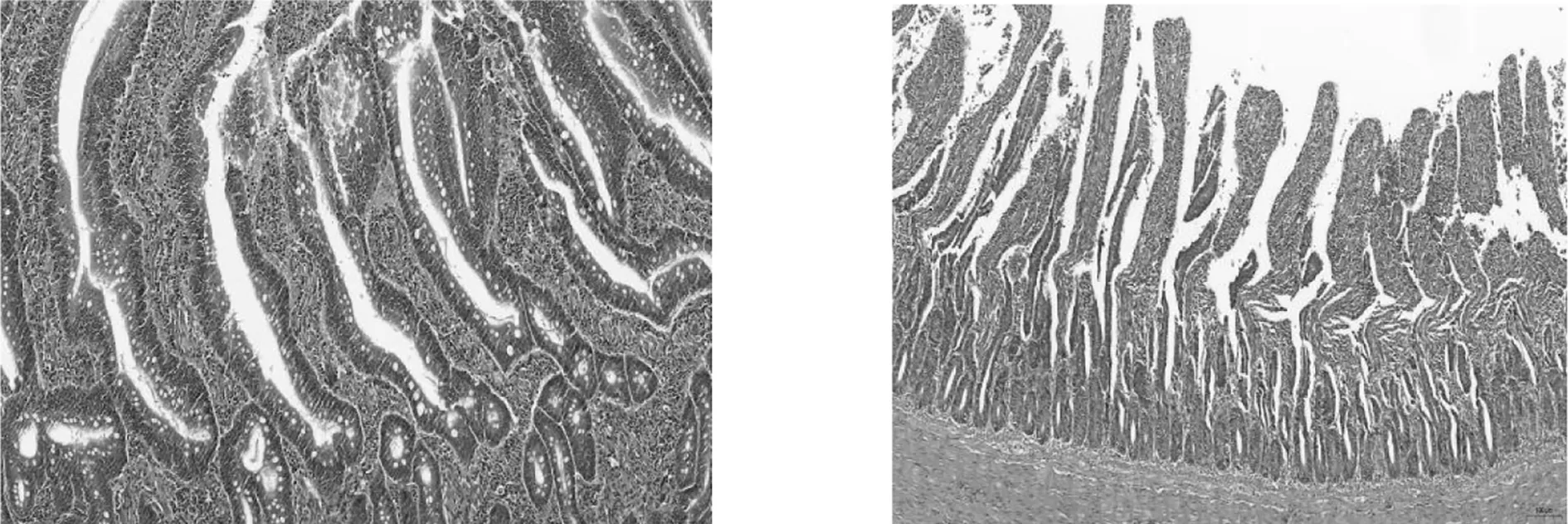
2.3 组织病理切片观察对雏鸭连续灌喂A型产气荚膜梭菌菌液144 h后,引起十二指肠、空肠、回肠不同程度的病变:十二指肠肠腔充满变性、脱落、坏死的上皮细胞,肠绒毛发生崩解脱落,并有血细胞和少量炎性细胞浸润,间杂大量淋巴细胞(见图3A、B);回肠绒毛总体结构较为完整,但部分肠绒毛发生断裂,并伴有充血现象(见图3C、D);空肠肠腔充满变性、脱落、坏死的上皮细胞,肠绒毛发生崩解脱落,并有血细胞和少量炎性细胞浸润,肌纤维间隙较大、断裂、密度明显减小(见图3E、F)。对照组肠组织切片正常(见图4 A、B、C、D)。
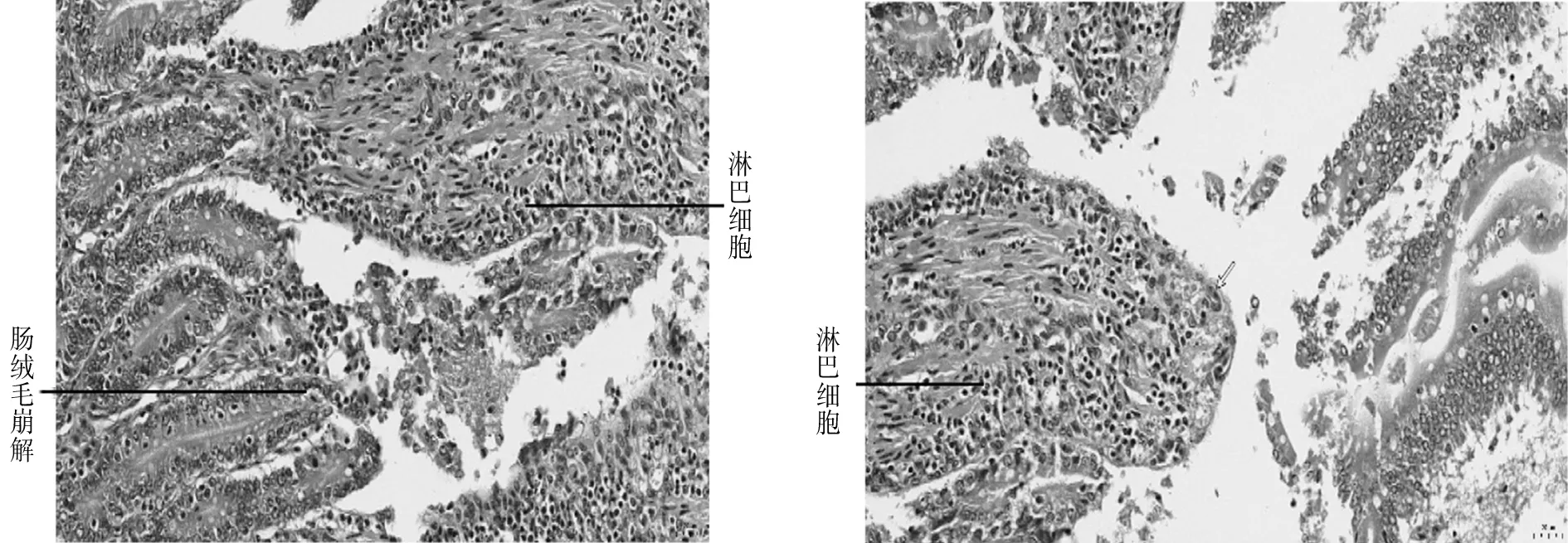
A B
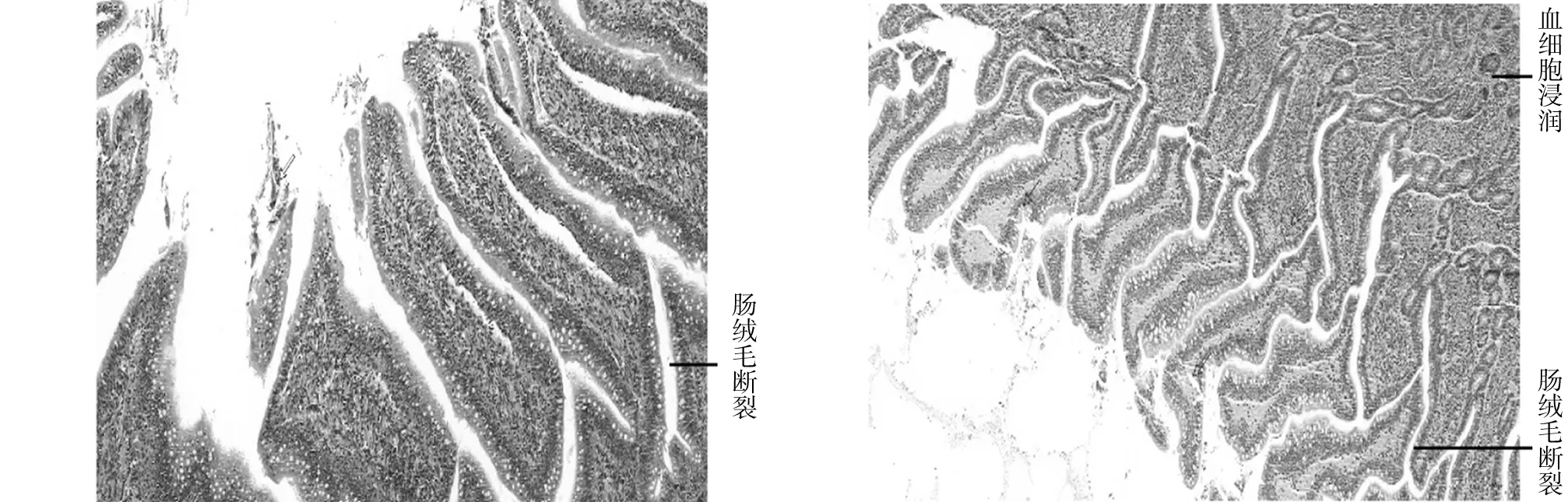
C D
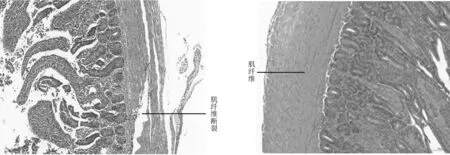
E FA、B:十二指肠; C、D:回肠; E、F:空肠图3 试验组肠组织病理切片
A B
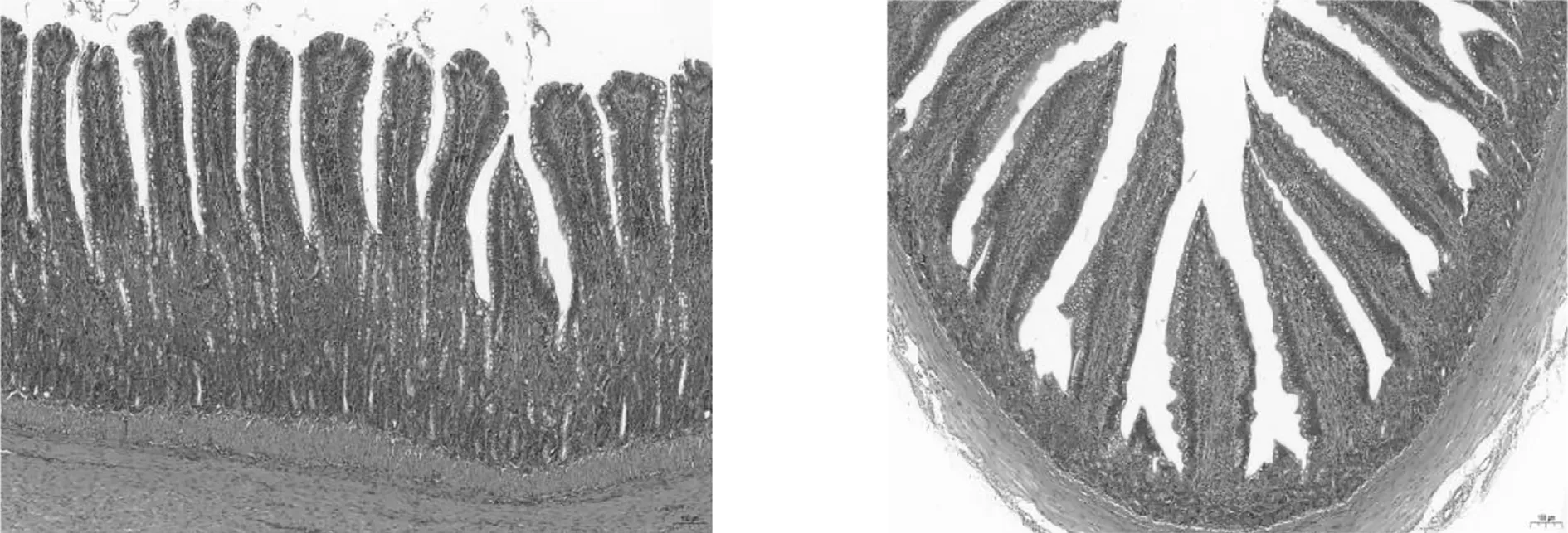
C DA、B:十二指肠; C:回肠; D:空肠图4 对照组肠组织正常切片
3 结论
本试验结果发现,A型产气荚膜梭菌会在鸭肠道内产生气体,引起十二指肠、空肠、回肠不同程度的病变,感染144 h后最为严重。病理变化主要为:十二指肠肠腔上皮细胞变性和坏死,肠绒毛发生崩解脱落,并有血细胞和少量炎性细胞浸润,间杂大量淋巴细胞;回肠绒毛发生断裂,并伴有充血现象;空肠肠腔充满变性、脱落、坏死的上皮细胞,肠绒毛发生崩解、脱落,并有血细胞和少量炎性细胞浸润,肌纤维间隙增大、断裂、密度明显减小;十二指肠、空肠、回肠黏膜出现轻微溃疡灶,发生肠毒血症、坏死性肠炎。
4 讨论
正常情况下,肠道菌群之间、菌群与宿主之间处于动态平衡,从而维持肠道的正常生理功能[7]。当动物机体受到病原微生物侵袭时,肠道菌群动态平衡被破坏,导致肠道有益菌数量减少而有害菌数量增多,同时引起宿主免疫功能下降,从而造成疫病的发生和病情的加重[9,10]。研究发现,产气荚膜梭菌感染鸡后可在小肠段大量增殖并分泌外毒素,导致肠道发生病理性损伤,进而引发坏死性肠炎[11];急性病例的病理变化表现为出血性黏膜溃疡或严重黏膜坏死,从而引发较高的死亡率[12];慢性病例的病理变化表现为十二指肠、空肠和回肠黏膜的轻微溃疡灶,从而导致营养物质消化吸收不良和饲料转化效率降低,严重影响家禽生产性能[13,14]。此外,DEV感染后,鸭肠道中产气荚膜梭菌和坏死梭杆菌均呈先下降后升高趋势[15]。DEV感染鸭的主要病变为血管损伤和消化道黏膜出血、坏死,推测与产气荚膜梭菌和DEV含量升高存在一定的关联,这有待于进一步实验验证。

