制霉菌素口腔糊剂的制备及处方优化
王 婷,张志华* ,李庆年,宋广涛,杨禹祺,林楸艳
(1.湖南省儿童医院药学部,长沙 410007;2.中南大学湘雅药学院药剂学教研室,长沙 410013)
鹅口疮是一种由白念珠菌感染引起的口腔黏膜急性损伤,临床表现为舌头、牙龈、上下颚等黏膜表面形成白色薄膜[1-2],是一种常见的儿童口腔疾病。若不及时治疗,感染范围会不断扩大,累及咽喉和扁桃体,蔓延到支气管、肺部等组织[3],引起食管炎、肺念珠菌病,甚至引起败血症[2]。目前临床上常将市售制霉菌素片剂研磨成粉,稀释成溶液或混悬液涂搽于口腔黏膜,用于鹅口疮的治疗[3-5],存在以下不足:(1)给药频次高,用药依从性不佳;(2)较难控制质量;(3)室温下水溶性混悬剂不稳定。因此,《第二批鼓励研发申报儿童药品清单》中鼓励研发适宜规格的制霉菌素口腔黏膜用糊剂,目前暂无制霉菌素口腔糊剂相关报道。糊剂是指原料药物固体粉末均匀地分散在适宜的基质中所形成的半固体外用制剂[6]。制备制霉菌素口腔糊剂用于临床治疗鹅口疮,具有以下优点:(1)质量可控,用药方便,提高了用药依从性;(2)可延长药物在口腔的作用时间,具有一定的缓释作用和黏附性[7],提高药效,降低用药频率;(3)在常温下具有较好的稳定性,可长期保存。本研究制备了制霉菌素口腔糊剂并优化其处方组成,以期为治疗小儿鹅口疮提供一种适宜的制剂。
1 仪器和试药
1.1 仪器 LRH-250-Y药物稳定性试验箱(韶关泰宏医疗器械有限公司);紫外可见光分光光度计(日本岛津仪器有限公司);DF-101S集热式恒温加热磁力搅拌器(巩义市中天仪器科技有限公司);TGL20M台式高速冷冻离心机(长沙英泰仪器有限公司);100目不锈钢冲框标准筛(长沙市思科仪器纱筛厂);BS323S电子天平和CP255D电子天平(德国Sartorius公司)。
1.2 试药 制霉菌素原料药(批号H15D9Z77402,上海源叶生物科技有限公司);羟丙甲纤维素(批号K1717099,上海阿拉丁生化科技股份有限公司);卡波姆940(批号C10484689,上海麦克林生化科技有限公司);液体石蜡(批号20190329)和凡士林(批号20170509)购自上海国药集团化学试剂有限公司;制霉菌素口腔糊剂(规格:1×105U/g,批号N20120901、N20121001、N20121002、N20121003)由湖南省儿童医院药学部自制。
2 方法和结果
2.1 制备工艺 首先将制霉菌素研磨,过100目筛,称取适量,备用。称取凡士林、液体石蜡适量,置于50 ℃恒温水浴锅中,避光加热熔融,待完全融化后,保持温度50 ℃,避光,依次加入羟丙甲纤维素、卡波姆940,边加边搅拌均匀,最后加入称量好的制霉菌素,搅拌2 min,混匀。密封冷却,即制得约10 g制霉菌素口腔糊剂。
2.2 考察指标 主要采用黏附力、吸水值、赋形性三个指标[8]考察制霉菌素口腔糊剂的单因素试验及全面试验。
2.2.1 黏附力 取30 cm×10 cm玻璃板,斜面上部10 cm及下部15 cm处横向粘贴一块宽度0.5 cm的医用胶带,两胶带间的距离为5 cm,加入糊剂,用刮板使成均匀薄层。将该板自下部缓缓浸于水中至糊剂上沿,立即取出,使与水平面成15°角,1 min后开始测定,试验在1~5 min内完成。将1~10号钢球由大到小自斜面顶端自由滚下,记录黏住的钢球号。钢球型号越大,表明糊剂的黏附力越强,1~4号钢球表明黏附力较小,5~7号钢球表明黏附力符合标准,8~10号钢球表明黏附力过大。
2.2.2 吸水值 精密称取约1 g糊剂,置92%的湿度条件下放置24 h,精密称取吸水后的重量(m1),吸水前的重量(m0),计算吸水值。吸水值=[(m1-m0)/m0]×100%。
2.2.3 赋形性 取1支制霉菌素口腔糊剂,置于37 ℃、相对湿度64%的恒温恒湿箱中30 min,取出,挤出约1 g置于平整的玻璃板上,玻璃板与水平面的倾斜角为60°,放置24 h,观察是否流淌。理想的半固体应该是在赋形性试验中不流淌的最低稠度(即临界流淌),使其既容易从软管中挤出并在口腔溃疡面上涂布,又保持了半固体的形状。
2.3 单因素试验 以黏附力、吸水值及赋形性3个指标,考察了凡士林和液体石蜡的比值(8∶1~1∶1)、羟丙甲纤维素和卡波姆940用量(4~8 g)、羟丙甲纤维素和卡波姆940比值(3∶1~1∶2)、载药量(1×104~1×106U/g)4个单因素。根据黏附力、吸水值、赋形性的测定结果,最后确定凡士林/液体石蜡比值的适宜范围为5∶1~6∶1,羟丙甲纤维素和卡波姆940用量适宜范围为2~4 g,羟丙甲纤维素和卡波姆940比值的适宜范围为1∶1~3∶1,载药量为1×104~1×105U/g时对3个考察指标的影响较小。
2.4 全面试验 根据单因素试验,筛选凡士林和液体石蜡用量比值(5∶1、6∶1)、羟丙甲纤维素和卡波姆940比值(1∶1、2∶1、3∶1)、羟丙甲纤维素和卡波姆940用量(2、3、4 g)3个因素进行全面试验,3个因素分别设为因素A、因素B、因素C,每次试验重复3次,结果见表1。
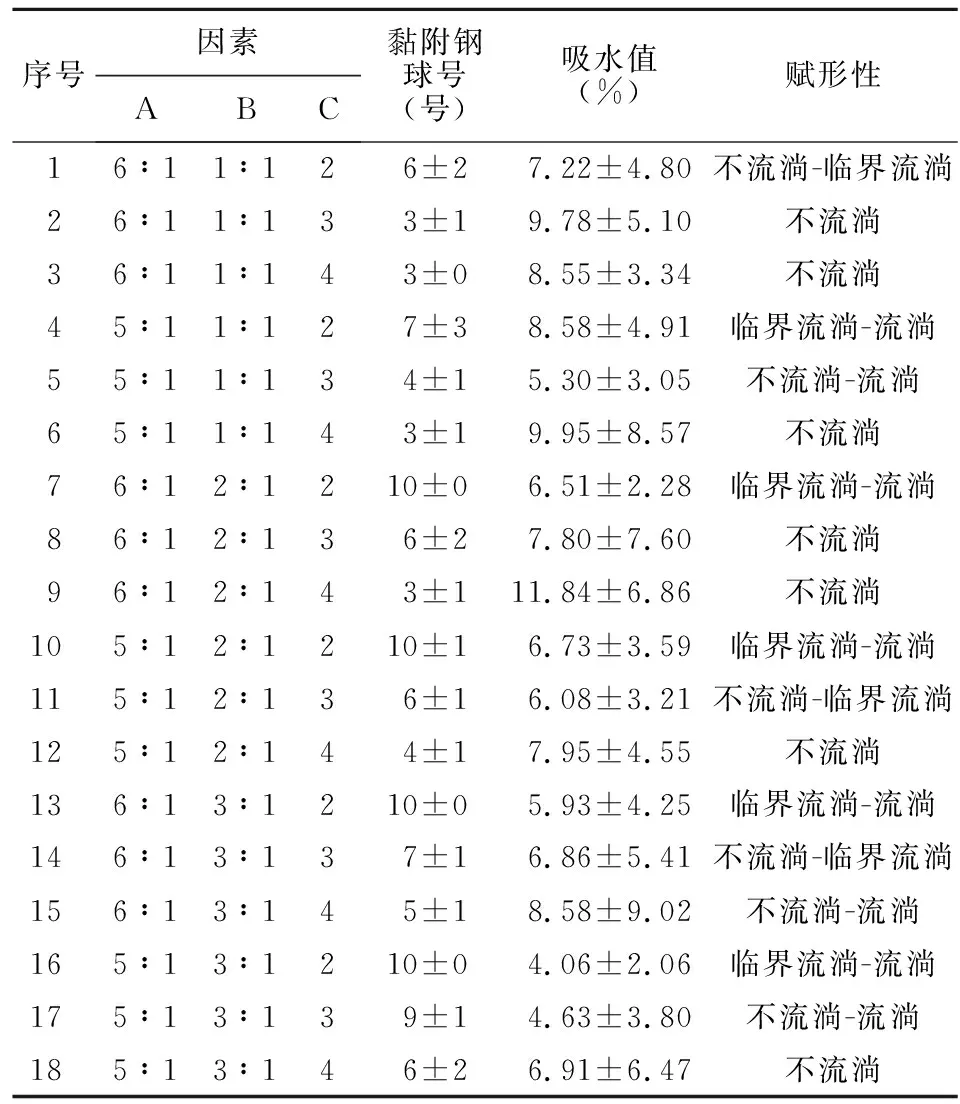
表1 制霉菌素口腔糊剂处方组成的全面试验结果Table 1 The comprehensive test results of nystatin oral paste formula
全面试验中,钢球号为5~7的有处方1、4、8、11、14、15、18共7个处方,其中钢球号的标准差(SD)≤1的有处方11、14和15,处方11、14与15的吸水值分别为(6.05±3.21)%、(6.86±5.41)%及(8.58±9.02)%,处方11及14的赋形性均为不流淌-临界流淌,处方15的赋形性为不流淌-流淌。由于处方11的吸水值SD更小,处方重现性更好,因此优选11号处方。最后确定制霉菌素口腔糊剂的优化处方为载药量1×104~1×105U/g 时,凡士林和液体石蜡用量比值为5∶1,羟丙甲纤维素和卡波姆940比值为2∶1,羟丙甲纤维素和卡波姆940用量为3 g(占处方总量的30%)。
2.5 质量评价 采用11号处方制备载药量为1×105U/g的制霉菌素口腔糊剂,批号分别为N201209101、N20121001、N20121002、N20121003,用于后续的高温实验、离心稳定性研究及含量测定。
2.5.1 离心稳定性 分别取批号为N20121001、N20121002、N20121003的制霉菌素口腔糊剂1 g,各1份,放置于刻度离心管中,以相对离心力6.30×102×g离心15 min,观察有无分层现象。结果3份样品均无分层现象,表明制霉菌素口腔糊剂离心稳定性良好。
2.5.2 含量测定
2.5.2.1 溶液的配制 (1)制霉菌素标准储备液:精密称取制霉菌素1×106U,加入二甲亚砜使之溶解,置100 ml棕色量瓶中定容,摇匀,得到1×104U/ml制霉菌素标准储备液,置4 ℃冰箱储存。(2)制霉菌素标准溶液:精密量取该储备液1 ml置50 ml棕色量瓶中,加入二甲亚砜至刻度,定容,摇匀,再精密吸取0.5、1.0、2.0、3.0、4.0、5.0、6.0、8.0、10.0 ml,分别置10 ml棕色量瓶中,得10、20、40、60、80、100、120、160、200 U/ml制霉菌素标准溶液。(3)制霉菌素样品溶液:精密称取适量制霉菌素口腔糊剂样品(相当于制霉菌素5×104U),加入二甲亚砜溶解,搅拌,部分固体基质不能溶解,少量多次(≥7次)加入二甲亚砜溶解,置100 ml棕色量瓶中定容,精密吸取续滤液1 ml,置10 ml棕色量瓶中定容,得到含制霉菌素50 U/ml的样品溶液。(4)空白基质溶液:以不加制霉菌素的口腔糊剂样品为空白基质,精密称取空白基质适量,按制霉菌素样品溶液制备过程相同操作,得空白基质溶液。
2.5.2.2 测定波长的选择 分别取二甲亚砜、空白基质溶液、制霉菌素样品溶液、制霉菌素标准溶液(60 U/ml),采用紫外分光光度法,在200~800 nm波长范围内扫描。结果制霉菌素在296、309、324 nm波长处有最大吸收,而空白基质溶液在309 nm波长处几乎没有吸收,对制霉菌素的测定没有干扰,故选择309 nm为制霉菌素的测定波长。
2.5.2.3 线性关系考察 配制10~200 U/ml系列制霉菌素标准溶液,以二甲亚砜为空白基质,在309 nm波长处测定吸光度(A),以吸光度(A)对浓度(c)进行线性回归,绘制标准曲线。结果回归方程为A=0.007 1c+ 0.031(r=0.999 8,n=6),表明在浓度10~200 U/ml范围内线性关系良好。
2.5.2.4 精密度试验 精密量取制霉菌素储备液,用二甲亚砜分别稀释为120、100、80 U/ml的标准溶液,在309 nm测定吸光度,计算浓度。结果日内平均精密度RSD为0.04%,连续测定3 d,日间精密度RSD为0.06%,表明该方法精密度良好。
2.5.2.5 加样回收率试验 分别精密称取制霉菌素口腔糊剂样品,加适量二甲亚砜,混匀,按处方比例分别配制高、中、低浓度分别为60、50、40 U/ml的制霉菌素样品溶液,每个浓度各3份,测定吸光度,计算含量。结果回收率范围为98.64%~100.05%,符合含量测定要求。
2.5.2.6 重复性试验和中间精密度试验 (1)重复性试验:精密量取同一批号的制霉菌素口腔糊剂6份,相当于制霉菌素5×104U,加入二甲亚砜溶解,置100 ml棕色量瓶中定容,测定吸光度,RSD为0.12%,表明该方法重复性良好。(2)中间精密度试验:不同分析人员、不同日期分别精密量取同一批号的制霉菌素口腔糊剂 6份,相当于制霉菌素5×104U,加入二甲亚砜溶解,置100 ml棕色量瓶中定容,测定吸光度,计算含量。结果RSD为0.13%,表明该方法中间精密度良好。
2.5.2.7 稳定性试验 取制霉菌素样品溶液和制霉菌素标准溶液(60 U/ml)各3份,分别于室温避光放置2、4、8、12 h后,测定吸光度,并计算含量,考察制霉菌素室温避光放置稳定性。制霉菌素样品溶液放置2、4、8、12 h的含量为(98.42±1.06)%、(99.32±1.15)%、(98.76±0.18)%和(99.02±0.98)%,制霉菌素标准溶液放置2、4、8、12 h的含量分别为(99.42±0.97)%、(98.83±1.21)%、(98.40±0.63)%和(99.08 ±0.11)%,表明制霉菌素样品溶液和标准溶液室温避光放置12 h稳定。
2.5.2.8 样品含量测定 取批号分别为N20121001、N20121002、N20121003的制霉菌素口腔糊剂,精密称取适量(相当于制霉菌素5×104U),加入二甲亚砜溶解,搅拌,部分固体基质不能溶解,少量多次(≥7次)加入二甲亚砜溶解,置100 ml棕色量瓶中定容,精密吸取续滤液1 ml,置10 ml棕色量瓶中定容,测定含量。结果上述3个批号的制霉菌素口腔糊剂中制霉菌素含量分别为标示量的(99.47±1.24)%、(98.48±0.11)%和(99.67±1.32)%。
2.5.3 高温实验 取制霉菌素口腔糊剂(批号N20120901)10份,于(60±2) ℃恒温箱放置10 d。分别于0、5、10 d各取5支,按稳定性重点考察项目(性状、含量)进行检测。结果表明,制霉菌素口腔糊剂在高温60 ℃下不稳定,会产生颜色变化,由黄色变为棕黄色,含量出现一定程度下降,由0 d的(97.90±0.28)%下降为10 d的(90.83±0.83)%。表明温度是影响制霉菌素口腔糊剂稳定性的因素之一,因此在运输及储存时需注意温度不能过高。
3 讨 论
3.1 处方基质及工艺的选择 在糊剂的制备过程中,基质的选择是影响黏附力与缓释效果的重要因素。因此,为选择适合的基质,需要考虑到制霉菌素遇水不稳定,且在较高温度下也不稳定,并且需要平衡糊剂的黏附力和吸水性。由于制霉菌素遇水不稳定,本研究采用熔融的凡士林、液体石蜡等油性基质为分散基质,避免制霉菌素与水接触,提高药物在制剂中的稳定性。但在加热熔融基质的过程中需要升高温度,因此需考虑制霉菌素在较高温度下不稳定的问题。在制备过程中,本研究控制温度在50 ℃,在此温度下,基质可熔化,但不影响制霉菌素的稳定性[9]。
凡士林、液体石蜡不具有溶胀性,不能够使糊剂很好地黏附在口腔黏膜上,因此需加入一定比例的黏附剂。 当黏附剂作用于口腔黏膜时,黏膜层可与溶胀的高分子材料接触,黏附材料的分子渗透到组织表面的缝隙,与黏液中的黏性链段分子互相穿透,通过疏水链、氢链、静电吸引力、范德华力等综合作用产生黏附特性,有利于药物吸收,并具有一定缓控释作用[7]。考虑到糊剂的黏附力及吸水值等性质,本研究选择羟丙甲纤维素4000及卡波姆940为黏附剂。羟丙甲纤维素是一种半合成的、不活跃的、黏弹性的聚合物,可作为增稠剂,具有良好的黏附力,但是吸水性较差[8-9],造成糊剂硬度较大而伤害疮口。卡波姆940是一种高分子聚合物,稳定性较好,同时具有较强的吸水性,吸水后可在口腔黏膜处与糖蛋白链形成弱化学键而产生黏附性,有增稠、悬浮等重要用途,同时卡波姆940对液体石蜡更具亲和力,有利于糊剂的稳定[8]。
3.2 湿度对糊剂的影响 本研究虽然充分考虑到制备时实验室湿度对制剂评价指标如吸水值的影响,但由于无法控制实验室环境恒温、恒湿,对吸水值等产生了较大影响。实验过程中同一个影响因素及处方的糊剂尽量在同一天同一个实验室完成制备及评价,实验过程中尽量保持材料及糊剂处于密封状态,但实验结果发现吸水值的标准差仍较大。有研究发现,水分对黏附剂也有影响,适量的水份能使聚合物膨胀,与糖蛋白链形成弱化学键而产生黏附性,但随着水分的增加,黏附剂的黏附强度会下降[8]。因此,制霉菌素口腔糊剂宜在恒温恒湿环境下制备及评价。
3.3 载药量范围 临床使用制霉菌素溶液的浓度为1×104~1×105U/ml,如文献[3,5]报道的制霉菌素溶液浓度为2×104~1×105U/ml,湖南省儿童医院临床自配的制霉菌素溶液浓度为1×104~5×104U/ml。制霉菌素口腔糊剂可能会存在缓释效果[8],黏附使用时间较长,局部靶浓度可能比溶液更高,所以合适的载药量目前暂未确定,故单因素试验设计载药量范围为1×104~1×106U/g,结果表明载药量在1×104~1×105U/g范围内对糊剂的黏附力、吸水值和赋形性影响较小。《第二批鼓励研发申报儿童清单的通知》建议制备制霉菌素口腔糊剂,也未规定载药量,课题组计划后期制备不同载药量的制霉菌素口腔糊剂进行相关评价研究,以确定适宜的载药量。

