活血解毒中药配伍对缺氧/复氧诱导H9C2心肌细胞自噬损伤的保护机制
谭 令,付长庚,2,邓 秘,曲 华,2,于子凯,2,黄明艳,龙霖梓
(1.中国中医科学院西苑医院,2.国家中医心血管病临床医学研究中心,北京 100091)
近年研究表明,心血管疾病(cardiovascular disease,CVD),尤其是缺血性心脏病已发展为中国乃至世界范围内发病率和致死率最高的疾病类型[1],及时、有效的血液再灌注治疗对于维持心脏功能和减少心肌损伤有重要作用。但在一定情况下,随着血液灌流的恢复,心肌组织功能不仅不能恢复,反而造成更严重的心肌结构损伤和心肌功能障碍,这一病理过程称为心肌的缺血/再灌注损伤(myocardial ischemia/reperfusion injury,MIRI)。因此,探索MIRI的病理生理机制,并采取针对性的治疗策略是临床上亟需解决的难点之一。
自噬是一种进化保守的真核细胞内特有的溶酶体依赖性的胞内物质的分解代谢过程。在关于MIRI病理机制的探索过程中,已有研究发现心肌细胞自噬贯穿MIRI发生发展的全过程,甚至可诱发心肌细胞的凋亡及坏死,而PI3K/Akt/mTORC1 通路是对自噬起负调控作用的主要信号通路。自噬在MIRI不同时期发挥的作用是不同的,该通路主要通过调节mTOR的活性调控自噬活性:在心肌缺血阶段,心肌组织因血液供应不足及ATP生成减少,致心肌mTOR的表达受到抑制,ULK1复合体被激活后转移到内质网,进而诱导自噬泡膜形成,启动自噬[2]。研究表明[3],自噬对于维持心肌缺血损伤时的细胞环境稳态至关重要,因为此阶段自噬水平轻度增强,自噬体可通过消化破损的线粒体等细胞器, 避免受损的线粒体释放凋亡因子,保护心肌细胞免于死亡;而在再灌注阶段,由于血液的重新供应,大量活性氧产生及Ca2+超载等原因引起Beclin-1 激活,进而导致心肌细胞自噬过度增强,加重心肌细胞的损伤,甚至出现细胞坏死,但此期心肌组织的血供被恢复后,血液中的生长因子、细胞因子和激素等成分可激活PI3K/Akt 信号通路,进而使其下游mTOR的抑制作用被解除,mTOR 激活后抑制再灌注期过度自噬的发生,从而保护心肌的缺血/再灌注损伤。
MIRI 据其临床症状可归属中医学“胸痹”、“真心痛”等范畴,《素问·脉要精微论》曰:“夫脉者,血之府也,长则气治,短则气病,……涩则心痛”,说明血脉瘀滞可致胸痹心痛,瘀血阻滞血脉,致气、水、血运行不畅,继而引起气滞、痰饮、瘀血等实邪内停,久则蕴结为浊毒之邪,毒邪与瘀血、痰浊胶结,缠绵难解, 日久必郁而化火,邪热易耗气伤血,而心主血脉,故毒瘀最易损伤心脏而发胸痹、心痛之症。临证针对此类病机所致之胸痹,最当行活血解毒药之法。
活血解毒中药配伍由川芎、赤芍和黄连三药组成,是课题组长期应用于临床并获得显著效果的经验方,既往药理实验研究表明,活血解毒中药组分川芎嗪[4]、赤芍总苷[5]、黄连素[6]等均能有效改善MIRI,且不良反应较少,但尚未有研究证实上述活血、解毒中药配伍应用对MIRI的治疗机制,因此,本实验决定在前期研究的基础上,以缺氧/复氧H9C2心肌细胞模拟心肌缺血/再灌注损伤的体外模型,进一步探究活血解毒中药对MIRI 的治疗作用及其潜在机制。
1 材料与方法
1.1 材料
1.1.1细胞株 H9C2细胞购自中桥新舟。
1.1.2药物 活血解毒中药由江阴天江药业有限公司提供。
1.1.3主要试剂与仪器 氯喹(targetmol,T0194)、CCK8 细胞增殖及细胞毒性检测试剂盒(Beyotime, C0037)、LC3(CST,12741)、β-catenin(affinity,AF6266)、Beclin-1(abcam, ab62557)、Bcl-2(abcam,ab196495)、磷酸酶抑制剂(碧云天,S1873)、PMSF(碧云天,ST506)、RIPA 裂解液(碧云天,P0013B)、BC 蛋白浓度测定试剂盒(碧云天,P0010)、蛋白marker(北京全式金生物技术有限公司,DM111)、显影定影试剂盒(天津市汉中摄影材料厂)。
酶标仪(Thermo,MULTISKAN MK3)、垂直电泳槽(北京六一仪器厂, DYCZ-24DN)、电转仪(北京六一仪器厂,DYCZ-40)、离心机(湖南湘仪实验室仪器开发有限公司,HI650)、电泳仪电源(北京六一仪器厂,DYY-7C)。
1.2 方法
1.2.1缺氧/复氧损伤细胞模型的建立与分组 取对数生长期H9C2心肌细胞,用0.25%胰酶消化并收集细胞。以DMEM培养液(含10% FBS、100 kU·L-1青霉素和 100 kg·L-1链霉素)制成细胞悬液,以5×107个·L-1细胞密度接种于培养板中培养24 h。药物处理24 h后,将心肌细胞置于1% O2、94% N2和5% CO2的低氧饱和湿度培养箱中孵育4 h,然后将细胞转移至DMEM基础培养基21%氧浓度的培养箱中继续孵育6 h,制造H9C2心肌细胞缺氧/复氧模型。实验共分为7组,正常对照组:H9C2心肌细胞在常规条件下培养;模型组:按上述方法制备缺氧/复氧损伤细胞模型;活血解毒中药组:在缺氧/复氧损伤细胞模型基础上加入适宜浓度的活血解毒中药提取物;PI3K抑制剂LY294002组:在缺氧/复氧损伤细胞模型基础上加入PI3K抑制剂LY294002;溶酶体抑制剂氯喹组:在缺氧/复氧损伤细胞模型基础上加入溶酶体抑制剂氯喹; 活血解毒中药联合PI3K抑制剂LY294002组:在缺氧/复氧损伤细胞模型基础上加入活血解毒中药和LY294002;活血解毒中药联合溶酶体抑制剂氯喹组:在缺氧/复氧损伤细胞模型基础上加入活血解毒中药和氯喹。
1.2.2药物配置 将川芎提取物:赤芍提取物:黄连提取物按1 ∶1 ∶1 配比,用PBS配制成一定浓度的母液,超声溶解,高压灭菌后于-20 ℃贮存备用。
1.2.3药物适宜浓度的筛选 取对数生长期的H9C2细胞,以合适的细胞密度接种于培养板中培养24 h后,药物处理24 h,将心肌细胞置于1% O2、94% N2和5% CO2的低氧饱和湿度培养箱中孵育4 h,然后将细胞转移至DMEM基础培养基21%氧浓度的培养箱中继续孵育6 h,CCK8检测细胞活性。
1.2.4细胞活性的检测 取对数生长期的H9C2细胞,以5×107个·L-1细胞密度接种于培养板中培养24 h。药物处理24 h后,将心肌细胞置于1% O2、94% N2和5% CO2的低氧饱和湿度培养箱中孵育4 h,然后将细胞转移至DMEM基础培养基21%氧浓度的培养箱中继续孵育6 h。每孔加入10 μL CCK8,37 ℃培养4 h,酶标仪测定各孔吸光值OD450。
1.2.5流式细胞术检测 取处于对数生长期的H9C2细胞,调整细胞密度到5×108个·L-1,接入6孔板,每孔1 mL细胞悬液,37 ℃培养过夜;按分组处理后,收集细胞,按试剂盒说明依次加入Annexin V-FITC和PI室温避光反应10 min;流式细胞仪上机检测。
1.2.6激光共聚焦显微镜观察 取对数生长期的H9C2心肌细胞,以合适的细胞密度接种于24孔培养板中,待细胞汇合度达到80%-90%时,将GFP标记的LC3质粒转染至H9C2细胞中。培养24 h后按照分组处理,DAPI核染。将处理后的各组细胞于共聚焦显微镜下拍摄细胞自噬流。
1.2.7实时荧光定量 PCR 检测 取对数生长期的H9C2心肌细胞,TRIzol 法提取总RNA,然后按逆转录试剂盒说明书将总RNA逆转录成cDNA,继而以cDNA为模板进行PCR扩增,实时荧光定量PCR反应条件为50 ℃ 2 min,95 ℃ 10 min;95 ℃ 30 s,60 ℃ 30 s,40循环。引物序列:LC3 Forward(CTTCTGAGCCAGCAGTAGGG LC3 Reverse(GAGGGACAACCCTAACACGA)、Beclin-1 Forward(AGGTTGAGAAAGGCGAGACA)、 Beclin-1 Reverse(AATTGTGAGGACACCCAAGC)、 Bcl-2 Forward(GAGGATTGTGGCCTTCTTTG)、Bcl-2 Reverse(ACAGTTCCACAAAGGCATCC)、 β-actin Forward(CTCCATCCTGGCCTCGCTGT)、 β-actin Reverse(GCTGTCACCTTCACCGTTCC)。
1.2.8Western blot检测 细胞培养同“1.2.1”。加入裂解液于冰上裂解细胞30 min,继而低温离心后取上清分装。用BCA试剂盒进行蛋白定量。将蛋白变性完后冷却至室温。然后依次进行凝胶电泳、转膜、封闭和一抗、二抗孵育。二抗孵育结束后,TBST洗涤3次,最后加入ECL化学发光液在成像系统中进行扫描。

2 结果
2.1 给药浓度的确定如Fig 1,中药提取混合物的IC50为5.067 g·L-1;浓度低于0.05 g·L-1时对细胞增殖的影响不明显,而高于0.15 g·L-1时又会对细胞造成损伤。因此,0.15 g·L-1浓度的中药提取液既有利于心肌细胞的增殖,又能很大程度地缓解缺氧/复氧带来的自噬损伤,所以选择此药物浓度进行后续的自噬机制研究。

Fig 1 Screening of mixed Chinese medicine extract concentration
2.2 各组细胞生长活性的比较如Fig 2,H9C2 细胞经缺氧/复氧处理后,细胞生长活性降低。与缺氧/复氧处理组相比,经活血解毒中药和溶酶体抑制剂氯喹预处理后,细胞生长活性增加;经PI3K抑制剂LY294002处理后,细胞生长活性进一步降低;活血解毒中药和LY294002联合预处理后,细胞生长活性高于单独LY294002处理,但低于单独活血解毒中药处理。活血解毒中药和氯喹联合预处理后,细胞生长活性高于单独活血解毒中药处理或单独氯喹处理。结果提示,缺氧/复氧能降低细胞生长活性,且与PI3K通路密切相关。

Fig 2 Detection of cell growth activity
2.3 活血解毒中药对缺氧/复氧 H9C2心肌细胞凋亡率的影响如Fig 3,H9C2细胞经缺氧/复氧处理后,细胞凋亡率增加。与缺氧/复氧处理组相比,经活血解毒中药和氯喹预处理后,细胞凋亡率显著降低;经LY294002预处理后,细胞凋亡率进一步增加;活血解毒中药和LY294002联合预处理后,细胞凋亡率低于单独LY294002处理,但高于单独活血解毒中药处理。活血解毒中药和氯喹联合预处理后,细胞凋亡率低于单独活血解毒中药处理或单独氯喹处理。

Fig 3 Detection of apoptotic rate
2.4 活血解毒中药对缺氧/复氧 H9C2心肌细胞自噬水平的影响如Fig 4,H9C2细胞经过缺氧/复氧处理后,细胞绿色点状聚集物明显增多,自噬水平增加。与缺氧/复氧处理组相比,经活血解毒中药和氯喹预处理后,细胞绿色点状聚集物明显减少,自噬水平降低;经LY294002预处理后,细胞绿色点状聚集物进一步增多,自噬水平进一步增加;活血解毒中药和LY294002联合预处理后,细胞绿色点状聚集物少于单独LY294002处理,但多于单独活血解毒中药处理。活血解毒中药和氯喹联合预处理后,细胞绿色点状聚集物少于单独活血解毒中药处理或单独氯喹处理。

Fig 4 Autophagy protein LC3 observed by fluorescence microscopy, with a scale of 25 μm
2.5 活血解毒中药对缺氧/复氧H9C2心肌细胞内Beclin-1、LC3和Bcl-2 mRNA水平的影响如Fig 5,H9C2细胞经过缺氧/复氧处理后,Beclin-1和LC3 mRNA 表达显著增加,Bcl-2 mRNA表达显著降低,说明缺氧/复氧能够引起自噬水平增加,且能促进细胞凋亡。与缺氧/复氧处理组相比,经过活血解毒中药和氯喹预处理后,Beclin-1和LC3 mRNA表达显著降低,而Bcl-2 mRNA 表达升高;经LY294002预处理后,Beclin-1和LC3 mRNA 表达升高,而Bcl-2 mRNA 表达明显降低;经活血解毒中药和LY294002联合预处理后,Beclin-1和LC3 mRNA表达水平较LY294002单独处理降低,但较单独活血解毒中药处理升高,而Bcl-2 mRNA表达较LY294002单独处理明显升高,较单独活血解毒中药处理明显降低;经活血解毒中药和氯喹联合预处理后,Beclin-1和LC3 mRNA表达水平较单独氯喹或活血解毒中药处理均降低,而Bcl-2 mRNA表达较单独氯喹或活血解毒中药处理均升高。
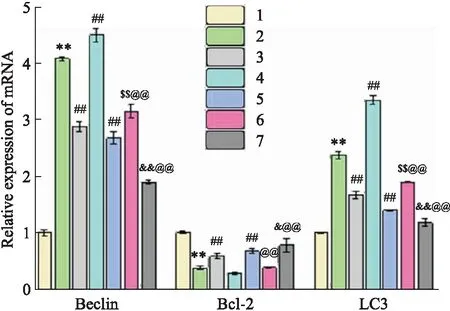
Fig 5 mRNA expression in cells
2.6 活血解毒中药对缺氧/复氧H9C2心肌细胞内自噬及凋亡相关蛋白表达的影响如Fig 6,H9C2细胞经过缺氧/复氧处理后,自噬相关蛋白Beclin-1、LC3Ⅱ/Ⅰ表达增加,p62、p-AKT、p-mTOR表达降低,PI3K/Akt/mTORC1通路活化减弱,自噬增强;凋亡相关蛋白Cleaved caspase-3、β-catenin、p-p65表达增加,Bcl-2表达降低,凋亡增加。与缺氧/复氧处理组相比,经过活血解毒中药和氯喹预处理后,Beclin-1、LC3Ⅱ/Ⅰ表达减少,p62、p-AKT、p-mTOR表达增加,PI3K/Akt/mTORC1 通路活化增强,Cleaved caspase-3、β-catenin、p-p65表达降低;经过LY294002预处理后,Beclin-1、LC3Ⅱ/Ⅰ表达增加,p62、p-AKT、p-mTOR和Bcl-2表达降低;Cleaved caspase-3、β-catenin、p-p65表达增加;活血解毒中药和LY294002联合预处理后,Beclin-1、LC3Ⅱ/Ⅰ、Cleaved caspase-3、β-catenin、p-p65等蛋白表达水平较单独LY294002处理升高,但其较单独活血解毒中药处理降低,p62、p-AKT、p-mTOR 的表达则相反;活血解毒中药和氯喹联合预处理后,Beclin-1、LC3Ⅱ/Ⅰ、Cleaved caspase-3、β-catenin、p-p65 等蛋白表达水平较单独氯喹或活血解毒中药处理升高,p62、p-AKT、p-mTOR 的表达水平则较单独氯喹或活血解毒中药处理降低。

Fig 6 Protein expression in cells
3 讨论
心肌缺血/再灌注损伤(MIRI)是一系列心血管疾病发生的重要病因[7]。目前,对于缺血性心脏病,现代医学采用的经皮冠状动脉介入治疗和冠状动脉旁路移植术等虽可显著改善患者心肌缺血的症状和预后,但由于MIRI的存在,心肌缺血经治疗后一年内仍有较高的心力衰竭发生率[8]。
本实验研究发现H9C2心肌细胞在缺氧/复氧诱导下,细胞生长活性降低,凋亡率增加,在激光共聚焦显微镜下可见细胞内自噬体结构显著增加,表明体外MIRI 模型建立成功。且本研究与屈玉春等[9]研究结果一致,表明缺血处理可诱导体外培养的心肌细胞凋亡,同时激活自噬,而再灌注处理使得自噬被过度激活, 则加速心肌细胞死亡。

心肌缺血期,心肌细胞由于缺乏能量供应而发生大量坏死和凋亡。caspase-3是细胞凋亡的关键起始基因,caspase-3 通过自身的寡聚化活化为凋亡的主要执行者Cleaved caspase-3,其通过激活下游多种蛋白酶而执行细胞凋亡。因此,caspase-3的激活标志着细胞凋亡开始执行且不可逆转[10]。p65是构成核转录因子NF-κB 异源二聚体的亚基之一,当p65被磷酸化激活后,可通过上调下游靶基因的表达,启动细胞凋亡的级联反应,诱导细胞凋亡[11]。此外,在心肌缺血期,因能量危机致心肌细胞大量凋亡的同时,还伴有自噬的轻度激活。此期自噬的发生可消化受损的线粒体,并产生新的能量和原料,使缺血损伤的心肌获得修复,且能有效抑制心肌细胞凋亡,显著降低心肌细胞的凋亡率[12]。因此,MIRI的心肌缺血期主要表现为心肌细胞凋亡和自噬激活介导对心肌的保护。
再灌注时期,心肌细胞由于恢复了能量供应,产生大量氧自由基产生,引起自噬的异常过度激活。有研究表明,在再灌注过程中,自噬加速可引起心肌细胞损伤,进而促进细胞死亡[13]。Beclin-1与Bcl-2是调控自噬的关键蛋白,且Bcl-2是自噬和凋亡的中央调控因子[14]。此两者的平衡状态是调控自噬与凋亡相互反馈作用的关键因素,在再灌注过程中,Beclin-1的表达量明显增多,致Bcl-2与Beclin-1表达失衡,则Bcl-2表达的相对下调既可诱发凋亡加重,又可通过激动Beclin-1来激活自噬,加速心肌细胞死亡[15]。因此,MIRI 的再灌注期主要表现为心肌自噬的过度激活及其引起的细胞凋亡加重。
参与再灌注过程中的自噬相关蛋白还包括 LC3 和 p62 等。其中 LC3 主要介导自噬体的成熟:LC3Ⅱ/LC3Ⅰ的比例越高说明自噬活性越强,因此 LC3 可用于相对定量地评价自噬体的活性程度[16]。p62则参与自噬的降解,通过与LC3蛋白结合形成复合物,并将LC3与待降解泛素化生成物连接,最终于溶酶体内进行降解,因此,p62可随着自噬作用的进行而不断被消耗[17]。
本研究采用了氯喹干预作为对照组,因氯喹具有溶酶体趋向性,能选择性地进入溶酶体内,破坏溶酶体的酸性环境,使溶酶体不能降解自噬体包裹的受损蛋白质和细胞器等物质,从而抑制细胞自噬过程。研究结果显示氯喹干预组的自噬和凋亡水平较模型组降低,同时,联合运用活血解毒中药与氯喹干预也导致心肌细胞的自噬和凋亡水平较单独运用活血解毒中药组或单独运用氯喹组更低,说明活血解毒中药能有效抑制心肌细胞的自噬和凋亡。且研究检测发现,H9C2细胞经缺氧/复氧处理后,Beclin-1、LC3Ⅱ/Ⅰ、Cleaved caspase-3、β-catenin 和p-p65等介导自噬或凋亡的蛋白表达增加,而Bcl-2、p62、p-AKT和p-mTOR等抑制自噬或凋亡的蛋白表达降低,活血解毒中药预处理可有效逆转上述蛋白表达,再次证明活血解毒中药能抑制MIRI过程中自噬和凋亡的发生。
为进一步明确活血解毒中药抑制缺氧/复氧心肌自噬和凋亡的分子信号通路机制。本实验设置了PI3K特异性抑制剂LY294002干预组作为对照组[18],从而使PI3K/Akt/mTORC1通路被抑制。研究发现单独用LY294002处理缺氧/复氧的H9C2细胞可导致其自噬和凋亡水平升高,而联合运用活血解毒中药与LY294002 预处理后,心肌细胞的自噬和凋亡水平较单独LY294002处理降低,但较单独活血解毒中药处理升高,说明活血解毒中药可能是通过调控PI3K信号通路降低心肌细胞的自噬和凋亡水平,从而有效保护心肌细胞的缺血/再灌注损伤。
综上所述,活血解毒中药配伍可通过调控PI3K/Akt/mTORC1自噬通路,降低心肌细胞自噬和凋亡水平,从而对缺氧/复氧损伤H9C2心肌细胞起到保护作用。本研究证实了活血解毒中药可有效保护缺氧/复氧诱导的H9C2心肌细胞损伤,为临床合理治疗心肌缺血/再灌注损伤开辟了思路。

