类风湿关节炎实验性动物模型研究进展
李利青,张 逢,彭馥芝,罗前颖,李 鑫,刘 良,3
(1.右江民族医学院桂西高发病防治重点实验室,广西 百色 533000;2.湖南中医药大学中药粉体与创新药物省部共建国家重点实验室(培育基地),湖南 长沙 410208;3. 澳门科技大学中药质量研究国家重点实验室,中国 澳门 999078)
类风湿关节炎(rheumatoid arthritis,RA)是一种以慢性、对称性、多关节病变为特征的自身免疫性疾病,主要表现为滑膜炎、软骨及骨破坏。遗传因素(如易感基因HLA-DRB1)是影响RA的主要因素(约占60%),40%是吸烟、饮食、环境等非基因因素。RA的发生发展与细胞因子之间的相互调控失衡有关:自身抗原持续作用,打破正常机体的免疫耐受,免疫细胞(如T细胞)异常激活与分化,释放多种促炎因子,激活B细胞分泌自身抗体,使关节部位免疫复合物过度形成并持续处于慢性炎症状态。早期RA以滑膜炎为主,出现红肿热痛经典炎症表现,持续性滑膜炎导致滑膜细胞快速分裂增殖,逐渐形成增厚的血管翳。晚期RA关节部位有大量的免疫细胞及相关酶浸润,致软骨和骨破坏,关节功能受损[1-2]。据统计,RA的全球患病率为0.5%-1%,女性患者多发于男性,死亡率通常是正常人的2倍,被列为全球致残的危害疾病之一[1, 3]。RA病因不明,发病机制复杂,尚无特效治疗药物,一直是国内外研究的热点和难点。动物模型很大程度上模拟了RA的致病因素和疾病特点,是研究发病机制和药物研发的重要工具。目前,RA动物模型主要是以啮齿类大小鼠为研究对象,其优势在于遗传背景稳定,操作方便且经济。根据模型造模情况,大致可将RA动物模型分为诱导型和自发性转基因型。本文对相关文献进行归纳总结,着重选择最具有代表性的RA动物模型,全面系统地从RA实验性动物模型的构建方法、免疫机制、致病靶点、疾病特点等方面展开论述,同时对这些实验诱导型动物模型进行综合比较,以期为合理选择实验动物模型作为RA的基础研究与药物研发提供依据和参考。
1 诱导型RA动物模型
诱导型RA动物模型是根据动物品系和发病特点选择不同的造模物质,采用不同的免疫方法进行诱导,常见的有外源性抗原佐剂诱导型(adjuvant-induced arthrtis,AIA)、内源性抗原Ⅱ型胶原诱导型(collagen Ⅱ-induced arthritis,CIA)、在CIA基础上发展的胶原抗体诱导型(collagen antibody-induced arthritis,CAIA)、非免疫原性物质降植烷诱导型(pristane-induced arthritis,PIA)及链球菌胞壁诱导型(streptococcal cell wall-induced arthritis,SCWIA)。不同诱导型RA动物模型所反应的RA特征和免疫机制也有所不同。
1.1 佐剂诱导型AIA模型AIA最早由细菌学家Pearson CM于1956年在大鼠上建立,是较早使用的经典RA动物模型,广泛用于RA致病机理研究与抗关节炎药物评价[4]。AIA通过大鼠尾根部或足跖部皮下注射含有灭活分枝杆菌或减毒卡介苗的完全弗氏佐剂(complete Freund’s adjuvant,CFA)进行免疫诱导。早期造模选用的主要是近交系Lewis大鼠,而远交系Wistar和SD大鼠等研究报道对AIA敏感性较低[5]。Cai等[6]2006年报道了AIA大鼠模型制备影响因素及SD和Lewis大鼠AIA模型平行比较的系统研究,发现选择结核分枝杆菌(MycobacteriumtuberculosisH37Ra,Mtb),采用手工研磨制备CFA,并于尾根部皮下免疫,成功建立成模率100%、重复性好及病理程度差异性小的♂ SD系大鼠AIA模型,其在临床表现、血清学[血沉(erythrocyte sedimentation rate,ESR)]、C反应蛋白(C-reactive protein,CRP)、组织病理和放射学改变以及免疫改变等方面与人RA有许多相似特征[6]。与Lewis大鼠AIA模型比较,该SD大鼠AIA模型具有更接近人类杂合性基因背景、价格便宜、易获得性等优势,从而得到国内外风湿免疫学界公认[7]。
RA的特征是以大量CD4+T细胞浸润为主的慢性滑膜炎症反应,而大鼠AIA也是一种T 细胞依赖、细胞免疫介导的炎症性动物模型,在临床表现和病理机制等方面与人RA 有许多相似特征,是研究外源性诱因引起RA自身免疫反应机制的较理想动物模型[8]。AIA模型发病机制是分子模拟作用,Mtb H37Ra是一个相对分子量为65-kD 热休克蛋白(heat-shock protein 65,HSP65),与大鼠关节软骨(CII)的自身抗原HSP60有高度相似的保守序列,通过分子模拟或交叉反应,激活原来处于静止状态的针对CII抗原为主的T淋巴细胞,从而引起关节的自身免疫反应,但是过量的Mtb H37Ra易造成模型动物免疫部位严重溃烂,出现腹膜炎、脾脏及尾根部皮下结节等关节外表现[9]。AIA易感性与MHC基因的依赖性相关,辅助性T细胞亚群间的平衡紊乱是其主要特点,因此适合T细胞及亚群间的分子机制研究[8]。
1.2 胶原诱导型CIA模型CIA由Trentham等[10]于1977年在远交系和近交系的大鼠上建立,通过关节软骨主要构成蛋白Ⅱ型胶原蛋白(collagen type Ⅱ,CII)与非完全弗氏佐剂(incomplete Freund’s adjuvant,IFA)(大鼠)或CFA(小鼠)等量混合制备成乳剂进行免疫诱导,通常在动物的免疫部位(尾根部、背部和跖部)进行多点皮下注射,可根据实验需要在d 7或d 21加强免疫以确保诱发CIA高发病率,与RA具有相似的滑膜炎和骨破坏等特征,但该模型不存在类风湿因子(rheumatoid factor,RF)[11-12]。CIA是一种内源性自身抗原介导自身免疫性疾病,主要特征是自身胶原的耐受性破坏和自身抗体的产生,是研究RA的金标准体内模型[12]。该模型的易感性受到MHC相关基因和其他细胞因子调控,大多数易感菌株品系发病率在80%-100%[12]。Ⅱ型胶原一般采用异源性CII(鸡、小牛和大鼠等动物),通常对Lewis、SD和Wistar大鼠,及敏感性DBA/1(H-2Q)和B10.RIII(H-2R)小鼠有很高的致炎作用。与CIA大鼠不同的是,CIA小鼠是不会通过IFA乳化的Ⅱ型胶原蛋白诱导产生关节炎,其疾病程度与CFA中的Mtb H37Ra浓度有很大的关系,对于低敏感度品系如B10(H-2B)、C57BL/6(H-2B)所需的Mtb H37Ra量会比敏感系小鼠多[12]。另外,免疫乳液的质量和稳定性对于诱导高发病率的关节炎至关重要,制备过程建议全程在冰水浴中,过多的热量易使胶原蛋白变性[13]。
DBA/1(H-2Q)小鼠品系是CIA经典小鼠模型,d 0和d 21于尾根部免疫乳化的牛CII/CFA乳液,初次免疫后d 26-d 35发病,其优势在于发病率高,可重复性好,但价格昂贵。经济性低敏感C57BL/6小鼠对鸡CII较敏感,对牛CII胶原不敏感,鸡CII/CFA乳化剂免疫也可产生关节炎(踝关节和足掌明显红肿),但发病率低于高敏感品系DBA/1小鼠[10-11]。Cai等[14]通过牛CII/IFA乳剂在大鼠尾部进行免疫诱导,以比较不同品系大鼠对CIA的敏感性,发现Wistar大鼠对CIA最敏感,其中♀ Wistar大鼠出现高发病率(>83%)和严重的关节炎,其次是Wistar Furth大鼠,SD大鼠最不敏感,d 30可见Wistar大鼠踝关节和足掌明显红肿、增生性滑膜炎、血管翳形成、关节软骨和骨破坏。随后,该模型成功用于抗关节炎中药复方制剂青附关节舒及中药活性单体化合物的药效评价与机理研究。CIA大鼠对不含结核杆菌的IFA或石蜡油乳化的Ⅱ胶原就能产生自身免疫,且不易对免疫部位产生严重的炎症反应,对药物评估和免疫指标的检测也不像 AIA 大鼠或CIA小鼠受其细菌或其组分影响。
1.3 胶原抗体诱导型CAIA模型CAIA模型是经典CIA模型的扩展,通过靶向Ⅱ型胶原蛋白的各种表位的抗体混合物来诱导关节炎的发生,其发病关键在于免疫复合物的形成和补体的激活,快速启动与RA相似的临床特征[15]。Terato K等[16]用Ⅱ型鸡胶原蛋白免疫的DBA/1小鼠中分离出具有识别CB11簇表位的gG亚型多种单克隆抗体,成功构建CAIA模型。随后Hutamekalin等[17]在4种抗Ⅱ型胶原单克隆(mAb)混合物的基础上添加具有识别Ⅱ型胶原蛋白LyC1片段的单克隆抗体(CII-3),制成更强致关节炎性的5种抗Ⅱ型胶原单克隆混合物,改善了4种抗Ⅱ型胶原单克隆抗体局限性,不仅减少所需mAb混合物的剂量,还能在多种低反应品系动物(C57BL/6、B10等)中诱导。研究表明,在抗体混合物诱导后给予脂多糖(lipopolysaccharide,LPS)可增强关节炎的免疫效果,起到一定的协同作用。这种CAIA模型采用mAb-LPS联合诱导,已被广泛用于自身免疫性关节炎和相关药物的研究[18]。
CAIA与有限MHC单倍型的CIA不同,几乎可以在大多数小鼠品系(DBA/1、Balb/c、C57BL/6、B10等)中诱导关节炎发展[15]。于d 0小鼠尾静脉注射150 μL(1.5 mg/小鼠)抗Ⅱ型胶原单克隆抗体混合物,d 3再注入20 μL(10μg/小鼠)的LPS加强免疫。初次免疫后d 4有炎症迹象,d 6-d 8关节炎达到最严重,足踝和足趾明显红肿、炎症细胞浸润、血管翳形成、软骨和骨骼降解,随后几天,关节炎的严重程度下降[16-17]。腹膜内注射也可用于CAIA高应答菌株,但关节炎的严重程度往往较低。对于低反应品系,mAb混合物和LPS的剂量可适当增加,具体取决于小鼠品系。该模型与CIA相似,都是自身抗原诱导,临床症状与RA相似。与CIA相比,CAIA的一个特别优点是该模型适用于不适合CIA的菌株或基因型,在短时间内迅速发病(CIA一般是4周),在发病过程中具有高度的同步性,且模型的复制率高,对快速筛选和评估抗炎药物具有重要意义[17],有望成为研究人RA的有效模型。但是,CAIA模型很难观察RA慢性变化,其昂贵的成本也令很多人望而却步。
1.4 降植烷诱导型PIA 模型PIA由Potter等[19]于1981年在近交系BALB/cJ小鼠建立,是一种非免疫原性致炎物质(降植烷)介导免疫系统产生类似RA慢性复发性关节炎模型。DA大鼠对PIA高度敏感,易形成PIA模型,一次性尾根部皮内注射降植烷后2-3周发生急性关节炎,可见四肢足趾、趾间及踝关节红肿、关节活动障碍,6-8周后出现反复发作和慢性关节炎,破骨细胞大量形成和炎性细胞浸润,骨侵蚀及新骨骼形成,发病率接近100%[20]。PIA小鼠以60 d间隔腹腔注射一定量降植烷进行诱导,发病较大鼠晚,注射后2-6月发病[21]。PIA主要是由T淋巴细胞活化引起自身免疫性疾病,依赖于CD4+T淋巴细胞和主要组织相容性复合体Ⅱ(major histocompatibility complex Ⅱ,MHC-Ⅱ)分子联合调控的慢性特异性炎症疾病,其病程可迁延数月,急性炎症发作后随即进入慢性反复性发作阶段[22]。
PIA与RA病程非常相似,其特征是慢性复发性炎症,骨和骨腐蚀也发生在慢性阶段,炎症仅限于关节,涉及滑膜增生和血管翳形成,RF、软骨寡聚基蛋白(cartilage oligomeric matrix protein,COMP)和靶抗原(RA33抗原)等抗体高表达。PIA疾病的发生受到不同的基因调控,主要是由MHC区域(Pia)影响该疾病的发展,染色体4和6(Pia2和Pia3)上的基因影响关节炎的发作,而染色体12(Pia4)上的基因与关节侵蚀有关[22]。PIA是RA的高度可复制动物模型,与更广泛使用的AIA模型相比,PIA的诱导依赖于烷类化合物而不是Mtb抗原,可减少动物的不适(结分枝杆菌感染)。该模型非常适合急性和慢性治疗性干预措施,并且考虑到动物福利时更容易接受。
1.5 链球菌胞壁诱导型SCWIA模型SCWIA早期由Schwab等[23]将链球菌细胞壁片段直接注射到膝关节中诱发兔的关节炎模型,证明链球菌细胞壁的肽聚糖多糖(peptidoglycan-peptidoglycans,PG-PS)具有很高的炎症活性和抗原潜能。后来在啮齿动物身上得到了发展,SD大鼠单次腹膜内注射SCW的水悬浮液可诱发急性关节炎,随后完全或部分缓解,后期出现糜烂性滑膜炎,关节畸形和强直[24]。SCWIA的严重程度与PG-PS复合物的分子量和结构有关。SCWIA疾病的发展一般分急性期、缓解阶段和慢性期,急性期在免疫24 h后有明显的临床症状,主要是由抗原刺激B细胞产生特异性抗原抗体免疫复合物,沉淀在关节软骨上激活补体,介导关节急性炎症,与嗜中性粒细胞浸润滑膜有关。慢性炎症期主要因T细胞异常活化和巨噬细胞功能失衡,促进多种免疫因子的释放,侵蚀性单核细胞累积,导致周围骨和软骨破坏[24-26]。
SCWIA常选择易感性Lewis大鼠和C57B1/10、BALB/c小鼠等构建模型。♀Lewis大鼠通过腹腔注射PG-PS可诱导大鼠多关节炎,并伴有肝脾肉芽肿性病变的形成,24-48 h内发展成急性炎症和关节肿胀,持续4-5 d后部分消退,2周后T细胞依赖性激活,形成慢性关节炎,表现出滑膜增生,炎性细胞浸润,对称性关节受累和复发性炎症[26]。于C57BL/6J小鼠膝关节内单次注射链球菌细胞壁悬浮液可诱发单侧急性关节炎,随后每周重复注射会将该急性炎症转变为慢性破坏性关节炎[25]。由于小鼠模型在发病后炎症表现方面没有大鼠模型理想,因此常采用大鼠作为模型。SCWIA模型的动物易感性与人类RA相似,但无RF产生,SCWIA诱导关节炎再活化模型有助于阐明免疫性细胞炎症机制,但是该模型诱导剂经济成本较高,关节腔注射技术存在一定的难度,不同的PG-PS 结构SCWIA发展程度也有所不同,导致研究使用的频率偏低[24-25]。
1.6 几种常见诱导型RA动物模型的比较RA实验动物模型尽可能地在某些方面模拟RA疾病的发展和特征,不同的造模方法和诱导物所构建的RA动物模型疾病特点也有所不同(Fig 1),通过比较可以发现:①AIA和SCWIA模型的免疫物质主要是细菌性致炎性抗原,易在免疫部位形成溃烂或皮下结节,且易影响关节外其他脏器(如肝脾肉肿大),早期疾病侵袭性较大,对动物体质量影响较大[6, 24];②CIA和CAIA都是模拟内源性物质Ⅱ型胶原进行的免疫诱导,符合RA自身介导的自身免疫性关节炎[6, 12]。CIA对MHC单倍型动物敏感,具有一定的局限性[12],CAIA可在多种小鼠品系诱导,在短时间内迅速发病,且发病率较高,可快速筛选相关的抗炎药物,但是由于CAIA模型所需的胶原抗体混合物昂贵,CIA乃是目前常用的经典RA模型;③PIA和SCWIA发病趋势很相似,具有急性炎症转变为慢性炎症的病理过程,非常适合急性和慢性治疗性干预措施,与SCWIA和AIA相比,PIA的病程侵袭性较小,但是构建的模型耗时久[13, 17];④从模型的发病病程来看,最早发病的是SCWIA,免疫后48 h后具有明显的临床症状[24],CAIA(约d 3)>AIA(约d 9)>CIA(约d 14)>PIA(大鼠约d 12,小鼠d 60-d 80发病)。PIA病程持续的时间最长,非常适合针对慢性RA疾病的研究[20];⑤AIA和CIA仍然是学术界最广泛使用的经典模型,AIA模型更符合经济性原则,其模型的构建方法也简单(CIA造模过程繁琐,免疫混合物的制备要求全程在冰上操作),CIA的病理特征及自身抗原免疫机制与RA最为相似。
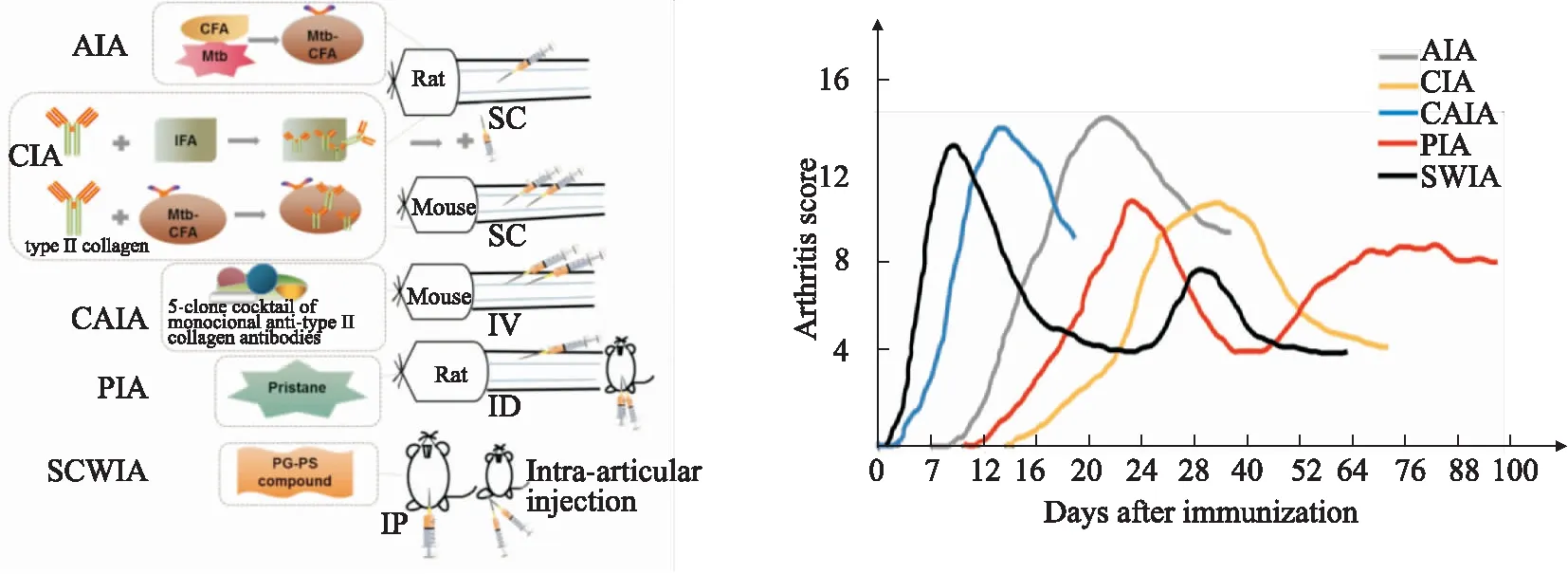
Fig 1 Induction methods and clinical progression of AIA, CIA, CAIA, PIA, and SCWIA
2 转基因型RA动物模型
转基因型RA动物模型主要选用啮齿类小鼠作为受体,利用转基因技术将特定基因转移到动物体内,使其自发性发展具有关节炎特征的疾病。目前该模型发展有很多类型,主要有K/BxN转基因模型、人TNF转基因小鼠模型和SKG小鼠转基因模型,是研究分子靶向免疫制剂和发病机制的良好模型。
2.1 K/BxN血清转移(K/BxN STA)小鼠模型K/BxN关节炎小鼠模型最早由Kouskoff等[27]于1996年发现,是通过转TCR基因的KRN-C57BL/6T小鼠与易患自身免疫性非肥胖糖尿病(NOD)小鼠杂交而成,3-4周龄自发形成慢性、进行性和对称性关节炎疾病。该模型RA发展与T细胞免疫机制及自身抗原葡萄糖-6-磷酸异构酶(G6PI)的调控有关。Korganow AS[28]等将K/BxN小鼠的血清转移到B细胞缺陷型K/BxN-μmol·L-1/小鼠,2 d内出现严重关节肿胀,组织病理学发现关节部位出现明显的炎症细胞浸润,滑膜细胞增生,血管翳形成和软骨破坏。这种以K/BxN血清或抗体转移(腹腔注射)到首次接受试验(原始)小鼠体内诱发的关节炎模型,称K/BxN血清转移关节炎(K/BxN STA)模型,是研究自身抗体介导的RA或其他关节炎及致病机制的有效工具。K/BxN STA易感性受chr2和chr1基因调控,chr2的C5区域是诱导关节炎发病的主要因素。此外,不同品系的小鼠对K/BxN血清的敏感度也有所不同,Balb/c等高易感小鼠在注射血清24 h后可见踝关节肿胀,C57BL/6和DBA/1等小鼠在d 3-d 4出现关节炎症发展,而NOD小鼠不敏感。研究表明K/BxN STA模型诱发的关节炎具有短暂性,在单次免疫的小鼠中,约d 15后关节炎症逐渐消退,但可通过反复注射抗体或血清使关节炎持续存在[28]。K/BxN STA模型和CIA或CAIA相似,都是自身抗体介导的自身免疫性疾病,疾病的发展趋势和易感性与CAIA有很多共性,可以在多种小鼠品系(ALB/c、C57BL/6和DBA/1等)中诱发,且在短时间内迅速发病,对快速筛选抗关节炎药物及新靶点治疗至关重要。K/BxN STA模型发病率高达100%,对于同品系小鼠其病理变化具有差异性小的特性。
2.2 人TNF转基因小鼠模型Kollias等[29]于1991年利用基因载体将肿瘤坏死因子(tumor necrosis factor, TNF)基因ARE的3’-UTR端由β球蛋白的3’-UTR端代替,建立慢性持续性过表达人TNF-α (TNF-Tg)动物模型。该模型约3-4周可出现自发性慢性炎症,在10周龄时发展成RA,表现出与人类RA相似的临床特征,如对称性关节炎、滑膜增生及炎症细胞浸润、关节软骨和骨骼破坏等。TNF-Tg小鼠模型表型稳定,病程进展呈现慢性炎症,有利于药物的开发及诊疗技术的改进,与基因敲除小鼠(无T细胞和B细胞)杂交后仍然表现关节炎症状。该模型适合做靶向RA的淋巴细胞反应或细胞因子TNF-α等抗体的靶向治疗及相关免疫机制的研究。
2.3 SKG小鼠转基因模型Sakaguchi等[30]通过对BALB/c小鼠进行ZAP-70基因编码,使SH2结构域自发突变发展T细胞介导的慢性自身免疫性关节炎(SKG小鼠模型)。SKG小鼠约2月龄可见小关节(足趾、足踝)明显肿胀,进而出现对称性关节炎和滑膜炎,骨密度及活动性能受到严重损害,与人类RA因慢性炎症而致骨质疏松症相似,属于T细胞介导的慢性自身免疫性多关节炎。6月龄以上大部分小鼠可发展为间质性肺炎,并伴有不同程度的血管周围炎,还有少部分具有皮下坏死性小结节等关节炎表现。SKG小鼠的自发性关节炎发展缓慢,且与可变发病率相关,用β-葡聚糖或酵母多糖A干预有利于模型的控制和复制,且♀SKG小鼠关节炎发生率高于♂ SKG小鼠。
3 总结与展望
RA动物模型研究结果的可靠度取决于与人类RA的可比拟度,好的动物模型在遵守动物福利的基础上应尽可能与人类疾病相似,最好能在两种动物体内复制该疾病,且易控制,符合经济原则。RA动物模型主要是啮齿类大小鼠,因造模方式和动物品系各异,不同动物模型所表现的疾病特点也有所不同。据上文所示,无论是实验诱导型还是自发性转基因型RA模型,都不能反映人RA疾病的全部特性,只能在某一方面或多个方面体现人类RA的部分特征。研究者应仔细评估各种模型的优缺点,以便为要解决的科学问题提供适当的选择。
研究T细胞及亚群相关机制又考虑经济性,可选择AIA模型;CIA因能较好地模拟人类RA的病理特征,仍是目前公认研究RA病理机制和评价治疗药物的最佳动物模型。CAIA造模方便,可快速发病,便于抗原免疫机制和新药研究,但所需费用昂贵;PIA和SCWIA的病理主要特征是由急性炎症转为慢性反复性炎症,PIA病程较长,具有多种自身抗体升高的特性,适合慢性炎症及自身抗原相关的研究。转基因关节炎小鼠模型主要表现为自发的慢性进行性多发关节炎,其中K/BxN STA模型在众多研究中将其归为基因型模型,实际上是转基因模型和实验诱导型的结合体,主要是以K/BxN小鼠的血清为自身抗体进行免疫诱导,可快速自发性形成关节炎[28],和转基因关节炎一样也可用于分子生物层面上的RA 病因病机及靶向药研究。
目前,尽管对RA的病因及发病机制有了一定的了解,但模型制备方法及评价标准均无统一、规范的实施标准。毫无疑问,动物模型显然为RA发病机制和药物筛选提供参考。随着动物模型研究和实验方法的发展,有望进一步探寻更具有RA特点的动物模型。

