尼妥珠单抗联合吉西他滨一线治疗晚期胰腺癌的疗效观察
韩 春,叶斯斯,李 娟,乔 迁,张文胜
解放军总医院第一医学中心 肿瘤内科,北京 100853
近年来,各种新药的问世将恶性肿瘤的治疗推进到了一个高歌猛进的时代,但由于胰腺癌自身高度恶性的病理特点及肿瘤微环境的复杂性,胰腺癌的治疗研究进展缓慢,5年生存率极低,仅为2%~6%[1-2]。针对胰腺癌预后极差的这一现状,国内外开展了多个相关的药物临床研究,希望能在现有治疗药物的基础上,找出尽可能延长胰腺癌晚期患者生存期的联合治疗方案。胰腺癌与胃癌、结直肠癌等消化道肿瘤不同,无特异性治疗靶点,但以表皮生长因子受体(epidermal growth factor receptor,EGFR)为靶点的药物对晚期胰腺癌患者展现出了一定的疗效。2005年FDA批准小分子EGFR酪氨酸激酶抑制剂厄洛替尼联合吉西他滨(gemcitabine,GEM)应用于晚期胰腺癌,但因其能提升的疗效实在有限,现临床应用很少。而另一以EGFR为靶点的单抗药物尼妥珠单抗在2008年4月被欧盟药监局授予胰腺癌“孤儿药”资格。基于国外良好的临床研究数据,2020年版《CSCO胰腺癌诊疗指南》推荐尼妥珠单抗联合GEM可作为晚期胰腺癌的一线化疗方案[3]。本文旨在以回顾性队列研究的方法探讨尼妥珠单抗联合GEM对我国晚期胰腺癌患者的疗效及其安全性,为该方案是否适用于我国患者提供一定的临床证据。
资料和方法
1 资料来源 选取2012年1月- 2019年6月解放军总医院第一医学中心收治的以尼妥珠单抗+GEM或GEM单药作为一线化疗方案的无法经手术根治切除的胰腺癌患者的病例资料。纳入标准:1)原发性胰腺癌;2)初诊时分期为Ⅲ期或Ⅳ期,经评估后无法行根治性切除;3)一线化疗前未接受任何抗肿瘤治疗,包括放疗、局部消融或粒子植入、免疫治疗、姑息手术等;4)一线治疗前有可经影像学评价疗效的原发或转移病灶;5)一线化疗前血常规及血生化指标正常;6)一线化疗期间至少有一次对治疗效果的评价。排除标准:1)病理确诊为转移性胰腺癌;2)分期为Ⅰ期、Ⅱ期或部分Ⅲ期,经评估后可手术根治切除;3)在一线治疗前已接受过包括放疗、局部消融或粒子植入、免疫治疗、姑息手术等任何的抗肿瘤治疗;4)一线治疗前无可经影像学评价疗效的原发或转移病灶;5)一线化疗前存在血常规指标及肝肾功能异常,无法耐受化疗;6)无一线治疗抗肿瘤效果评价。
2 化疗方案 1)联合组:尼妥珠单抗(给药剂量:400 mg/次;给药频率:每周1次)+GEM(给药剂量:1 000 mg/m2;给药频率:每个周期的第1天及第8天分别给药,每3周为1周期)。2)单药组:GEM (给药剂量:1 000 mg/m2;给药频率:每个周期的第1天及第8天分别给药,每3周为1周期)。
3 疗效、安全性及生存评价 1)疗效评价标准:按照《实体瘤的疗效评价标准》版本1.1进行评价。2)安全性评价:化疗的急性不良反应判定按美国癌症研究所常见毒性判定标准3.0版。3)生存评 价:无 进 展 生 存 期(progression free survival,PFS) —— 确诊至首次记录到疾病进展或任何原因导致死亡(以先发生者为准)的时间;总生存期(overall survival,OS) —— 确诊至因任何原因所致死亡的时间。对于最终分析时无记录显示进展或死亡的受试者,将删失至最后一次随访的日期。随访终点时间为2020年6月。
4 统计学分析 统计软件为SPSS23.0。计数资料率的比较采用χ2检验或Fisher’s精确检验。单因素生存分析采用Kaplan-Meier法,多因素生存分析采用Cox比例风险回归模型。P<0.05为差异有统计学意义。
结 果
1 两组一般资料比较 根据年龄、临床分期和转移器官数进行1∶1匹配后,联合组和单药组均有61例患者。两组患者性别、年龄、肿瘤位置、分化程度差异无统计学意义(P>0.05),具有可比性。见表1。
2 不良反应发生情况比较 联合组化疗周期总数为281个周期,平均为4.6(1~10)个周期。其中47例(77.1%)化疗过程中无药物减量,8例(13.1%) GEM用量减低,6例(9.8%)治疗间隔延长。单药组化疗周期总数为192个周期,平均为3.2(1~8)个周期。其中51例(83.6%)化疗过程中无药物减量,7例(11.5%) GEM用量减低,3例(4.9%)治疗间隔延长。与治疗相关的中性粒细胞或血小板减少、恶心呕吐反应、肝功能损伤、皮疹等常见的不良事件发生率方面,两组差异无统计学意义(P>0.05)。见表2。
3 生存分析 截至随访终点时的生存分析。联合组:一线化疗后进展61例,死亡57例,生存4例;PFS为2.1~13.9个月,中位PFS为4.5个月,OS为2.1~24.9个月,中位OS为7.4个月。单药组:一线化疗后进展61例,死亡59例,生存2例;PFS为0.5~8.4个月,中位PFS为3.1个月,OS为2.3~11.9个月,中位OS为6.4个月。log-rank检验显示,联合组的中位PFS(P<0.001)及中位OS(P<0.001)较单药组的延长均有统计学差异。两组PFS及OS见图1、图2。

图1 两组一线化疗PFS生存曲线Fig.1 Kaplan–Meier curves for progression-free survival in the two groups
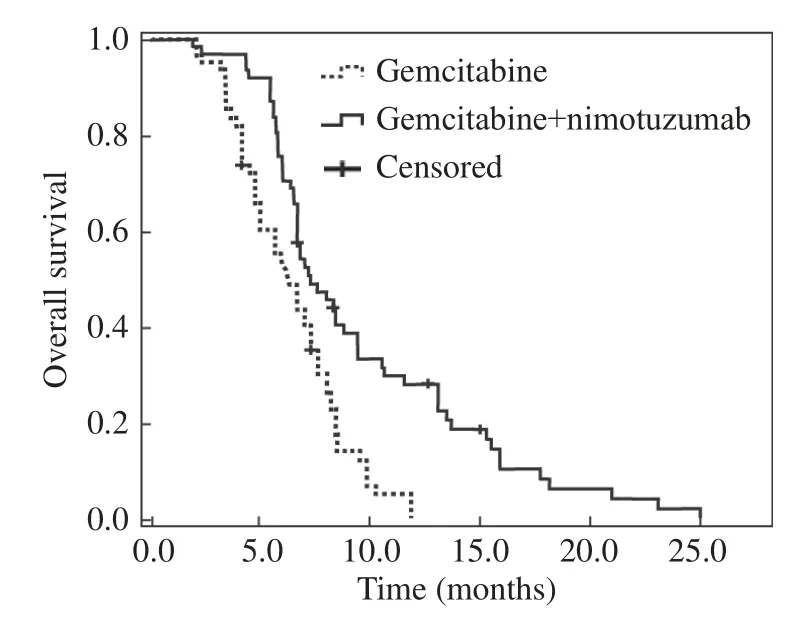
图2 两组一线化疗OS生存曲线F ig.2 Kaplan–Meier curves for overall survival in the two groups
4 单因素及多因素生存分析 单因素分析结果显示,临床分期、转移器官数目、一线化疗方案是影响患者PFS和OS的独立因素(表3)。根据单因素结果将上述3个因素进一步使用Cox比例风险模型进行多因素分析,由于临床分期和转移器官数目这两个变量存在交互作用,因此将这两个变量分别纳入不同的模型中。将临床分期和一线化疗方案纳入模型A,结果显示临床分期和一线化疗方案[PFS:HR 0.323(0.218~ 0.477),P<0.001;OS:HR 0.427(0.285~0.639),P<0.001]是独立预后因素。将转移器官的数目和一线化疗方案[PFS:HR 0.275(0.183~0.413),P<0.001;OS:HR 0.428(0.283~0.647),P<0.001]两个变量纳入模型B,结果同样显示一线化疗方案是影响患者PFS和OS的独立因素(表4)。
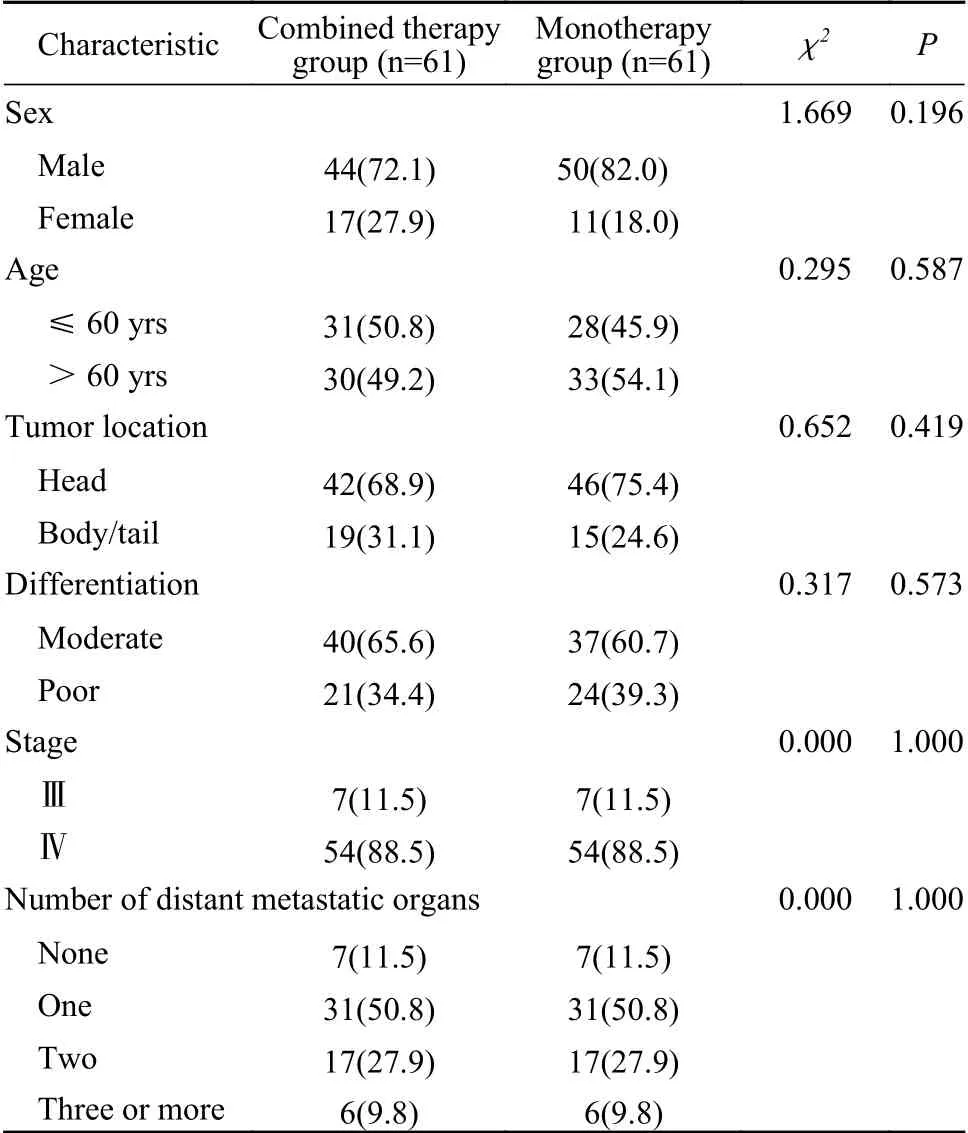
表 1 两组患者一线治疗前基线情况比较(n, %)Tab. 1 Clinicopathological characteristics of patients in the two groups before treatment (n, %)
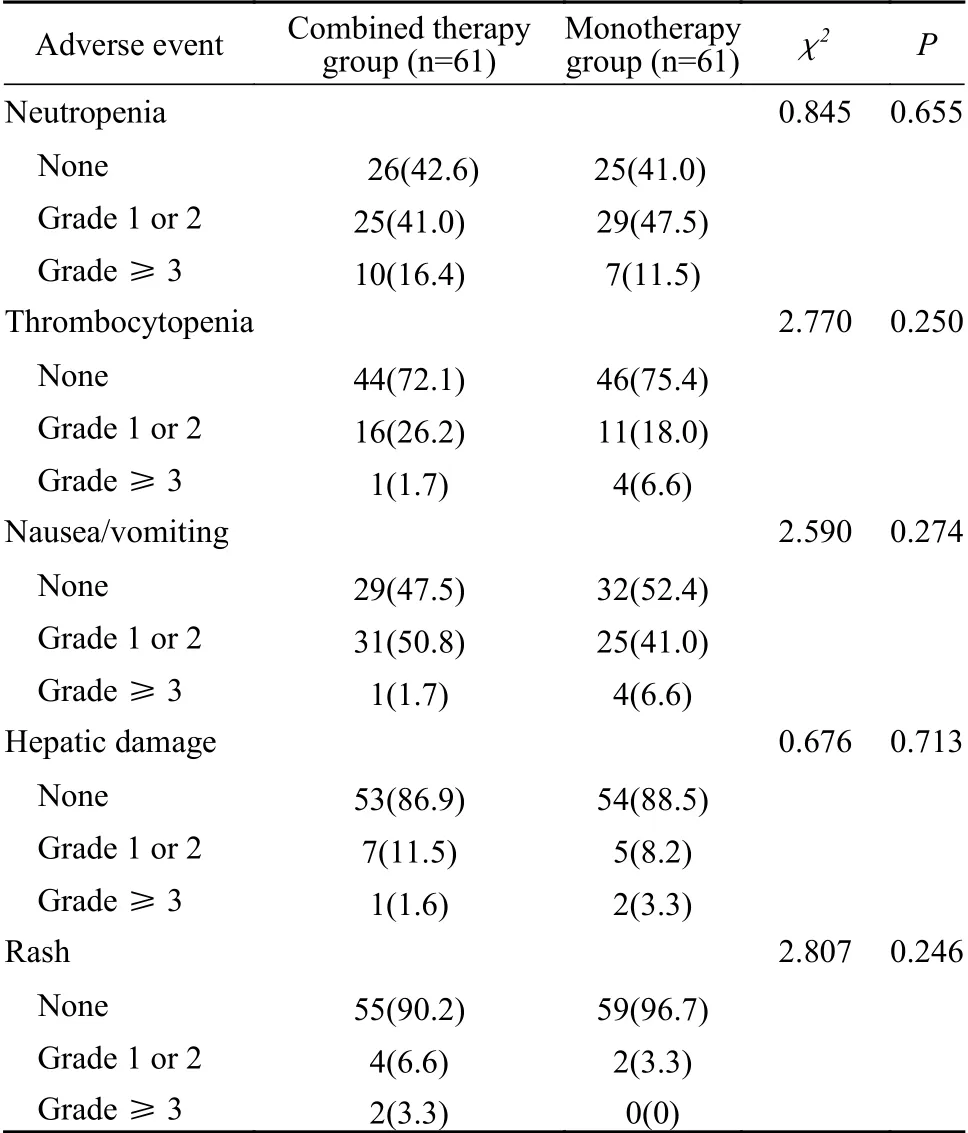
表 2 两组患者一线化疗不良事件发生率比较(n, %)Tab. 2 Comparison of adverse events related to chemotherapy regimen between the two groups (n, %)

表 3 影响晚期胰腺癌患者预后的单因素分析Tab. 3 Univariate analysis of factors associated with survival in patients with advanced pancreatic cancer
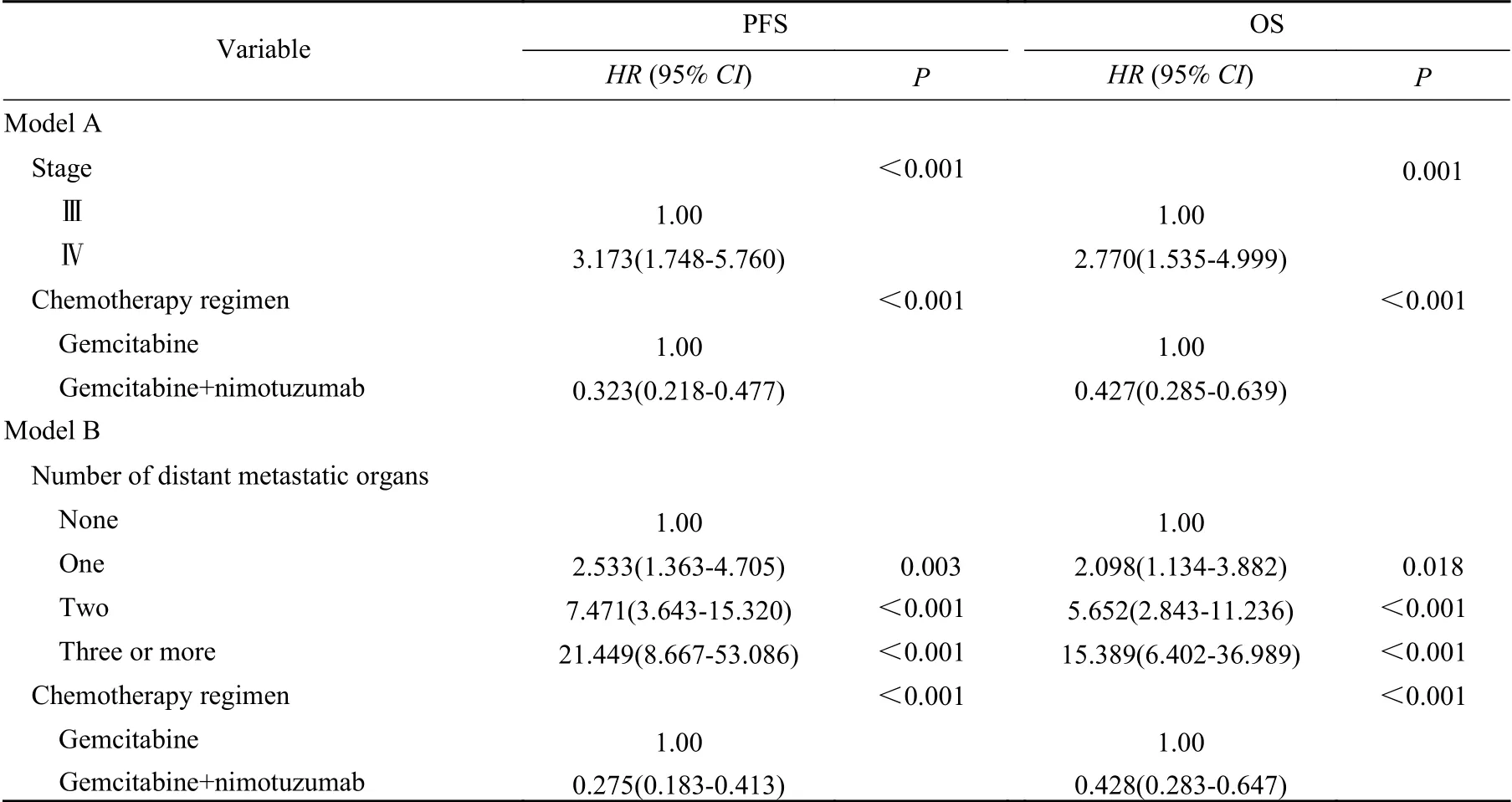
表 4 影响两组晚期胰腺癌患者预后的Cox回归分析Tab. 4 Cox regression analysis of factors associated with survival in patients with advanced pancreatic cancer
讨 论
GEM为晚期胰腺癌标准的一线化疗药物,但其对生存期的改善程度有限,一线接受GME单药化疗的晚期胰腺癌患者中位OS为6个月左右[4]。联合化疗方案奥沙利铂+氟尿嘧啶+亚叶酸钙+伊立替康可明显延长晚期胰腺癌患者的生存期,其中位OS可达到11.1个月,但三药联合方案不良反应增多,一般患者难以耐受,大大限制了其临床应用[5]。近年来靶向治疗的兴起,也使得研究者将研究重点转向胰腺癌微环境内的多种成分及相关的信号转导途径,其中EGFR通路受到了极大的关注。研究表明EGFR及其配体的表达水平越高,其预后越差[6]。研究者们认为,EGFR及其相关配体可能以自分泌环路的形成持续刺激胰腺肿瘤细胞的增殖。临床前研究也显示EGFR信号通路的异常激活贯穿于胰腺癌的浸润和转移过程中,通过选择性的一致EGFR信号通路可以抑制胰腺癌转移[7]。胰腺癌间质纤维化是化疗药物难以进入肿瘤内部的重要原因之一,而EGFR信号通路通过胰腺星状细胞的介导,在这一过程中起着举足轻重的作用[8]。因此,根据上述研究结果,通过抑制EGFR信号通路的异常激活或调节其信号通路相关的上下游分子的表达或许能抑制胰腺癌细胞的生长,这也是EGFR抑制剂应用于胰腺癌治疗的理论基础。最早的尝试为小分子EGFR酪氨酸激酶抑制剂厄洛替尼,但其临床研究的结果是令人失望的,其对晚期胰腺癌患者的生存延长极为有限,与GEM相比,OS也仅从5.91个月延长至6.24个月[9]。
与厄洛替尼不同的是,尼妥珠单抗是一种单克隆抗体,其特异性结合位点是EGFR的胞外区域。通过竞争性地抑制EGFR与内源性配体的结合,尼妥珠单抗可对EGFR通路起到有效的负向调节作用,包括抑制酪氨酸激酶磷酸化及阻碍EGFR二聚体的形成,从而减弱或中止其信号转导过程[10-11]。Crombet-Ramos等[12]发现在肿瘤原位小鼠模型中,尼妥珠单抗可通过下调血管内皮生长因子的表达,减少肿瘤细胞的营养供应从而促进凋亡。此外,尼妥珠单抗还可直接激活抗体依赖细胞介导的细胞毒效应和补体依赖的细胞毒效应等,有效杀灭肿瘤细胞[13-14]。随后,尼妥珠单抗被证实在体内对EGFR过表达的KRAS野生型胰腺癌具有良好的抗肿瘤活性[14]。2017年,Schultheis等[15]主持的一项多中心的Ⅱb期临床研究结果显示,GEM联合尼妥珠单抗组在一线治疗晚期胰腺癌时,1年的OS率及PFS率分别为34%及22%,而在GEM+安慰剂组,这一数据分别为19%和10%。生存期方面,GEM 联合尼妥珠单抗组的中位OS和PFS分别为8.6个月及5.1个月,而GEM加安慰组的中位OS和PFS则分别为6个月及3.4个月。我国亦有多家医院报道过尼妥珠单抗联合化疗治疗晚期胰腺癌的临床观察数据,均显示出不错的疗效[16-18]。
上述提到的研究数据均来自国外临床研究,考虑到人种、环境和流行病学因素均可能对药物的敏感度及耐受性产生影响,因此我们想要进一步证实尼妥珠单抗联合GEM对我国晚期胰腺癌患者的疗效。本研究结果显示,病例组的中位PFS和中位OS分别为4.5个月和7.4个月,而单药组的中位PFS和中位OS则分别为3.1个月和6.4个月。联合组相较于单药组,一线治疗的PFS及总OS均明显延长(P<0.001)。进一步的多因素分析显示一线应用尼妥珠单抗联合GEM可独立影响晚期胰腺癌患者的PFS及OS。因此,本研究的结果提示了尼妥珠单抗联合GEM作为晚期胰腺癌患者的一线化疗方案可使患者生存获益,与上述临床试验的结果相符。
在化疗不良反应发生率方面,本研究发现GEM单药组与尼妥珠单抗联合GEM治疗组的一线化疗不良反应发生情况无统计学差异。这与尼妥珠单抗本身的药物特性相关,其是一种高度人源化的小鼠单克隆抗体,亲和力常数为10-9~10-8mol/L,对EGFR仅具有中等的亲和力。同时尼妥珠单抗具有较高的选择性,可使该药物在体内达到最佳分布(肿瘤组织高摄取,在正常组织低摄取),有效减少了尼妥珠单抗对正常组织的损伤,降低了皮疹等不良反应的发生率,因此患者对其耐受性良好[19]。
本研究是一项回顾性队列研究,一些限制和缺陷无法避免。首先,本研究虽然尽可能使病例组和单药组在一般资料的分层上基本匹配,但仍无法避免选择偏倚;其次,由于电话随访很难获得患者完整可靠的院外治疗情况,故本研究未纳入在患者一线化疗进展后的治疗情况,统计分析结果存在一定的偏倚。综上所述,通过回顾性队列研究,本研究显示了尼妥珠单抗联合GEM方案一线治疗晚期胰腺癌的疗效确切,且不增加不良反应,对于进展期胰腺癌患者来说是一个可供选择的一线治疗方案。

