肺癌患者胸腔镜下肺段切除与肺叶切除术后房颤发生率的比较*
张玉琨,李波,刘静,赵红利,邹青
710038 西安,空军军医大学第二附属医院 心脏内科
心房颤动(atrial fibrillation,AF)是临床常见的心律失常(占总人口的1.5%~2%)[1],也是一种常见的外科术后并发症,在非心胸外科手术后为0.4%~12%,在心胸外科手术后可高达16%~46%[2]。术后发生房颤会增加患者的术后ICU停留时间、住院时间和住院费用,并有导致心脑血管栓塞的风险,甚至可能威胁患者生命[3-4]。因此,有效预防和快速处理术后房颤对于肺切除患者的顺利康复具有重要意义。近年来,随着早期肺癌筛查和胸部微创技术的日益普及,胸腔镜下肺叶和肺段切除成为肺癌治疗的主流手段。但是,目前微创条件下肺叶切除或肺段切除对术后房颤发生率的影响尚不清楚[5],因此,本研究旨在比较胸腔镜下行肺段切除术和肺叶切除术的肺癌患者术后房颤的情况,以进一步探讨微创条件下肺癌术后房颤的发生机制,为有效预防房颤的发生和快速处理术后房颤提供理论支持。
1 资料与方法
1.1 纳入排除标准
对我院胸腔外科单一手术组2018年6月1日至2020年6月1日入院的肺癌手术患者进行回顾性分析。入选标准:术前影像学确定为临床ⅠA期,病变可手术切除,患者年龄>50岁,术前为窦性心律。排除标准:术前非窦性心律、术前有阵发性或者慢性房颤病史、口服I或Ⅲ类抗心律失常药物、肺叶楔形切除术、袖式切除术、双肺叶切除、全肺切除术、胸壁侵犯切除等广泛切除的患者。术前由于高血压或冠心病而口服β受体阻滞剂的患者在术后第一天重新开始口服上述药物。
1.2 麻醉与手术
所有患者均由同一胸外科医生主刀完成,手术均采用标准的麻醉诱导,双腔插管麻醉,术中药物维持,术后均采用镇痛泵静脉内泵入阵痛,24小时撤除镇痛泵后根据患者需要给予肌注或口服镇痛药。肺叶切除组的患者给予解剖性肺叶切除术和单侧纵隔淋巴结系统性清扫或淋巴结采样,肺段切除组的患者根据患者病变位置和大小行肺段、联合亚段、亚段切除术和淋巴结采样术。所有手术均采用三孔式手术方式,观察孔在腋中线第7肋间,长约1 cm,主操作孔位于腋前线第3~4肋间,长约2~3 cm,副操作孔在肩胛线第8~9肋间,长约1.5 cm。
1.3 房颤的诊断和治疗
所有患者术后进入监护室进行24~96 h的动态心电图监测,病情平稳后转出监护室,转出后有心律失常者立即进行动态心电图检测,检测时间延长至心电图维持正常后48 h。根据电生理学定义,至少大于30秒或在ECG记录持续时间内显示AF。心电图的具体表现为伴有p波消失的心律失常,脉率心率不等。治疗房颤一般按照以下策略进行:首先,可使用钙离子拮抗剂或者β受体阻滞剂控制心率。如果患者的血流动力学稳定,我们可以用ⅠA或ⅠC抗心律失常药物纠正心律。如果患者血流动力学不稳定,可以考虑给予患者电复律。最后,如果患者房颤持续发作超过48 h,立即开始抗凝治疗。抗凝可选用低分子肝素钙,利伐沙班等较为温和的抗凝药物[6-7]。
1.4 其他术后管理
肺叶切除和肺段切除患者术后管理模式相同,术后第二天正常进食,鼓励患者咳嗽,整体状态良好者鼓励尽早下地活动,状态较差者可在床上活动,家属定期按摩下肢,每日液体控制在25 mL/kg以下;常规放置胸腔引流管,引流液无异常,每日引流量小于150 mL,透视胸腔无积气积液后可拔出胸引管。
1.5 统计分析
分析术前和手术后的临床因素,包括性别、年龄、吸烟史、术前呼吸功能、缺血性心脏病病史、手术方式、手术时间、出血量、纵隔淋巴结清扫方式等。采用SPSS 19.0统计学软件处理数据。计量变量以(均数±标准差)表示,采用分位数图(Q-Q图)和矩法对计量变量进行正态性检验,采用Levene检验考察计量变量组间是否方差齐同,服从正态分布且方差齐同的计量变量两组间均数比较采用成组t检验,否则采用Mann-WhitneyU检验比较计量变量两组间中位数差异;计数变量采用频数和百分比进行表示,组间构成比较采用χ2检验。采用多因素Logistic回归筛选肺癌患者胸腔镜下肺段切除与肺叶切除术后房颤影响因素。P<0.05表示差异具有统计学差异。
2 结 果
2.1 基本临床资料
在2018年6月1日至2020年6月1日共有672例肺癌患者接受择期的胸腔镜下手术治疗,其中年龄50岁以上,接受肺叶切除术者212名,肺段切除者113名,合计325名患者。对比两组患者术前基本资料,两组患者年龄(P=0.056)、男性患者比率(P=0.281),吸烟患者比率(P=0.146),术前肺功能(FEV1%,P=0.458;%VC,P=0.733)等无统计学差异,肺段手术患者术中耗时和纵隔淋巴结清扫比率均显著低于肺叶组(P=0.001),两组患者术中出血量无统计学差异(P=0.408)。术后共21例患者发生房颤,术后房颤总体发生率为6.46%,其中肺叶切除组18名(8.49%),肺段切除组3名(2.65%),两组间比较可见肺段切除组术后房颤发生率显著低于肺叶切除组(P=0.042)(表1和表2)。

表1 肺叶切除组和肺段切除组患者的临床资料(计量变量)

表2 肺叶切除组和肺段切除组患者的临床资料(计数变量)
2.2 切除位置与房颤发生的关系
212名切除肺叶患者按照切除的不同部位分组,右下(11.42%)和左上(11.11%)房颤发生率最高,但切除不同部位肺叶患者房颤发生率差异无统计学意义(P=0.662)(表3)。113名肺段切除患者按照切除的不同肺段分组,房颤主要发生在左肺固有上叶(20%)和右肺下叶基底段(33%)(表4)。
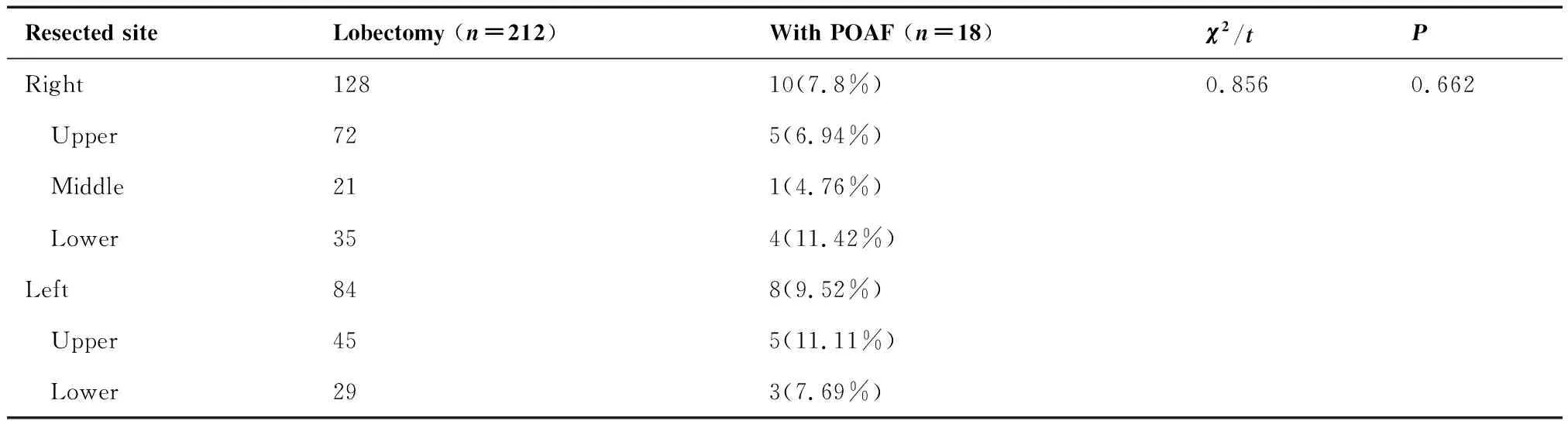
表3 肺叶切除组中不同肺叶切除后发生房颤的比率
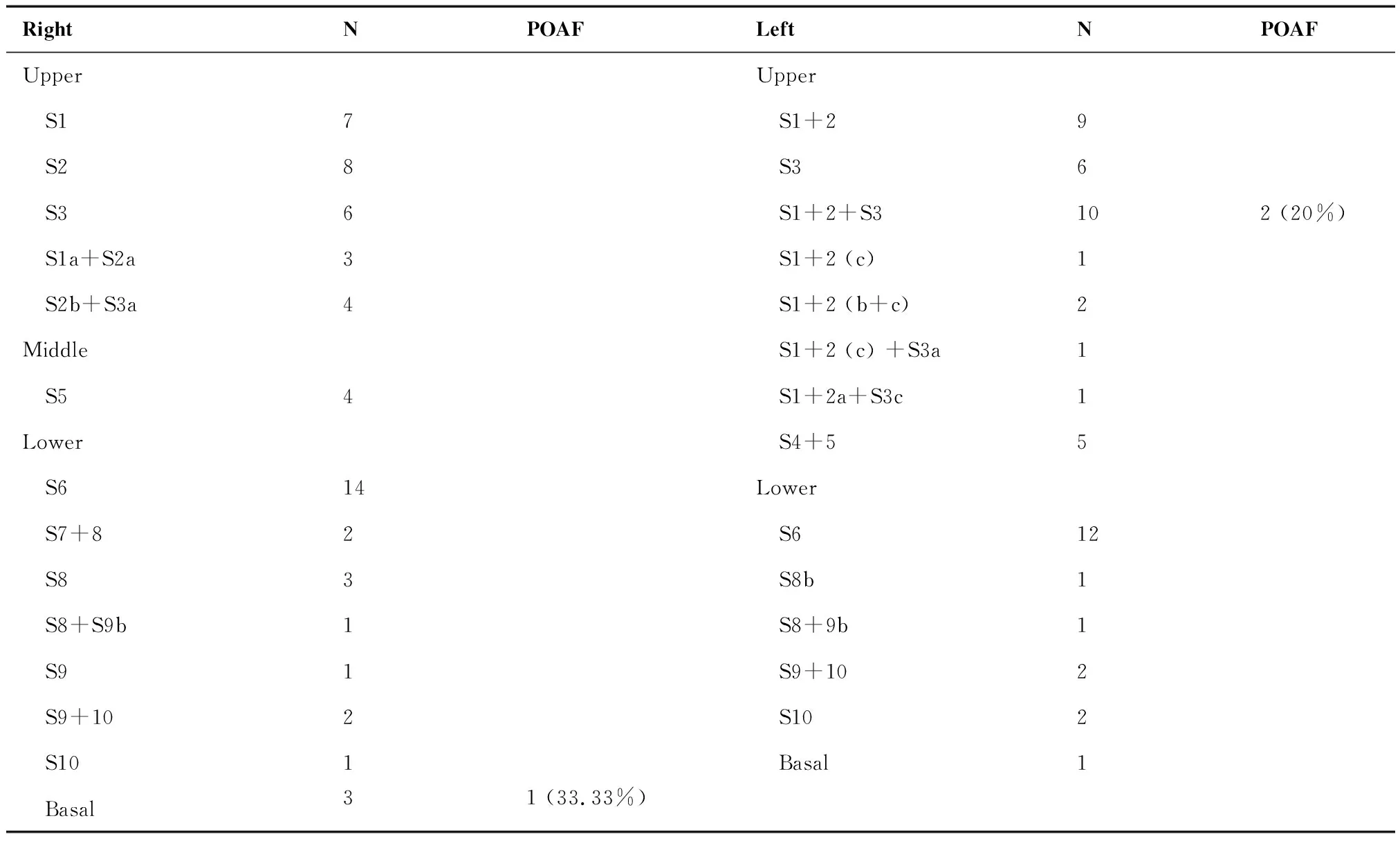
表4 肺段切除组中不同肺段切除后发生房颤的比率
2.3 房颤危险因素单因素分析结果
表5总结了发生房颤和未发生房颤的患者的临床资料,患者的性别(P=0.765),吸烟史(P=0.386),术前肺活量(P=0.480),术中出血量(P=0.825)在是否出现房颤的两组患者中无统计学差异,但是出现房颤的患者平均年龄较未出现房颤的患者更高(P=0.034),术前一秒率更低(P=0.001),标准淋巴结清扫率更高(P=0.036),平均手术时间更长(P=0.043),肺段切除比率更低(P=0.042)。

表5 房颤危险因素单因素分析结果

(Table 5 continues on next page)
2.4 房颤危险因素多因素分析结果
采用多因素Logistic回归分析发现,肺段切除组患者术后发生房颤高于肺叶切除组患者(OR=0.207,P=0.037),患者FEV1/FVC≤70%是术后房颤的保护因素(OR=0.092,P<0.001),患者手术时间是术后房颤的危险因素(OR=1.039,P<0.001)(表6)。
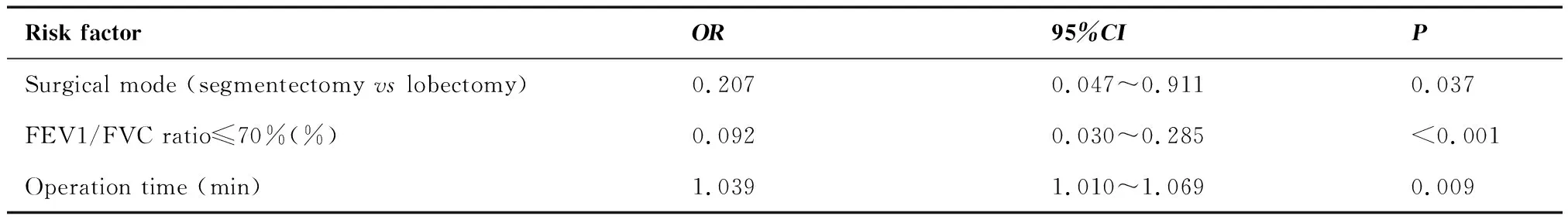
表6 房颤危险因素多因素分析结果
3 讨 论
房颤是肺部分切除术后的一种常见的并发症,但是目前对其发病危险因素上没有统一定论[8-9]。在我们的研究中,房颤的发生率为6.46%,低于目前报道的平均数值。这可能和我们所有入组的患者都是微创手术有关。另外,我们常规动态心电图检测时间为24~72小时,有可能个别迟发的一过性心律失常的患者无明显症状,房颤症状未被发现。有文献指出术后房颤的发生于患者的年龄、肺组织切除范围、性别、临床分期,冠心病史以及纵隔淋巴结清扫有关。但是也有很多学者持反对意见。Amar等[10]和He等[11]对接受肺叶切除、全肺切除以及食管部分切除的患者进行了回顾性分析,证实了术后房颤发生率随着患者年龄的增加,是术后房颤发生的独立危险因素。在我们的研究中,房颤组患者中位年龄更高,但是多因素分析尚不能说明年龄是房颤发生的独立危险因素,可能与我们房颤总体发生率较低有关。Asamura等[12]的研究表明,随着肺组织切除范围的增大,房颤的发生率显著增加。这与我们的研究同样相符合,在我们的研究中,行肺段切除的患者房颤发生几率显著低于肺叶切除组。有学者提出全肺切除是术后房颤发生的独立危险因素,本实验中排除了全肺切除的患者,而且所有的手术都在微创条件下完成,可能是本实验房颤总体发生率低于其他报道的原因。另外Vaporciyan等[13]发现单病灶楔形切除和多病灶多个楔形切除患者的术后房颤发生率相似,意即尽管增加了肺组织切除的总量,患者的房颤发生率并未随之增加,因此提出肺门游离(尤其是肺静脉的游离)可能是诱发术后房颤发生的原因。在我们的研究中,排除了楔形切除,所有患者经历了肺动、静脉的骨骼化和肺门处淋巴结的游离和采样。但是肺段切除组的术后房颤发生率显著低于肺叶组,研究显示[14],肺段切除术后,FEV1平均可保留至术前水平的90%以上,较之肺叶切除多10%左右,对于体质较弱、肺功能较差的患者,肺段切除能够更有效地减少缺氧对患者带来的不利影响,因此我们更倾向认为肺组织的切除范围可能和术后房颤发生率相关。另外,有文献报道术前肺功能不全是肺术后房颤发生的独立危险因素,这也与我们的研究相符合。肺叶切除组肺组织损失更多,对术后肺功能的影响更大,心肌组织缺氧也可能会有诱发房颤的发生[15-16]。因此术后积极改善患者缺氧,如严格预防肺部感染,持续低流量吸氧等均可能有效预防房颤发生。还有学者报道指出,肺段切除和肺叶切除对患者同样造成术后应激,手术时间和术中出血量无明显区别,两组患者术后房颤发生无显著区别,这与我们的研究结果不相符合,在我们的研究中,肺段切除组术后出现房颤共三名患者,其中一名患者为基底段切除,还有两名患者均为左肺上叶S1+2+S3切除,切除肺组织相对相对较大,因此我们认为手术切除范围增加会导致房颤发生率增加。Xin等[17]学者认为左侧肺叶切除会增加房颤的发生率,但是我们的研究中并没有发现这些现象,也有学者认为纵隔淋巴结清扫会增加房颤的发生率[18],在我们的研究中,肺段切除患者多数仅行淋巴结采样,纵隔淋巴结周围的自主神经丛骚扰显著少于对照组,也有可能是房颤发生率少的原因之一。但是在肺叶切除组中,部分患者仅进行淋巴结采样,还有部分患者清扫淋巴结的时候进行了迷走神经保护,这两类患者的房颤发生率也较常规纵隔淋巴结清扫的患者低,提示自主神经丛广泛损伤有可能会增加房颤发生的几率。另外,在我们的研究中,随着手术时间增加,房颤发生率增高。本实验由同一手术组完成,手术时间延长可能与肺门操作困难,手术难度增加相关。肺门操作难度增加可能会增加自主神经丛损伤的的程度,增加心律失常发生可能。另一方面,手术时间延长,呼吸机单肺通气时间增加,肺组织损伤可能性增大,增加术后缺氧可能,从而增加房颤发生可能性。
患者出现房颤后我们首先使用钙离子拮抗剂或者β受体阻滞剂控制心率。如果患者的血流动力学稳定,我们可以用ⅠA或ⅠC抗心律失常药物纠正心律。其中胺碘酮是我们最常用的治疗药物,目前报道认为胺碘酮是预防与治疗快速心律失常最有效的抗心律失常药物[19],在外科使用相对简单,使用禁忌较少。但是,由于胺碘酮具有剂量累积性的肺毒性,因此在我们的工作中不常规使用胺碘酮进行房颤的预防,而仅在房颤发生后进行对症治疗。
本研究具有一定的局限性。首先,这是一项回顾性研究;其次,本研究中总体房颤的发生率较低,对于房颤的发生危险因素分析相对不够充分;因此,我们在后期可设计随机对照试验对上述因素进行深入分析,从而提供更有利的证据。
综上所述,在我们的回顾性研究中,肺段切除患者的房颤发生率显著低于肺叶切除组,患者术前肺功能状态和术中自主神经丛的保护和心肌供养状态均可能对房颤的发生造成影响。因此对于高龄,心脏具有既往疾病史的房颤高危患者,可充分评估手术风险和妥协手术的利弊,考虑行肺段切除术或保护自主神经的肺叶切除术。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

