FOXJ1通过调控MMP2/9和β-catenin抑制胃癌转移的机制研究*
王静,李灵敏,刘晓峰,樊代明
250000 济南,中国人民解放军联勤保障部队第九六〇医院 消化内科(王静、李灵敏、刘晓峰);710032 西安,空军军医大学西京消化病医院 肿瘤生物学国家重点实验室(王静、樊代明)
胃癌是全球致死率第三的恶性肿瘤[1],也是我国发病率最高的消化道恶性肿瘤,进展期胃癌患者的5年生存率仅约20%[2]。因此,探讨胃癌恶性进展的关键分子机制,是预防胃癌转移、改善患者预后的关键环节。叉头框蛋白J1(forkhead box J1, FOXJ1)在胃弯曲的发育形成中发挥重要转录调控功能[3]。我们前期率先发现FOXJ1是抑制胃癌增殖和转移的重要转录因子,并可作为影响胃癌患者生存的独立预测因素[4]。然而FOXJ1在胃癌中的作用机制仍未明确。
胃癌的侵袭转移是一个多阶段进展过程,而细胞外基质(extracellular matrix,ECM)降解、基底膜破坏是肿瘤细胞转移最初环节。基质金属蛋白酶(matrix metalloproteinases,MMPs)可降解ECM,有利于肿瘤细胞穿破基底膜,发生浸润和远处转移。其中,IV型胶原酶MMP-2、MMP-9的作用最为直接[5]。我们前期发现FOXJ1可抑制胃癌细胞分解Matrigel从而穿过微孔滤膜的能力[4],而Matrigel的主要成分即为Ⅳ型胶原、层黏连蛋白等。另外,Wnt/β-catenin通路异常活化在胃癌的增殖、侵袭、转移、耐药等多种病理过程均发挥重要作用[6]。有研究报道,FOXJ1-Wnt/β-catenin轴调控斑马鱼Kuffer’s囊泡纤毛的形成[7],Wnt通路可能是FOXJ1转录调控纤毛形成网络中的重要通路[8]。因此,本研究针对参与肿瘤侵袭转移的关键分子MMPs和通路Wnt/β-catenin,探讨FOXJ1抑制胃癌转移的分子机制,为进一步拓展对胃癌转移信号通路的新认识、开发干预胃癌转移的潜在靶点提供新的思路。
1 材料与方法
1.1 细胞培养
高/低转移潜能胃癌细胞系MKN28M/MKN28NM由空军军医大学西京消化病医院肿瘤生物学国家重点实验室建立并保存,即将人胃癌细胞系MKN28经反复Transwell迁移和侵袭实验筛选获得的高/低转移潜能胃癌细胞亚系,病毒包装细胞293T购自ATCC。MKN28M-FOXJ1、MKN28M-control、MKN28NM-shFOXJ1、MKN28NM-shcontrol使用含2 μg/mL嘌呤霉素的完全培养基常规培养。
1.2 慢病毒稳定转染细胞系建立
过表达慢病毒和RNA干扰慢病毒载体系统购自上海吉凯基因化学技术有限公司,包括:GV166载体、GV248载体、pHelper 1.0载体和pHelper 2.0载体。根据MOI值1∶100进行慢病毒感染,加入嘌呤霉素(2~4 μg/mL)筛选7~10 d,获得稳定感染细胞株,利用Real-time PCR和Western blot鉴定感染效率。
1.3 Real-time PCR
各靶基因的引物序列为:FOXJ1(F):5’- TGGATCACGGACAACTTCTGCTA-3’;FOXJ1(R):5’- CACTTGTTCAGAGACAGGTTGTGG-3’;MMP2(F):5’- ACGATGATGACCGCAAGT-3’;MMP2(R):5’-GGTTCATTTGGCGGACTG-3’;MMP9(F):5’- TCCCTGGAGACCTGAGAACC-3’;MMP9(R):5’-AAACTACTCGGAAGACTTGCC-3’;TIMP1(F):5’- TCTGGAAACGACATTTATGG-3’;TIMP1(R):5’- GTTGGAGGCCTGCTTATGGG-3;TIMP2(F):5’-ACTGTTGGTGGGAACTCAGAAG-3’;TIMP2(R):5’-CAAGGTCAATGTCAGGAGAGG-3’;GAPDH(F):5’- GCACCGTCAAGGCTGAGAAC-3’;GAPDH(R):5’- TGGTGAAGACGCCAGTGGA-3’。
使用SYBR®Premix Ex TaqTMII试剂盒,进行Real-time PCR反应。
1.4 Western blot
分别提取总蛋白与核蛋白,应用不连续Tris-SDS聚丙烯酰胺凝胶垂直平板电泳系统,采用半干电转法,稀释相应一抗:FOXJ1(Abcam,ab220029,1∶1 000),MMP2、MMP9、TIMP1、TIMP2(Santa Cruz,sc13595、sc21733、sc365905、sc21735,1∶500),β-catenin、c-Myc、N-cadherin(Cell Signalling,#8480、#18583、#13116,1∶1 000),β-actin(Sigma,A 1978,1∶2 000),Histone H3(Cell Signalling,#4499,1∶2 000)孵育过夜,孵育对应二抗(1∶2 000),在化学发光检测仪上记录显色情况。
1.5 免疫组织化学染色
105例胃癌及其对应癌旁组织石蜡标本取自2007年11月至2009年2月西京消化病医院的手术病例,并经HE染色确诊。所有患者术前均未接受放化疗,术后接受常规化疗。患者相关信息及临床病理资料通过病例系统获取,其中男性67例,女性38例,临床分期依据美国癌症联合会第七版TNM分期标准。本研究经伦理委员会审核通过并获得知情同意。
采用SP免疫组化染色法,各一抗孵育浓度如下: FOXJ1(Abcam,ab220029)1∶400,β-catenin(Cell Signaling Technology,#8480)1∶200。
在对患者临床病理资料未知的前提下,由2名病理科医生参考Sinicrope[9]评分标准,采用半定量法,主要依据染色强度和染色细胞所占比率分别综合评分。
1.6 细胞免疫荧光染色
取对数生长期的细胞爬片,4%多聚甲醛固定20 min,1%BSA室温封闭30 min,稀释对应一抗(鼠抗人FOXJ1单克隆抗体1∶400,兔抗人β-catenin多克隆抗体1∶200)分别孵育,加入绿色荧光标记羊抗鼠二抗和红色荧光标记羊抗兔二抗(1∶200),加入DAPI染细胞核(1∶1 000),激光共聚焦显微镜下观察并拍照。
1.7 双荧光素酶报告基因实验
各组细胞以每孔6 000个细胞的浓度接种于96孔板上。将180 ng TOPflash或FOPflash表达质粒与12 ng pRL-TK(Renilla-TK-荧光素酶载体,Promega)共转染细胞,以pRL-TK 为内参,24 h后测定TOPflash/FOPflash值。TOPflash为报告质粒,FOPflash为阴性对照。
1.8 统计学分析
采用SPSS 20.0统计学软件进行分析。采用Spearman相关系数分析FOXJ1和β-catenin在胃癌中的表达相关性;采用t检验或χ2检验分析各实验中的组间差异。以P<0.05为差异有统计学意义。
2 结 果
2.1 FOXJ1可抑制胃癌细胞的迁移和侵袭能力
前期细胞划痕实验结果显示:上调FOXJ1可抑制胃癌细胞迁移,而下调FOXJ1可促进胃癌细胞迁移;Transwell迁移和侵袭实验结果提示:FOXJ1可抑制胃癌细胞迁移及侵袭入ECM的能力[4]。
2.2 FOXJ1抑制胃癌细胞中MMP2和MMP9的表达
采用real-time PCR和western blot分别检测上调/下调FOXJ1对高/低转移潜能胃癌细胞亚系MKN28M/MKN28NM中MMP2和MMP9表达的影响,结果显示,过表达FOXJ1可显著降低MKN28M中MMP2、MMP9的表达,而干扰FOXJ1可明显增加MKN28NM中MMP2、MMP9的表达(图1)。

图1 FOXJ1抑制胃癌细胞MMP2和MMP9的表达
2.3 FOXJ1促进胃癌细胞中TIMP1、TIMP2的表达
对上调/下调FOXJ1的胃癌稳转细胞系中TIMP1、TIMP2表达水平进行mRNA和蛋白水平检测,结果表明,MKN28NM-shFOXJ1细胞中TIMP1、TIMP2表达明显减弱,而MKN28M-FOXJ1细胞中,虽然TIMP1表达变化不明显,但是TIMP2表达明显增强(图2)。

图2 FOXJ1促进胃癌细胞TIMP2的表达
2.4 FOXJ1与β-catenin在胃癌中的表达呈负相关
通过免疫组化检测FOXJ1和β-catenin在胃癌组织中的表达,并分析二者表达相关性,结果发现,在105例胃癌组织中(TNM Ⅲ+Ⅳ期50例,淋巴结转移74例,远处转移12例),有42例呈β-catenin核表达阳性,51例呈FOXJ1表达阳性(图3),Spearman分析提示,胃癌组织中β-catenin核表达与FOXJ1表达呈负相关(相关系数为-0.228,P=0.003,表1)。

表1 FOXJ1和β-catenin在胃癌中的表达负相关

图3 免疫组化检测FOXJ1和β-catenin在胃癌中的表达负相关
2.5 FOXJ1可能参与调控胃癌细胞Wnt/β-catenin信号通路
首先通过免疫荧光染色,检测上调/下调FOXJ1对各稳转胃癌细胞系中β-catenin表达定位的影响,结果显示:下调FOXJ1可促进β-catenin在MKN28NM细胞浆中聚集,并增加细胞核中β-catenin表达;而上调FOXJ1可明显减少MKN28M细胞浆中β-catenin聚集,并抑制细胞核中β-catenin表达(图4A)。进一步检测β-catenin在胞核/胞浆中的分布,如图4B和图4C所示,FOXJ1对各亚系细胞总蛋白中β-catenin的量影响不大,但是下调FOXJ1可以增加MKN28NM细胞核蛋白中β-catenin的表达量,而上调FOXJ1可降低MKN28M细胞核蛋白中β-catenin的表达量。提示FOXJ1可能抑制β-catenin由细胞浆向细胞核移动。同时,我们还检测了FOXJ1对Wnt/β-catenin信号通路重要下游基因c-Myc、N-cadherin的表达量(图4D)和胃癌细胞中内源性T细胞因子(T cell factor,TCF)转录活性(图4e)的影响,发现下调FOXJ1可以显著升高MKN28NM细胞中c-Myc、N-cadherin表达量和TCF转录活性,而上调FOXJ1可降低MKN28M细胞中c-Myc、N-cadherin表达量和TCF转录活性。以上结果均提示FOXJ1部分抑制胃癌细胞Wnt/β-catenin通路活性。
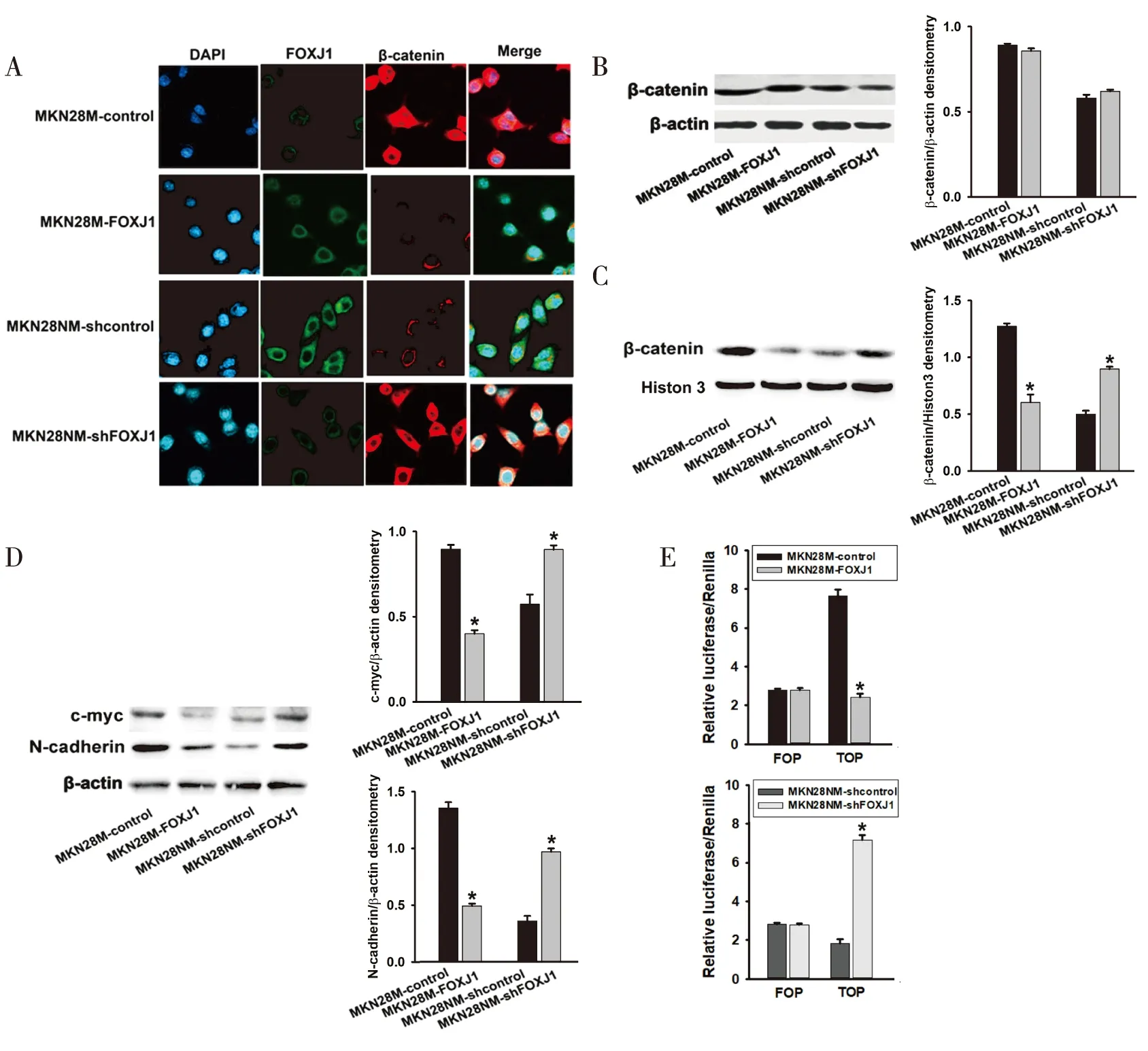
图4 FOXJ1可能抑制胃癌细胞Wnt/β-catenin信号通路
3 讨 论
侵袭与转移是影响胃癌转归的最重要因素。但我们对胃癌转移的调控网络仍知之有限,其中涉及多个基因、多条信号通路的交互作用,发现调控、连接胃癌转移的多条信号通路的关节点,对理解胃癌转移的分子机制,开发治疗胃癌的靶向药物具有重要意义。
FOX家族是一类新的参与肿瘤发生发展的重要转录分子。FOX家族成员在胃癌中的作用也受到广泛关注,研究发现,一方面,FOXCs[10-12]、FOXM1[13-14]、FOXK1[15-16]、FOXQ1[17]可能在胃癌中发挥促癌作用;另一方面,FOXD3[18]、FOXOs[19-21]、FOXF2[22]、FOXA1[23]可能抑制胃癌发生。FOXJ1是FOX家族的成员之一,除了在纤毛形成、胚胎发育分化、抑制自身免疫等生物学行为中起着重要调控作用外,近年也发现FOXJ1在不同肿瘤中发挥着不同作用。我们前期率先发现FOXJ1是抑制胃癌增殖和转移的重要转录因子:FOXJ1在胃癌中的表达下调,并与肿瘤浸润深度、TNM分期、淋巴结转移及远处转移密切相关,可作为影响胃癌患者生存的独立预测因素;FOXJ1阴性表达的患者多倾向于发生淋巴结转移;FOXJ1参与抑制胃癌细胞增殖、侵袭、迁移等多种恶性生物学行为。那么,FOXJ1抑制胃癌发生发展的分子机制是什么呢?目前国内外尚无研究报道。
MMPs与肿瘤细胞的侵袭和转移密切相关。其中,MMP-2和MMP-9直接参与肿瘤血管发生、降解ECM、破坏基底膜完整性。在本研究中,我们发现,过表达FOXJ1可显著降低MKN28M中MMP2、MMP9的表达,而干扰FOXJ1可明显增加MKN28NM中MMP2、MMP9的表达,提示FOXJ1可能通过抑制MMP2、MMP9抑制胃癌细胞的侵袭和转移。这与FOXL1抑制肾癌细胞侵袭和转移的机制相似[24]。另外,MMPs的活性受内源性因子组织型金属蛋白酶抑制物的特异调节。我们前期发现MMPs和TIMPs的表达失衡促进胃癌的发展过程[25]。因此,我们通过检测上调/下调FOXJ1的稳转胃癌细胞系中TIMP1、TIMP2的表达水平,发现MKN28M-FOXJ1细胞中TIMP2表达明显增强,而MKN28NM-shFOXJ1细胞中TIMP1、TIMP2表达明显降低,提示FOXJ1可能通过TIMP1、TIMP2抑制MMP9和MMP2的活性,进而减少胃癌ECM降解,抑制侵袭和转移的发生。
Wnt/β-catenin通路的异常活化是调控胃癌发生发展的关键机制。本实验中,我们首先通过Pearson相关性分析FOXJ1和β-catenin在胃癌中的共定位情况,发现二者的核表达呈负相关。进一步免疫荧光染色和核蛋白测定发现,FOXJ1可抑制β-catenin在胃癌细胞浆中聚集及核转位的发生。而β-catenin由胞浆进入胞核是Wnt/β-catenin激活的重要标志,β-catenin从细胞膜脱离,且胞浆内降解复合体形成受到抑制,导致β-catenin在胞浆中不断积聚,继而向核内转移,与TCF/LEF结合,启动MMP2、c-Myc等经典下游靶基因转录活化,促进细胞异常增殖分化、侵袭转移[26]。同时,Wnt/β-catenin通路还参与胃癌上皮间质转化(epithelial-mesenchymal transitions,EMT),间质标志物N-cadherin作为β-catenin的下游分子参与EMT,促进肿瘤细胞的侵袭与转移[27]。本实验进一步分析了FOXJ1是否通过Wnt/β-catenin信号转导调控胃癌进程,结果显示FOXJ1能够明显抑制β-catenin/TCF的转录活性以及Wnt/β-catenin通路下游靶蛋白c-Myc、N-cadherin的表达。因此,FOXJ1可能部分通过阻断Wnt/β-catenin激活,抑制胃癌侵袭和转移。而FOXJ1如何抑制Wnt/β-catenin信号通路尚有待深入探讨。
综上所述,本实验在课题组前期研究的基础上进一步验证了FOXJ1抑制胃癌侵袭和转移;FOXJ1通过TIMP1、TIMP2的内源性调节作用抑制MMP9和MMP2的活性,减少胃癌ECM降解;部分通过抑制Wnt/β-catenin通路的异常激活,进而抑制胃癌侵袭和转移。为揭示胃癌进展的机制网络、探寻胃癌预后靶点提供新的科学依据。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

