PD-1抑制剂治疗食管癌的临床研究新进展
马明全 综述 唐鹏 审校
作者单位:天津医科大学肿瘤医院食管肿瘤科,国家肿瘤临床医学研究中心,天津市“肿瘤防治”重点实验室,天津市恶性肿瘤临床医学研究中心(天津市 300060)
食管癌(esophageal cancer,EC)在所有恶性肿瘤中发病率排名第7 位、死亡率排名第6 位[1],对于局部进展期患者来说,术前行新辅助治疗能显著提高患者生存率[2-3],但70%患者在术后半年仍会出现转移或复发。在中国60%~70% EC 患者就诊时即为晚期病变[4],放、化疗是标准的晚期一线治疗方案,但往往治疗效果不佳。肿瘤免疫防御中T 细胞是起关键作用的免疫浸润细胞,肿瘤微环境中抗原提呈细胞与其之间的配体-受体相互作用会严格调控T 细胞激活,这些起到负调控作用的配体-受体被称为“免疫检查点”,主要包括细胞毒性T 淋巴细胞相关蛋白-4(cytotoxic T lymphocyte related-proteins,CTLA-4)、程序性细胞死亡因子-1(programmed cell death-1,PD-1)及其配体(programmed death-ligand 1,PD-L1)等。目前,PD-1 抑制剂的研究较多,根据KEYNOTE-181[5]和ATTRACTION-03[6]试验结果,帕博利珠单抗(pembrolizumab)和纳武利尤单抗(nivolumab)作为晚期EC 的二线治疗已经进入美国国立综合癌症网络(NCCN)指南。同时,PD-L1 的表达、肿瘤浸润淋巴细胞(tumor infiltrating lymphocytes,TILs)、肿瘤突变负荷(tumor mutation burden,TMB)和微卫星不稳定性(microsatellite instability,MSI)也可能是评估PD-1 抑制剂疗效有价值的生物标志物[7-8]。本文将主要对EC 的PD-1 抑制剂的临床研究进展,以及潜在标志物进行回顾和总结。
1 PD-1 抑制剂
PD-1 由 Ishida 等[9]在1992年发现,广泛分布于CD4+T、CD8+T 细胞等表面,与大量分布于肿瘤细胞和抗原提呈细胞表面的PD-L1 结合后,直接抑制T 细胞激活通路[4]。相比于CTLA-4,PD-1 主要在感染时发挥T 细胞活性抑制和自身免疫抑制作用,减轻 T 细胞对临近组织的破坏。肿瘤细胞利用 PD-1 对组织的天然保护生理特性,促使 PD-L1 表达上调,以保护自身免受免疫系统监视及杀害,从而发生免疫逃逸,此过程即适应性免疫抑制[10]。因此,PD-1 抑制剂通过阻断PD-1 的负性免疫调节机制,使T 细胞恢复免疫活性,从而发挥抗肿瘤效应。目前国内外获得批准上市的PD-1 单抗主要包括:美国默沙东公司研发的帕博利珠单抗、美国百时美施贵宝公司研发的纳武利尤单抗和中国恒瑞公司研发的卡瑞利珠单抗等。
2 临床研究进展
2.1 帕博利珠单抗
2.1.1 帕博利珠单抗单药单臂研究 KEYNOTE-028是一项国际性、多中心、多队列、ⅠB 期的临床试验[11-12],纳入23 例已接受过铂类治疗且PD-L1 阳性(表达水平>1%)的晚期EC 患者,总体客观缓解率(objective response rate,ORR)为30%。食管鳞癌(esophageal squamous cell carcinoma,ESCC)组18 例,食管腺癌(esophageal adenocarcinoma,EAC)组5 例,ORR 分别为28%和40%。所有患者中有9 例(39%)发生了治疗相关的不良事件(adverse event,AE),其中最常见的是食欲下降、淋巴细胞计数减少和皮疹,无患者出现4 级AE。该试验首次确认帕博利珠单抗在PD-L1 阳性的晚期EC 患者中具有良好的抗肿瘤活性和可控的不良反应。
基于上述研究,帕博利珠单抗后续开展了一项接受过2 次及以上系统治疗后进展的晚期或转移性EC 的Ⅱ期研究KEYNOTE-180[13],ORR 为9.9%,其中63 例ESCC 和58 例食管胃连接处癌(esophagogastric cancer,EGC)患者的ORR 分别为14.3%和5.2%,PD-L1 阳性组和PD-L1 阴性组的ORR 分别为13.8% 和6.3%。同时,15 例(12.4%)患者出现了3~5 级治疗相关AE,仅1 例发生治疗相关肺炎死亡。总体而言,KEYNOTE-180 进一步确认了帕博利珠单抗较持久的抗肿瘤活性和可控的AE 发生率(表1)。
2.1.2 帕博利珠单抗单药双臂研究 KEYNOTE-181 试验明确了帕博利珠单抗单药二线治疗晚期EC的治疗效果[5],该试验是一项纳入628 例晚期/转移性ESCC/EAC 患者的随机Ⅲ期研究,帕博利珠单抗组和化疗组中位总生存时间(median overall survival,mOS)均为7.1 个月。对于联合阳性评分(combined positive score,CPS)≥10 亚组,尽管两组中位无进展生存(medianprogression-free survival,mPFS)无明显差异,但帕博利珠单抗单药治疗使患者mOS 延长1.6 个月(9.3 个月vs.6.7 个月,P=0.007 4),12 个月总生存(overall survival,OS) 率也升高23%(43%vs.20%)。该试验在401 例ESCC 亚组中取得了较好的生存获益,帕博利珠单抗组患者mOS 延长1.1 个月(8.2 个月vs.7.1 个月,P=0.009 5),12 个月OS 率分别为39.4%和24.9%。而CPS ≥10 分的EAC 亚组两组mOS 相近(6.3 个月vs.6.9 个月),但 1年OS 率有明显提高(23%vs.15%)。在AE 方面,两组分别有6%的患者因不可耐受终止治疗,5 例死于不良反应,但帕博利珠单抗组3~5 级治疗相关AE 发生率显著低于化疗组(18.2%vs.40.9%)。
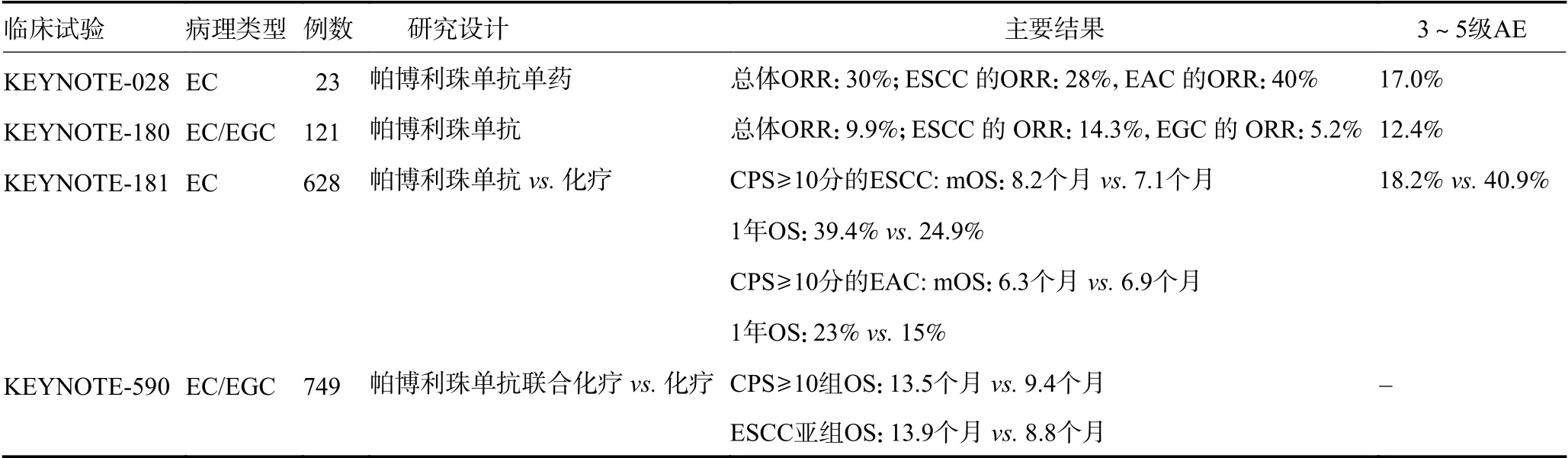
表1 帕博利珠单抗治疗的相关研究
2.1.3 帕博利珠单抗联合治疗 Keynote-590 随机对照研究对比了帕博利珠单抗联合化疗和化疗一线治疗晚期EC/EGC 患者的疗效[14],所有患者仅显示了2.6 个月的OS 获益,在CPS≥10 组OS 提升了4.1 个月(13.5 个月vs.9.4 个月,P<0.001)。对于ESCC 亚组(占73%),联合治疗在CPS≥10 的患者中生存优势极为明显,较化疗组相比mOS 提高了5.1 个月(13.9个月vs.8.8 个月,P<0.000 1)。而CPS 评分不高组其生存时间也提高了2.8 个月(12.6 个月vs.9.8 个月,P=0.000 6)。作为对晚期EC/EGC 一线免疫治疗探索的试验,Keynote-590 取得的良好结果将会推动更多的一线免疫治疗研究。此外,一项帕博利珠单抗联合放化疗作为局部晚期ESCC 术前新辅助方案的Ⅱ期临床研究[15],共纳入26 例完成手术的患者,ypT0N0 占23.1%,ypT0 占46.1%,在安全性方面,免疫联合治疗并未明显增加治疗相关AE。提示帕博利珠单抗联合治疗可能是局部晚期可切除EC 术前新辅助治疗的更佳方案,但仍需更多大样本随机对照研究来进一步验证。
2.2 纳武利尤单抗
2.2.1 纳武利尤单抗单药单臂研究 ATTRACTION-01 是一项针对至少二线治疗无效或不可耐受的晚期ESCC 患者的Ⅱ期研究[16]。64 例患者ORR 为17%,mOS为10.8 个月,3 级以上治疗相关AE 发生率为17%,主要包括肺部感染(6%)、脱水(3%)、间质性肺疾病(3%)等,未出现治疗相关的死亡,这表示纳武利尤单抗单药治疗有良好的抗肿瘤活性且安全性可控(表2)。
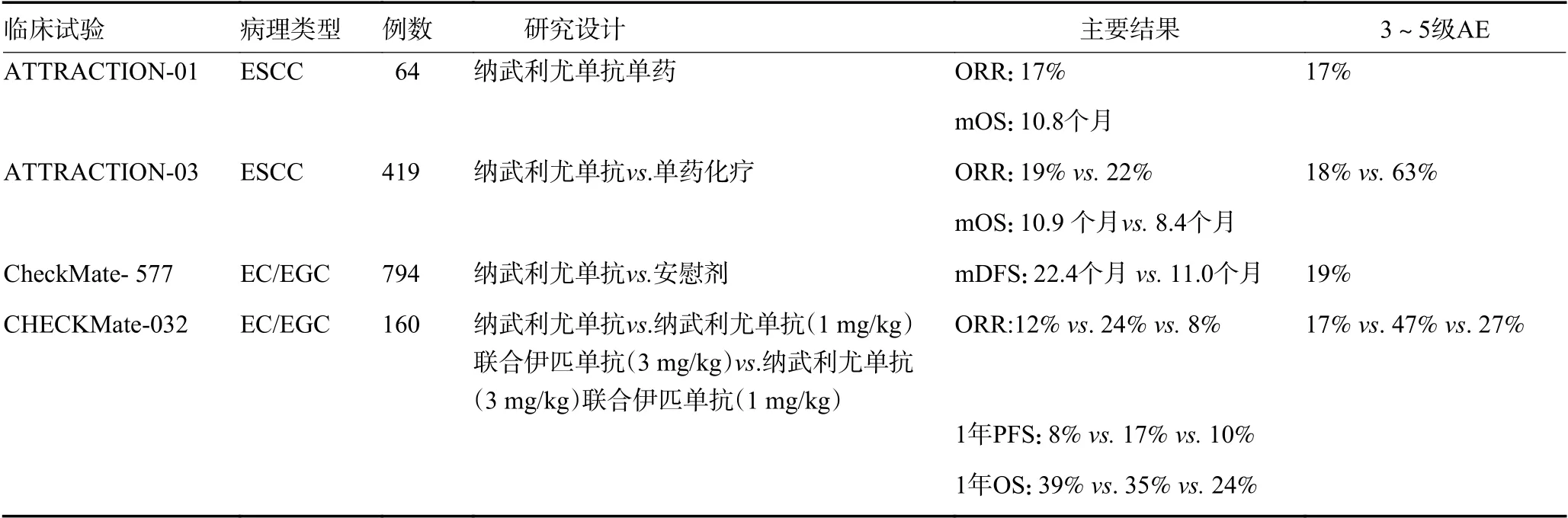
表2 纳武利尤单抗治疗的相关性研究
2.2.2 纳武利尤单抗单药双臂研究 ATTRACTION-03 作为一项针对无法切除的晚期或复发ESCC 患者二线治疗的Ⅲ期试验[6],共纳入患者419 例,研究结果使纳武利尤单抗成为全球首个在治疗晚期ESCC 患者时不依赖PD-L1 表达状态使OS 显著延长的PD-1抑制剂。尽管纳武利尤单抗组的ORR 低于化疗组(19%vs.22%),但纳武利尤单抗的中位缓解持续时间明显更长,OS 也相对延长2.5 个月(10.9 个月vs.8.4个月,P=0.019),3~4 级AE 也明显减少(18%vs.63%)。其中,两组最常见的3 或4 级治疗相关不良事件分别是贫血(2%)和中性粒细胞计数下降(28%)。
CheckMate 577 是全球首项针对接受过三联方案治疗后的EC/EGC 患者术后辅助纳武利尤单抗治疗的随机对照的Ⅲ期临床研究[17],其结果也证实了对该目标人群术后行纳武利尤单抗辅助治疗可显著延长患者无病生存期。该试验纳武利尤单抗治疗组(532 例)和安慰剂对照组(262 例)的中位无疾病生存(median disease-free survival,mDFS)分别为22.4 个月和11.0 个月(P<0.001),且两组3 级或4 级治疗相关AE 分别为13%和6%。其中,70%的患者为EAC,30%的患者为ESCC,使用纳武利尤单抗治疗的患者在DFS 方面得到显著改善。2021年中国临床肿瘤学会(CSCO)已公布EC 指南的更新亮点,纳武利尤单抗将成为这类接受过新辅助放化疗、术后未达到病理完全缓解率(pathological complete response,pCR)的患者辅助治疗标准方案(ⅠA 类证据,Ⅱ级专家推荐)。
2.2.3 纳武利尤单抗的联合治疗 CHECKMate-032是一项对比纳武利尤单抗和联合伊匹单抗(ipilimumab)后线治疗转移性EC/EGC 的疗效和安全性的Ⅰ/Ⅱ期临床研究[18],研究共入组160 例局部晚期或转移性胃癌、EC/EGC 患者,其中纳武利尤单抗组(3 mg/kg)、纳武利尤单抗(1 mg/kg)+伊匹单抗(3 mg/kg)组和纳武利尤单抗(3 mg/kg)+伊匹单抗(1 mg/kg)组的ORR 分别为12%、24% 和8%,12 个月的PFS 分别为8%、17% 和10%,12 个月OS 分别为39%、35%和24%。3 组中分别有17%、47%和27%的患者报告了与治疗相关的3/4 级AE,其中发生率均为最高的是谷丙/草转氨酶异常。鉴于该研究中纳武利尤单抗联合伊匹单抗化疗在难治EC 患者中显示出抗肿瘤活性及安全性可控,一项评估纳武利尤单抗联合伊匹单抗一线治疗晚期EC 的Ⅲ期临床研究CheckMate-648 正在招募中。
2.3 卡瑞利珠单抗
2.3.1 卡瑞利珠单抗单药单臂研究 NCT02742935是一项中国范围内卡瑞利珠单抗后线治疗晚期ESCC 的Ⅰ期临床研究[19],30 例入组患者的ORR 为33.3%,mPFS 为3.6 个月,AE 发生率为83.3%,其中3 级以上治疗相关AE 为10%,无治疗相关死亡。由此可见,卡瑞利珠单抗具有可控的安全性和良好的抗肿瘤活性(表3)。

表3 卡瑞利珠单抗治疗的相关性研究
2.3.2 卡瑞利珠单抗单药双臂研究 基于NCT02742935成果,江苏恒瑞医药股份有限公司又开展了一项Ⅲ期临床试验ESCORT(NCT03099382)[20],与化疗组相比,卡瑞利珠单抗作为二线治疗显著提高了晚期或转移性ESCC 患者的OS,使mOS 提高了2.1 个月(8.3 个月vs.6.2 个月,P=0.001),ORR 提高13.8%(20.2%vs.6.4%)。两组3~5 级治疗相关的AE 发生率分别为25%和39%,包括贫血(3%vs.5%)、肝功能异常(2%vs.<1%)和腹泻(1%vs.4%)。10 例治疗相关死亡患者中,3%发生在卡瑞利珠单抗组(3 例死于不明原因,1 例小肠结肠炎,1 例肝功能异常,1 例肺炎和1 例心肌炎),1%发生在化疗组)2 例死于不明原因,1 例消化道出血)。2020 版CSCO 的EC 诊治指南[21]已经将卡瑞利珠单抗列为晚期EC 二线治疗Ⅰ级专家的推荐方案。
2.3.3 卡瑞利珠单抗联合治疗 NCT03603756 研究是一项探索卡瑞利珠单抗联合阿帕替尼联合化疗一线治疗晚期ESCC 的中国单中心Ⅱ期试验[22],共入组30 例ESCC 患者,ORR 为80% ,DCR 为96.7%,mPFS 为6.85 个月。该研究表明,卡瑞利珠单抗联合阿帕替尼联合化疗可能成为局部进展期ESCC 的治疗方式,但该方案有较高的AE 发生率,潜在免疫相关AE 发生率为73.3%,其中20%发生3~4 级免疫相关AE,因此值得进一步研究探索。
3 生物标志物
3.1 PD-L1 和TILs
目前,筛选PD-1 抑制剂的最大获益人群是主要研究方向,肿瘤细胞中PD-L1 的表达是预测PD-1 抑制剂治疗效果的潜在生物标志物[23-25]。PD-L1 表达水平可以通过肿瘤细胞阳性比例评分(tumor proportion score,TPS)和CPS 来评估,TPS 评分被定义为任意强度PD-L1 膜染色的肿瘤细胞占肿瘤细胞总数百分比。而CPS 评分综合考虑了肿瘤和免疫细胞的因素,是根据PD-L1 阳性细胞(肿瘤、淋巴和巨噬细胞)的总数与肿瘤细胞总数的比较来进行评估。KEYNOTE-180[13]试验中47.9%患者CPS 评分≥10 分,并定义为PD-L1(+),该组6 个月PFS(22%vs.10%)和9 个月PFS(14%vs.5%)均高于PD-L1(-)组。在KEYNOTE-181 试验[5]中,PD-L1(+)也是促使帕博利珠单抗发挥更好疗效的关键,而PD-L1(-)亚组并未得到帕博利珠单抗关于ORR 和OS 的优势结果。
然而部分研究表明,PD-L1 高表达并不能完全转化为PD-1 抑制剂的治疗获益[26-27],这可能与TILs 的参与有关。在肿瘤发展和各种治疗的应用过程中,TILs 迁移到肿瘤组织中作为抗肿瘤反应的效应物。肿瘤微环境中高水平的TILs 已被证实与EC[28]、肺癌[29]、乳腺癌[30]等肿瘤患者更好的预后相关。此外,PD-L1 和TILs 结合更有意义,PD-L1(-)肿瘤浸润淋巴细胞(+)组的患者具有最长的OS 和无疾病生存期(disease-free survival,DFS),而PD-L1(+)肿瘤浸润淋巴细胞(-)组的患者具有最短的OS 和DFS[8],且基于肿瘤细胞上高表达的PD-L1 和TILs 计算的免疫评分,相比TNM 分期有更好的预测准确性[28]。研究发现,TILs 也与PD-1/PD-L1 抑制剂治疗黑色素瘤的临床益处有关[31-32]。在KEYNOTE-001[33]帕博利珠单抗治疗黑色素瘤患者的研究中,治疗前肿瘤样本中的CD8+T 细胞密度在疾病缓解组更高。对于EC 而言,TILs 或联合PD-L1 表达对于PD-1抑制剂疗效的关系仍不确定,需要在未来提供更多的证据。
3.2 TMB 和MSI
TMB 是指肿瘤细胞的基因突变总数,TMB 较高的肿瘤细胞可能产生更多的新抗原,诱导特异性T 细胞应答,进而增强抗肿瘤免疫[34]。有研究通过定向综合基因组分析(CGP)、外显子组测序检测TMB,共描述了来自多中心的100 000 例癌症患者TMB 的分布情况,并测试了100 余种肿瘤类型中体细胞变化与TMB 之间的关系,发现许多疾病类型的高TMB 患者可能会受益于免疫疗法[35]。Yarchoan 等[36]也发现TMB 与PD-1 抑制剂的反应存在显著的相关性。不同癌症的TMB 数目不同,根据西方国家的报道,TMB 在EC 中表达水平较低[37]。然而,对中国EC 患者的分析显示,TMB 处于中上水平[7]。NCT02915432的Ⅰb/Ⅱ期试验[38]发现,难治性晚期ESCC 患者接受特瑞普利单抗治疗后,11 例(23.4%)高TMB(≥12 个突变/Mb)得患者在ORR 或OS 方面无显著优势。因此,需要更多的研究来判断TMB 在EC 患者中的预测价值。但与基于免疫组织化学检查的PD-L1 评估相比,TMB 检测既耗时且对标本质量要求更高。因此,TMB 不会取代PD-L1 的预测地位,可作为一项对预后预测有益补充的指标。
错配修复基因是指在DNA 复制过程中修复错误合成核苷酸的基因,缺乏这些基因意味着DNA 错配修复(mismatch repair,dMMR)的缺失,DNA 可能出现大量短重复序列(微卫星),MSI 即为肿瘤中某个微卫星位点由于重复单元的插入或缺失而出现新的微卫星等位基因的现象[34]。MSI 可分为高度(high-frequency microsatellite instability,MSI-H)、低度(lowfrequency microsatellite instability,MSI-L)和稳定(microsatellite stability,MSS)3 种类型。Chalmers 等[35]发现83% 的MSI-H 患者具有高表达TMB。2015年,Le 等[39]证实MSI 状态与帕博利珠单抗治疗结直肠癌患者临床获益相关。因此,MSI 在免疫治疗中的价值得到关注。此后,一项研究(NCT01876511)纳入12 种不同类型肿瘤,所有患者均为晚期dMMR缺陷并予以PD-1 抑制剂治疗,发现分别有53%和21%的患者获得了客观的影像缓解和完全缓解[40]。截至目前,NCCN 指南已经推荐帕博利珠单抗作为包括EC 在内的MSI-H 或dMMR 实体癌的二线或后续治疗。研究表明EC 组织中的dMMR 仅为4.35%[7],KEYNOTE-012 研究中MSI-H 患者为17%(4/24)[41],CHECKMATE-032 研究中MSI-H患者为18%(11/61)[18]。因此MSI 在EC 中是否可成为重要的预测因子仍是未来研究的重点领域。
4 结语与展望
尽管PD-1 抑制剂给EC 患者带来显著获益,但仍存在亟需解决的问题。首先,需明确最佳获益人群及治疗最佳时期、最佳周期等,盲目使用PD-1 抑制剂只会增加不良反应发生率。因此,最直接有效的预测生物标志物及其最佳截断值的界定需要不断优化。其次,在PD-1 抑制剂单药治疗效果有限的同时,应多开展其与化疗、放射治疗、靶向药物或其他免疫调节剂联合使用的临床试验,寻找PD-1 抑制剂最佳联合治疗方案将会为EC 治疗带来更大优势。

