原发于小肠的骨外黏液样软骨肉瘤1例*
陈镜 管丽丽 廖刚
作者单位:①重庆医科大学附属第一医院核医学科(重庆市400016);②胃肠外科
患者女性,66 岁,因“腹胀纳差3 个月,腹泻、双下肢水肿2 个月”,于2017年5月至重庆医科大学附属第一医院就诊。既往无肿瘤家族史。增强CT 提示(图1)盆腔较大占位性病变,与邻近小肠关系密切,压迫右侧输尿管盆段,导致右侧肾及输尿管积水。此后患者行右“剖腹探查、盆腔巨大肿瘤切除、回肠及乙状结肠部分切除、肠吻合、切口疝修补术”。术后病理切片(H&E染色)提示:小肠恶性肿瘤。免疫组织化学结果显示(图2):Vimentin(+),S100 灶(+),NSE(+),TLE-1 灶(+),SATB2(+),CD11(-),Dog-1(-),SMA(-),CD34(-),CK(-),EMA(-),MBM2(-),CR(-),MYOD1(-),CD99(-),Bcl-2(-),Ki-67 10%(+)。EWSR1 基因FISH 检测提示:EWSR1 易位比率33%,阈值>15%。C-kit 基因突变检测:Exon-9、Exion-11、Exon-13、Exon-17 均为野生型。PDGFRA 基因突变检测:Exion-12、Exion-18 均为野生型。最终病理诊断:结合组织形态学、免疫组织化学及基因检测结果,考虑骨外黏液样软骨肉瘤(extraskeletal myxoid chondrosarcoma,EMC)。患者术后恢复可,术后未行放化疗等其他治疗,未规律随访。
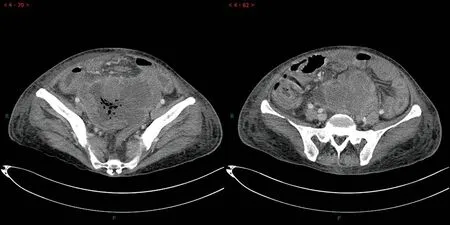
图1 2017年5月患者腹部增强CT 检查
2018年11月患者出现下腹疼痛,于重庆医科大学附属第一医院再次就诊。增强CT 提示:下腹部及盆腔内多发囊实性肿块影,右侧输尿管下段受侵,伴近端尿路扩张积水及右肾功能不良。18F-FDG PET/CT 提示(图3):腹腔及盆腔多发囊实性占位性病变,实行部分代谢活性增高,考虑肿瘤复发,盆腔右侧病变累及输尿管致右肾积水。结合患者既往病史及增强CT 与PET/CT 结果,考虑EMC 复发。本院胃肠外科医生考虑患者腹部包块较大,已出现相关脏器压迫症状,建议手术治疗。遂全麻下行“剖腹探查、肠黏连松解、腹腔巨大包括切除、联合部分小肠、盲肠,右侧部分腰大肌、右侧部分输尿管及右侧部分髂外动脉切除、右侧输尿管吻合及双‘J’管置入、小肠-小肠吻合、回肠-升结肠吻合术”。术后病理提示(图2):腹部黏液间质中散在短梭型和圆形细胞,部分胞质嗜酸,核空泡状、核仁明显,核分裂像少见,局部区域见坏死。结合患者既往病史、原切片形态学特点,符合EMC。肿瘤累及肠管浆膜、肌层及黏膜下层;右侧输尿管切缘外膜亦见肿瘤累及。患者术后恢复尚可,临床医生建议患者术后行姑息化疗,患者拒绝。

图2 患者小肠EMC 病理检查及免疫组织化学法检测标记物表达
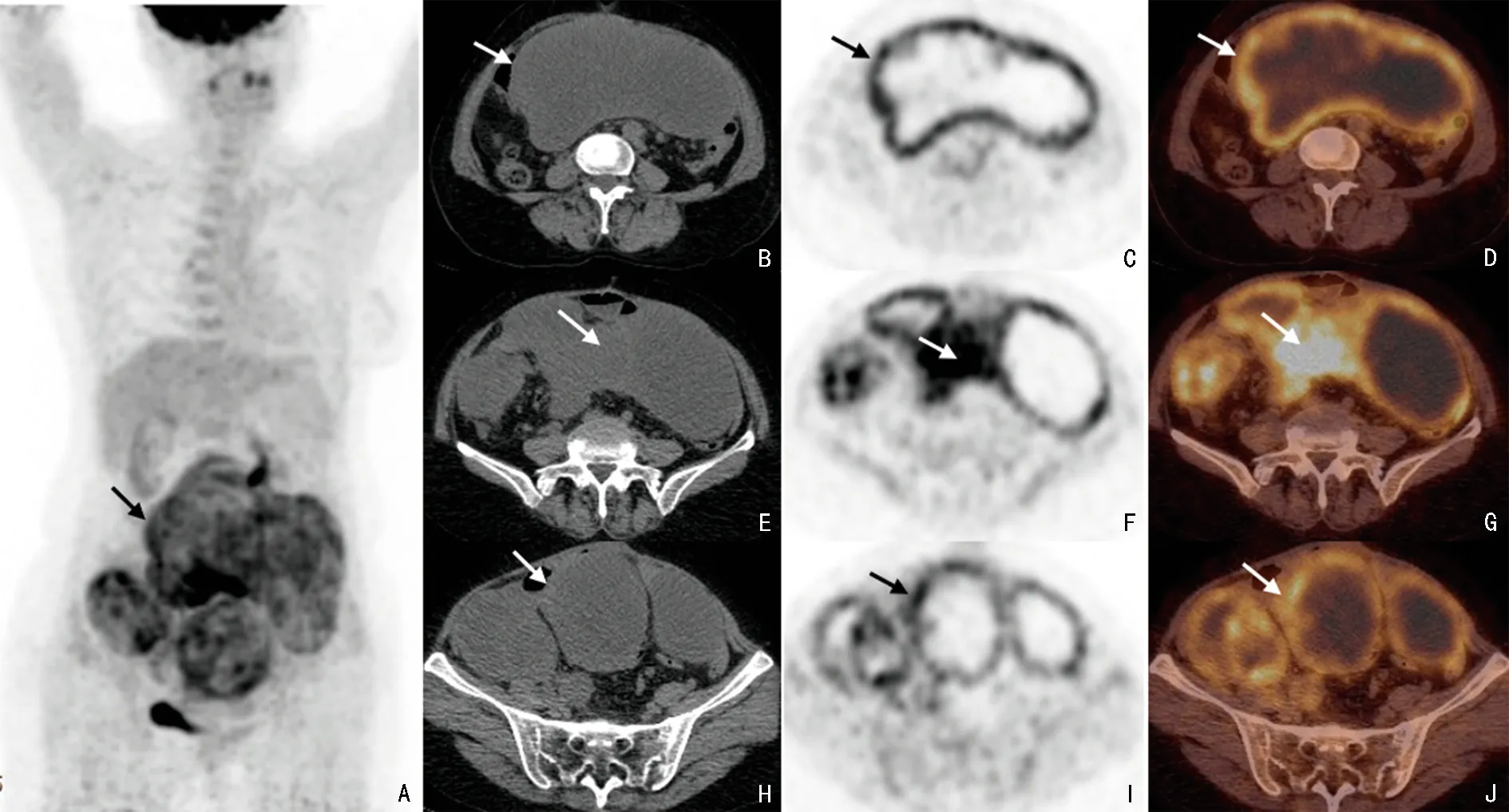
图3 2018年11月患者18F-FDG PET/CT 检查
小结EMC 是一种罕见的染色体易位相关软组织肉瘤,其特征是黏液样基质内均匀排列的梭形细胞呈网状生长[1-2]。EMC 生长缓慢,好发生于四肢,尤以下肢多见,约占70%,其次是躯干及上肢,但也有部分不常见的部位,如阴囊和手指[3-4]。本例患者EMC 发生在小肠这一罕见的部位。目前,国内外尚缺乏原发于小肠的EMC 病例报道。虽然EMC 最初被认为是软骨肉瘤的一种变体,但是由于缺乏软骨分化,世界卫生组织(WHO)将其归类为分化不确定的恶性间充质肿瘤[5]。EMC 恶性程度较低,但有较高的局部复发转移几率[6]。研究表明[7-8],EMC 局部复发率在35%~48%,远处复发率高达50%。EMC 患者局部复发风险高,建议在常规手术切除的基础上增加放疗,可改善预后。本例患者的EMC,第1 次术后1年半后出现复发;患者第1 次发病仅行手术治疗,未进一步行化疗或放疗,有可能是导致复发的原因。
影像学提供的信息可以帮助临床医生诊断EMC及更好地了解EMC 累及的范围。本例患者CT 增强表现为腹腔及盆腔多发囊实性肿块,以囊性成分为主,呈分叶状,边界清晰,可见分隔,实性部分与囊性部分分界不清。而复发后18F-FDG PET/CT 表现为实性成分FDG 摄取增高,囊性成分未见FDG 摄取,除腹盆腔外,全身其余部位未见肿瘤转移征象。
综上所述,EMC 发生在小肠较为罕见,PET/CT为临床提供了有无远处转移的信息,为临床医生制定下一步治疗计划提供了影像学依据。而手术切除肿瘤的基础上增加放疗是治疗EMC 的有效手段,可以减少复发风险,改善疗效。

